红花酢浆草试管根茎诱导和快速繁殖研究
李春芳,罗吉凤,程治英,杨俊波
(中国科学院昆明植物研究所,西南野生生物种质资源库,云南 昆明 650204)
红花酢浆草(Oxalix rubra St.Hill)为酢浆草科(Oxalidaceae)无茎直立的多年生草本植物,地下块状根茎呈纺锤形。叶片丛生状具长柄,掌状复叶小叶3枚倒心脏形,昆明地区元旦前后开花,花大,每株有花8~12朵,深桃红色。植株整齐,叶色青翠,覆盖地面迅速,能抑制杂草生长,是一种良好的观花地被植物。花期长,花色艳丽,可作花坛、盆栽或装饰岩石隙缝等。该物种从美国引进昆明只开花不结种子,主要繁殖方式为分株,即分植根茎,繁殖速度慢,不能满足市场需求,而且长期用根茎进行无性繁殖,生长在土中的根茎病毒逐年积累致使植株开出的花变小变少,品质下降。因此我们采用组织培养方法,对其繁殖技术进行探讨,以求短期内大批量生产优质种苗,满足市场需求。
1 材料与方法
1.1 试验材料
供试材料为地下纺锤形根茎,来源于昆明,经常规无菌消毒后得到无菌材料供试验用。
1.2 培养条件
基本培养基为MS,诱导根茎发芽的培养基:①MS+BA 2 mg/L+NAA 0.2 mg/L,②MS+BA 1 mg/L+NAA 0.5 mg/L,③MS+BA 0.5 mg/L+NAA 0.2 mg/L;诱导生根培养基:④1/2 MS+NAA 1 mg/L;诱导珠芽培养基:⑤MS+PP3331.5 mg/L;⑥MS+PP3332 mg/L,⑦MS+PP3335 mg/L;诱导试管根茎的培养基:⑧MS+NAA 0.05 mg/L+AC 0.5 g/L+蔗糖8%,⑨MS+NAA 0.1 mg/L+蔗糖8%,⑩MS+NAA 0.2 mg/L+AC 0.5 g/L+蔗糖8%,⑪MS+NAA 0.5 mg/L+AC 0.5 g/L+蔗糖8%。培养基①~⑦均附加0.56%琼脂固化,蔗糖浓度为3%。以上培养基pH值5.5~5.8,培养温度(25±3)℃,光照强度为40 μmol/m2/s,光照时间为12 h/d。
2 结果与分析
2.1 微型扦插和丛生芽繁殖
将无菌块茎接种在培养基①上,根茎培养约70 d长芽,平均6芽/块,将生长出的芽割下,继代在培养基①上的小芽经过60 d培养,丛生芽增殖率为1∶10左右(见图1)。这种丛生芽可反复切割继代,用于丛生芽的增殖,也可切割成单个芽条在培养基④上培养,约20 d在长高的同时也长出带根的可移栽的完整试管苗。当小芽接种在培养基②上,经过60 d培养,丛生芽增殖率约为1∶6。将从根茎上切割的小芽培养在培养基③上,经过约3个月培养可一次成苗且生根,但无新芽产生,这种完整试管苗不仅可用于出瓶移栽,还可以将植株茎切为2个节1段,用于微型扦插,达到增殖目的。
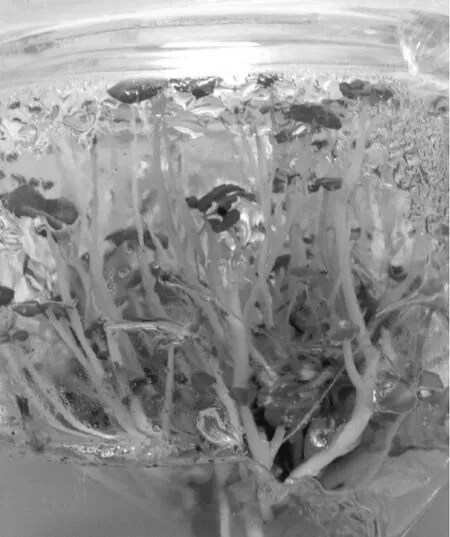
图1 珠芽诱导
2.2 珠芽繁殖
将切割的芽条接种在培养基⑤~⑦上培养,每种培养基作为1个处理,40个芽条/处理,重复3次。培养30 d后,培养基⑤上培养的材料100%长出珠芽,培养基⑥、⑦上培养的芽条长出的根有黑化现象,说明PPP333浓度太高对根有伤害。此外,在这2种培养基上培养的芽条培养30 d后,仅形成75%的珠芽。说明培养基⑤作为诱导珠芽的培养基较合适。在茎的叶腋处诱导出的珠芽呈白色,长×宽=0.5 cm×0.3 cm,随着培养时间的延长变为绿色。珠芽产生的部位在茎的叶腋处,在茎的基部也能形成丛生芽(见图2)。珠芽形成后无生长迹象,取下珠芽放在培养基①~③上培养5 d后均能形成芽,恢复生长,长大成苗。笔者诱导出的珠芽是由芽条的腋芽肥大而形成的珠状结构。由珠芽发育的植株健壮,移栽成活率也高。

图2 丛生芽
2.3 试管根茎的诱导
将高约4 cm的芽条接种在培养基⑧~⑪上,每瓶10个芽条,重复6次,培养90 d后统计芽条产生根茎数。结果显示,培养基⑧~⑪上的芽条均产生了根茎,但培养基⑪最佳,表现为每个培养瓶平均结根茎数为28个,并且根茎较大(长在0.6 cm以上,宽在0.5 cm以上)(见图3)。根茎产生的方式为每个芽条先生根然后根尖部分膨大,形成纺锤形的根茎(见图4)。

图3 试管根茎诱导

图4 根茎的发生过程

图5 移栽苗


图6 试管苗规模化生产
2.4 苗的生根和移植
将以上各种繁殖方法形成的试管芽条(除微型扦插一次成苗和试管根茎可直接种入土中外)切割成2~3 cm接种在培养基④上,培养20 d后开始生根,约30 d根诱导率在95%以上,平均每株长根3条左右,当苗高6~7 cm时便可移栽,移栽基质用腐叶土∶生黄土=1∶1,经过5%甲醛水溶液消毒密封24 h后打开2~3 d便可移苗。试管苗从培养瓶中取出时不要伤及植株的叶片和根尖,移后注意保湿和通风,待新叶长出后去掉保湿用塑料布,可以按常规管理,移栽成活率在90%以上(见图5、图6)。
3 讨论
3.1 各种繁殖技术比较
本试验得到组培快繁的红花酢浆草试管苗近2万株,并在生产中推广应用。利用短枝微型扦插培养90 d可一次成苗,方法简便。若用此法快繁,60 d增殖速率为1∶8。利用丛生芽增殖,增殖速度快(约1∶10),繁殖量大,1个繁殖周期仅要80 d,可以作为规模化生产的主要方式。珠芽繁殖和试管根茎诱导的技术也可以利用,此法为笔者的创新技术。优点是移植成活率高,缺点是手续复杂、成本加大。
3.2 母瓶保存
笔者选择红花酢浆草的丛生芽和试管苗作为离体保存的培养物类型,于8月放入温度为12℃、相对湿度为60%的条件下保存母瓶,为防止母瓶培养基干燥,在瓶盖口用保鲜膜密封,保存10个月后培养物良好。次年5~6月取出母瓶用于快繁生产,6~7月供应瓶苗移栽苗,当年可以开花。本试验为红花酢浆草持续利用提供了技术支撑。关于红花酢浆草的离体珠芽和试管根茎的诱导等繁殖技术和规模化生产未见报道。
[1]李霖,宋宜颖,鲁润龙,等.紫叶酢浆草的组织培养[J].植物生理学通讯,2002,38(4):360.
[2]王金刚,吴多,付慧娟,等.大花酢浆草的组织培养与快繁[J].植物学报,2010,45(2):233~235.
[3]王连润,杨松光,胡忠荣,等.草莓试管苗移栽基质研究[J].西南农业学报,2010,23 (4):1374~1376.
[4]孟静静,李慧,宋旭丽,等.红莓组织培养及快速繁殖技术[J].西南农业学报,2010,23 (6):2155~2157.
[5]陈丽静,马爽,李丽丽,等.东方百合“索蚌”离体培养快繁体系建立[J].西南农业学报,2010,23(5):1652~1654.

