小柴胡汤超微饮片与传统饮片药效学剂量对比研究
张祥伟, 陈佩虹, 金晓艳, 陈育尧, 黄添友, 佟 丽*
(1.南方医科大学中医药学院,广东广州 510515;2.广东九天绿药业有限公司,广东河源 517000)
中药超微饮片是随着现代超微粉体技术的发展而兴起的新型中药饮片。它以中药材细胞破壁为目的,使细胞内有效成分快速、大量的释放出来,提高了中药材的利用率,从而可以减少临床用量[1-2]。我们前期对小柴胡汤超微饮片与传统饮片化学成分溶出特性进行了对比研究,结果表明超微饮片有效成分溶出速度显著加快,水溶性成分、总黄酮及黄芩苷溶出量是传统饮片的2倍左右[3]。本实验在此基础上进一步探讨小柴胡汤两种饮片药效学剂量的相关性,为中药复方超微饮片的临床使用提供科学依据。
1 实验材料
1.1 药物与试剂 小柴胡汤超微饮片与传统饮片(药物组成:柴胡24 g、黄芩9 g、半夏 9 g、党参 9 g、生姜9 g、大枣9 g、甘草9 g)由广东九天绿药业有限公司提供(批号20080901);卡介苗干混悬剂(Bacillus Calmette-Guerin,BCG,60 mg/支,中国药品生物制品检定所,批号2008-1);脂多糖(Lipopolysaccharides,LPS,10mg/支,Sigma 公司);联苯双酯滴丸(北京协和药厂,批号08040108);丙氨酸氨基转移酶试剂盒(Alanine Aminotransferase Kit,中生北控生物科技股份有限公司,批号:091211-200907);天门冬氨酸氨基转移酶试剂盒(Aspartate Aminotransferase Kit,中生北控生物科技股份有限公司,批号090591-200908)。1640干粉(GIBCO,批号1279327);新生牛血清(GIBCO,批号 600202);噻唑蓝(MTT,Sion-American Biotec,批号2497B516);二甲基亚砜(Dimethyl sulfoxide,DMSO,Sigma公司,批号20080126)。
1.2 动物 SPF级昆明种小鼠,♂性,体重18~22 g,由南方医科大学实验动物中心提供。实验动物合格证号:NO:0057746,SCXK(粤)2006-0015。
1.3 仪器 Anke TDL-40B型离心机;Sartorius CP225D型电子天平;意大利ECHO LCD全自动生化分析仪 ;英国 RSBiotech GalaxyS 241-220 CO2培养箱;德国LEICA XDP-EC型倒置显微镜;日本O-lympus BH-2型显微镜;Sigma Diagnostics 201型酶联免疫检测仪;德国Leica EG1600型包埋仪;德国LEICA RM 2135型切片机。
2 实验方法
2.1 对免疫性肝损伤小鼠血清谷丙转氨酶(ALT)、谷草转氨酶(AST)活性的影响 取小鼠108只,随机分成空白对照组、模型对照组、联苯双酯组(0.15 g/kg)、传统饮片1组(20.28 g/kg)、传统饮片2组(10.14 g/kg)、传统饮片3组(5.07 g/kg)、超微饮片1组(10.14 g/kg)、超微饮片2组(5.07 g/kg)、超微饮片3组(2.54 g/kg)。除空白对照组尾静脉注射生理盐水(0.1 mL/10 g),其余各组按文献[4-5]制备小鼠免疫性肝损伤动物模型:各组小鼠尾静脉注射BCG混悬液(剂量:50 mg/kg;浓度:5 mg/mL)。按表1剂量灌胃给予相应药物(20 mL/kg),每天1次,连续10 d。第11天禁食不禁水12 h,尾静脉注射脂多糖(LPS)7.5 μg/只。注射后12 h,眼球采血,常规分离血清,按试剂盒说明书测定血清ALT、AST。
2.2 对免疫性肝损伤小鼠肝脏、脾脏、胸腺脏器指数的影响 眼球采血后,立即取动物肝脏、脾脏、胸腺,称其湿重,计算各脏器脏器指数(脏器指数=脏器湿重/体重×100%)。
2.3 对免疫性肝损伤小鼠肝脏病理变化的影响[6]取小鼠肝脏大叶,10%中性甲醛固定,脱水、包埋、切片、HE染色,制备病理切片,显微镜下观察对肝脏病理损伤的影响。参考中华医学会传染病与寄生虫病学分会、肝病学分会联合修订的《病毒性肝炎防治方案》分为正常、轻、中、重四个等级,各组分别计数。
2.4 对免疫性肝损伤小鼠脾淋巴细胞增殖的影响[7]各组随机选取采血后小鼠3只,常规消毒后无菌取脾脏,制备脾淋巴细胞悬液,过滤、离心,用完全培养基调整细胞浓度至8×106个/mL。每组培养4孔,每孔加样(200 μL)后,将96孔板置于37℃、5%CO2孵箱培养68 h;取出96孔板,超净台下各孔加入MTT溶液20 μL,继续培养4 h。取出96孔板,各孔吸出培养液170 μL,加入等容积的DMSO,震荡10 min。在酶联免疫检测仪(波长545 nm)测各孔OD值。
2.5 统计方法 所有数据用mean±SD表达,采用SPSS13.0统计软件对实验数据进行处理。计量资料采用单项方差分析(One-way ANOVA):方差齐采用LSD法;方差不齐采用Dunnett T3法。计数资料采用多个独立样本非参数检验(K Independent Samples Test)。
3 实验结果
3.1 对免疫性肝损伤小鼠血清ALT、AST活性的影响 实验结果表明,传统饮片临床等效2倍剂量可显著降低免疫性肝损伤小鼠ALT与AST水平,与模型对照组比较有显著性差异(P<0.05);超微饮片临床等效0.5倍剂量亦能显著降低免疫性肝损伤小鼠ALT与AST水平,与模型对照组比较有显著性差异(P<0.05)。联苯双酯可显著降低造模动物ALT水平(P<0.05),但对改善AST活性水平,与模型对照组比较无统计学意义(P=0.069)。见表1。
表1 对免疫性肝损伤小鼠血清ALT、AST活性的影响(±s),n=12Tab.1 Effects on serum ALT and AST in immunological liver injury in mice(±s)
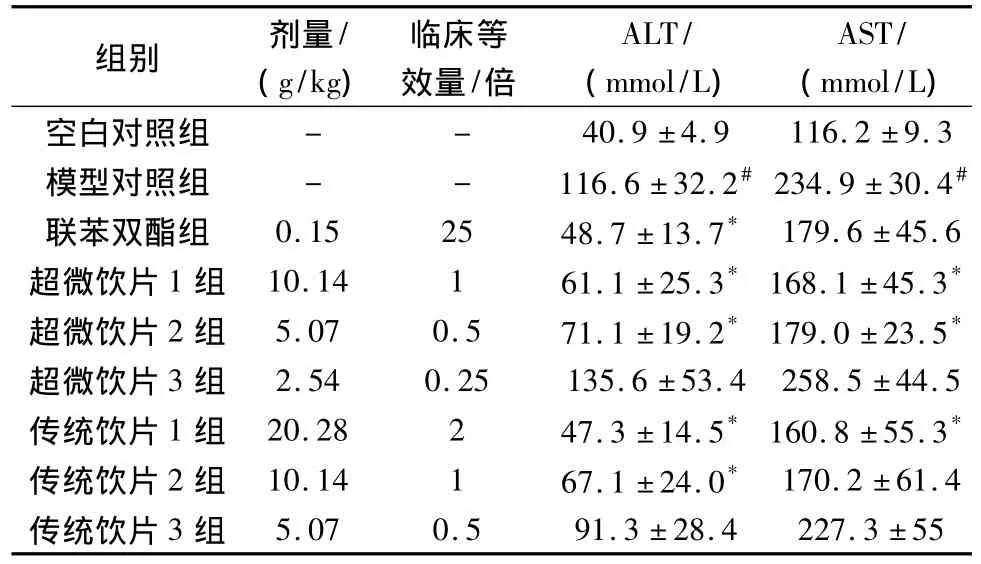
表1 对免疫性肝损伤小鼠血清ALT、AST活性的影响(±s),n=12Tab.1 Effects on serum ALT and AST in immunological liver injury in mice(±s)
与空白对照组比较,#P<0.05;各给药组与模型对照组比较,*P<0.05。
组别 剂量/(g/kg)临床等效量/倍ALT/(mmol/L)AST/(mmol/L)- - 40.9±4.9 116.2±9.3模型对照组 - - 116.6±32.2#234.9±30.4#联苯双酯组 0.15 25 48.7±13.7* 179.6±45.6超微饮片1组 10.14 1 61.1±25.3* 168.1±45.3*超微饮片2组 5.07 0.5 71.1±19.2* 179.0±23.5*超微饮片3组 2.54 0.25 135.6±53.4 258.5±44.5传统饮片1组 20.28 2 47.3±14.5* 160.8±55.3*传统饮片2组 10.14 1 67.1±24.0* 170.2±61.4传统饮片3组空白对照组5.07 0.5 91.3±28.4 227.3±55
3.2 对免疫性肝损伤小鼠脾脏、肝脏、胸腺脏器指数的影响 实验结果表明,给药10d后,肝损伤模型组与正常对照组比较脾脏指数显著增大(P<0.05),说明造模后脾脏增大、肿胀明显,但各给药组对肝脏、脾脏、胸腺脏器指数无显著影响。见表2。
3.3 对免疫性肝损伤小鼠肝脏病理变化的影响实验结果表明,超微饮片临床等效剂量1倍与传统饮片临床等效剂量2倍及联苯双酯组,均可减轻肝脏损伤程度(病理照片见图1,HE染色 ×10倍),与模型对照组比较有显著性差异(P<0.05)。见表3。
3.4 对免疫性肝损伤小鼠脾淋巴细胞增殖的影响实验结果表明,超微饮片临床等效剂量1/2倍与传统饮片临床等效剂量1倍剂量时,皆可显著抑制淋巴细胞的增殖,与模型对照组比较有显著性差异(P<0.05)。见表4。
表2 对免疫性肝损伤小鼠肝、脾、胸腺脏器指数的影响(±s)n=12Tab.2 Effects on organ index in immunological liver injury in mice(±s)
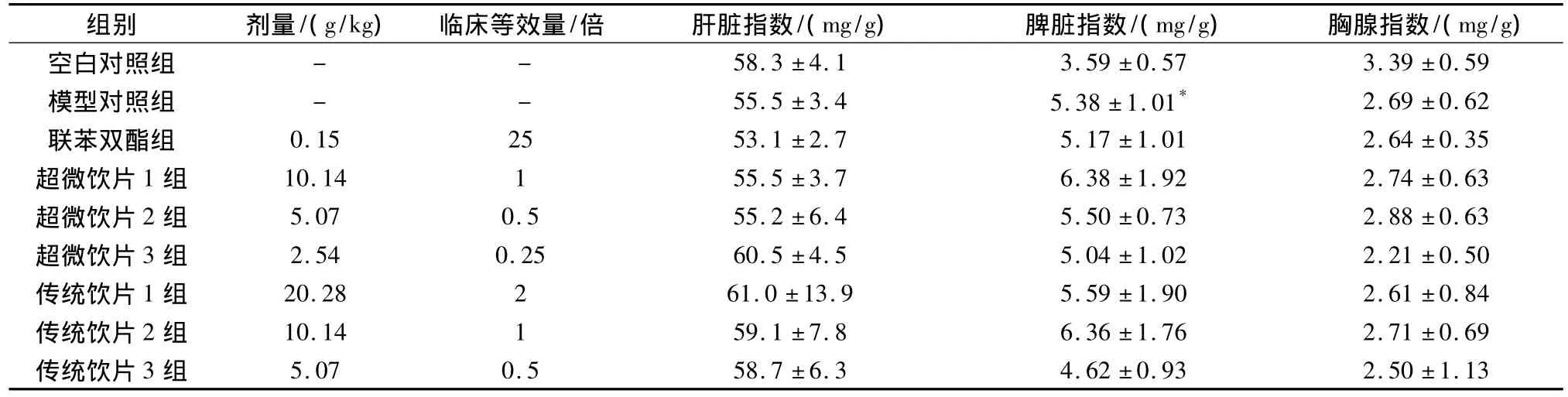
表2 对免疫性肝损伤小鼠肝、脾、胸腺脏器指数的影响(±s)n=12Tab.2 Effects on organ index in immunological liver injury in mice(±s)
空白对照组与模型对照组比较,*P<0.05。
组别 剂量/(g/kg) 临床等效量/倍 肝脏指数/(mg/g) 脾脏指数/(mg/g) 胸腺指数/(mg/g)58.3±4.1 3.59±0.57 3.39±0.59模型对照组 - - 55.5±3.4 5.38±1.01* 2.69±0.62联苯双酯组 0.15 25 53.1±2.7 5.17±1.01 2.64±0.35超微饮片1组 10.14 1 55.5±3.7 6.38±1.92 2.74±0.63超微饮片2组 5.07 0.5 55.2±6.4 5.50±0.73 2.88±0.63超微饮片3组 2.54 0.25 60.5±4.5 5.04±1.02 2.21±0.50传统饮片1组 20.28 2 61.0±13.9 5.59±1.90 2.61±0.84传统饮片2组 10.14 1 59.1±7.8 6.36±1.76 2.71±0.69传统饮片3组空白对照组 - -5.07 0.5 58.7±6.3 4.62±0.93 2.50±1.13
表3 对免疫性肝损伤小鼠肝脏病理 变化的影响(±s)n=12Tab.3 Effects on liver pathological change in immunological liver injury in mice(±s)
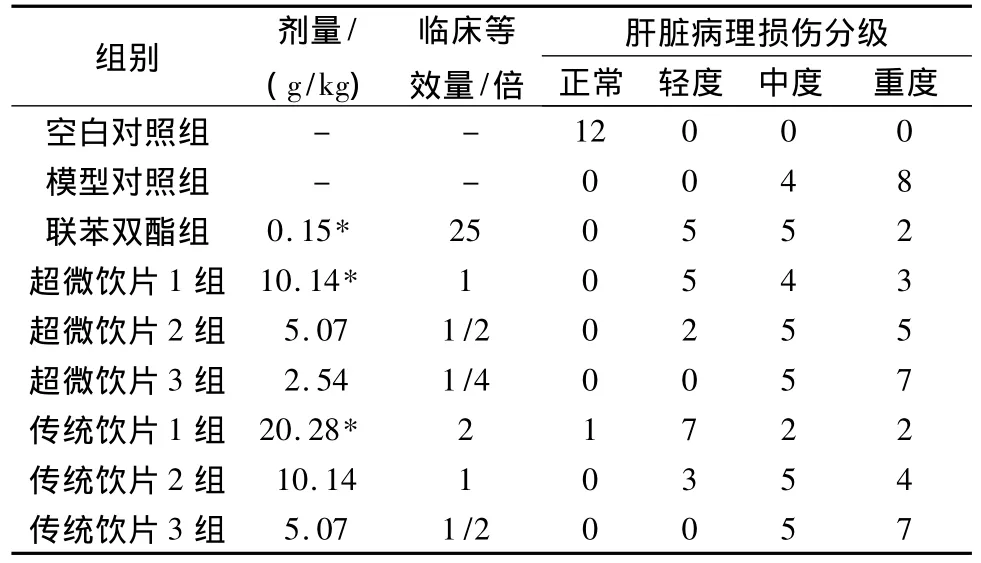
表3 对免疫性肝损伤小鼠肝脏病理 变化的影响(±s)n=12Tab.3 Effects on liver pathological change in immunological liver injury in mice(±s)
与模型对照组比较,*P<0.05。
组别 剂量/(g/kg)肝脏病理损伤分级临床等效量/倍- -12000模型对照组 - - 0 0 4 8联苯双酯组 0.15* 25 0 5 5 2超微饮片1组 10.14* 1 0 5 4 3超微饮片2组 5.07 1/2 0 2 5 5超微饮片3组 2.54 1/4 0 0 5 7传统饮片1组 20.28* 2 1 7 2 2传统饮片2组 10.14 1 0 3 5 4传统饮片3组正常 轻度 中度 重度空白对照组5.07 1/2 0 0 5 7
4 讨论
小柴胡汤具有和解少阳之功,临床用于治疗少阳病症见往来寒热、胸胁苦满、默默不欲饮食、心烦喜呕等。现代研究具有保肝利胆、抗炎解热、免疫调节等药理作用[8],临床广泛用于病毒性肝炎的治疗。病毒性肝炎以乙型病毒性肝炎最为常见,是由乙型肝炎病毒(HBV)引起的世界范围性疾病。其发病机制复杂,目前认为是HBV感染人体后引起细胞免疫和体液免疫应答,激发自身免疫反应及免疫调节功能紊乱导致肝细胞损伤[9],从而导致ALT、AST水平升高。本项研究采用BCG+LPS诱导的免疫性肝损伤动物模型,BCG首先激活致敏T淋巴细胞,尤其是致敏肝内Kupfer细胞和巨噬细胞,并大量聚集于肝脏;再注射LPS后进一步激活致敏的巨噬细胞,促使其释放大量细胞因子,如一氧化氮、肿瘤坏死因子、白细胞介素、自由基、白三烯等造成肝细胞损害[10]。该病理过程与人类病毒性肝炎中Kupffer细胞等非特异性免疫细胞在肝细胞内浸润并释放大量细胞因子造成肝细胞损害的病理过程比较相似,被认为是研究乙型病毒性肝炎最公认、经典的动物模型[11]。

图1 小柴胡汤对免疫性肝损伤小鼠肝脏病理的改变Fig.1 Effects on liver pathological change in immunological liver injury in mice
表4 对免疫性肝损伤小鼠脾淋巴细胞增殖的影响(±s)n=4Tab.4 Effects on proliferation of spleen lymphocytes in immunological liver injury in mice(±s)
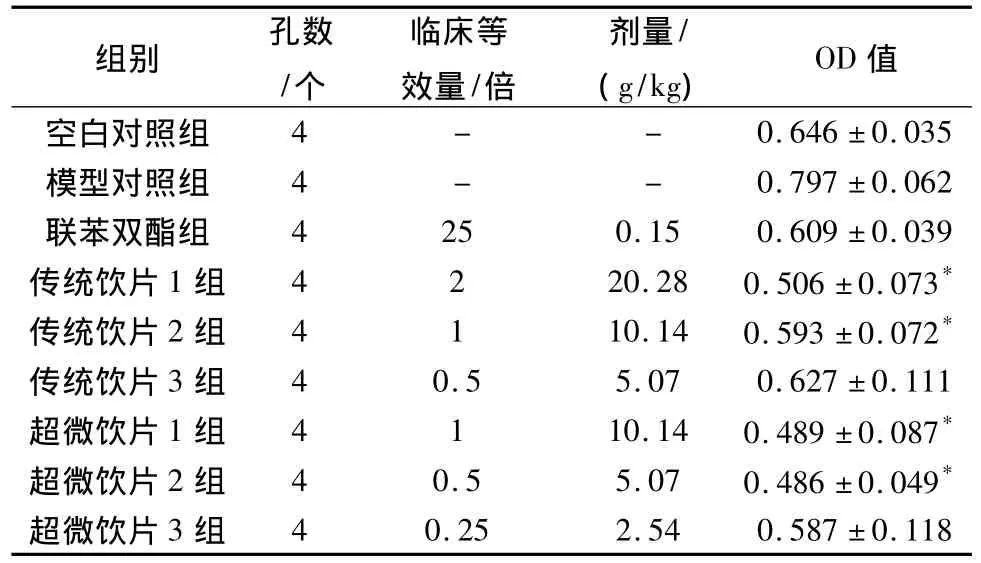
表4 对免疫性肝损伤小鼠脾淋巴细胞增殖的影响(±s)n=4Tab.4 Effects on proliferation of spleen lymphocytes in immunological liver injury in mice(±s)
与模型对照组比较,*P<0.05。
组别 孔数/个临床等效量/倍剂量/(g/kg) OD值- 0.646±0.035模型对照组 4 - - 0.797±0.062联苯双酯组 4 25 0.15 0.609±0.039传统饮片1组 4 2 20.28 0.506±0.073*传统饮片2组 4 1 10.14 0.593±0.072*传统饮片3组 4 0.5 5.07 0.627±0.111超微饮片1组 4 1 10.14 0.489±0.087*超微饮片2组 4 0.5 5.07 0.486±0.049*超微饮片3组空白对照组4-4 0.25 2.54 0.587±0.118
本实验采用免疫性肝损伤小鼠模型与脾淋巴细胞增殖实验,探讨了小柴胡汤超微饮片与传统饮片药效学作用的剂量关系。实验结果表明,小柴胡汤两种饮片均可显著降低免疫性肝损伤小鼠血清ALT、AST活性,减轻肝脏病理损伤程度,抑制脾脏淋巴细胞的增殖,对肝损伤起到较好的保护作用。实验数据显示,超微饮片临床等效剂量的1/2倍即可显著降低ALT、AST水平,与传统饮片临床等效量2倍剂量效应相当;在抑制脾淋巴细胞增殖方面,小柴胡汤超微饮片临床等效剂量的1/2倍与传统饮片临床等效剂量1倍效应相当。病理是诊断、治疗疾病及判断预后的“金标准”,超微饮片临床等效剂量1倍与传统饮片临床等效剂量2倍剂量,均可显著减轻肝脏损伤程度,两者效应相当。结合前期小柴胡汤超微饮片与传统饮片化学成分的对比研究,超微饮片水溶性浸出物、总黄酮及黄芩苷溶出量约为传统饮片的2倍,参考本实验药效学实验结果,建议超微饮片使用剂量可以减少至传统饮片使用量的1/2~1/4。
[1]李 雅,尹天雷,蔡光先,等.补阳还五汤复方超微饮片浸泡液与传统汤剂的化学对比研究[J].中药材,2007,30(11):1459-1461.
[2]蔡光先,李永敏,郑 兵,等.中药超微饮片量效关系及安全性初探[J].中国新药杂志,2007:16(9):682-684.
[3]张祥伟,罗奇志,佟 丽,等.小柴胡汤超微饮片与常规饮片化学成分溶出特性的对比研究[J].时珍国医国药,2009,20(11):2750-2752.
[4]佟 丽,陈育尧,刘欢欢,等.龙胆粉针剂对实验性肝损伤的作用[J].第一军医大学学报,2001,21(12):906-907.
[5]刘建文主编.药理实验方法学-新技术与新方法[M].2版.北京:化学工业出版社,2008:207-208.
[6]王伯沄,李玉松,黄高昇,等.病理学技术[M].北京:人民卫生出版社,2001:76-140.
[7]林宗宁,董胜璋,董书芸,等.MTT法检测T淋巴细胞增殖功能的方法学探讨和应用[J].中国卫生检疫杂志,2000,10(1):8-10.
[8]唐已婷,陈家旭.小柴胡汤实验研究进展[J].中国医药学报,2000,15(6):59-61.
[9]孙 慧,吴金明.乙型病毒性肝炎肝细胞损伤机制的研究进展[J]. 医学综述,2008,14(21):3296-3300.
[10]邱英锋,缪晓辉,蔡 雄,等.卡介苗加脂多糖建立的大鼠急性免疫性肝损伤模型的研究[J].西北国防医学杂志,2004,25(5):345-347.
[11]曲相如,孙景春,卢秀花,等.实验性肝损伤动物模型制备和评价[J].中国实验诊断学,2009,13(10):1477-1478.

