烟草MADS-box家族基因保守片段的克隆与序列分析
李元元,杨爱国,王 鲁,罗成刚,贾兴华,刘贯山,苏振刚,王元英*
(1.中国农业科学院烟草遗传改良与生物技术重点开放实验室,青岛 266101;2.中国农业科学院研究生院,北京 100081)
MADS-box家族基因是一类编码转录因子的基因,其命名是根据4个最先克隆的家族成员首字母即 MCM1[1]、AG[2]、DEF[3-4]和 SRF[5]。MADS-box家族基因广泛分布于植物、动物和真菌中,在双子叶植物拟南芥、金鱼草、番茄、油菜、烟草和矮牵牛,以及单子叶植物玉米、小麦、高粱中研究比较多,其在植物生长发育和信号转导过程中具有重要作用[6],特别是在显花植物响应外界温光环境条件和内源信号变化,调控开花早晚中起到重要作用[7-9]。在拟南芥中,至少有4条主要的途径来调控成花诱导和开花过程[10],其中起主要作用的是FLC、FT和SOC1。 CO响应长日照,激活FT和促进SOC1基因表达[11-12],而FT和SOC1促进开花过程,即所谓的光周期途径;与此同时,FLC能相应环境温度变化,春化(低温)能抑制FLC的表达,而FLC抑制成花促进基因FT和SOC1 的表达[13-16],所以低温促进成花,即所谓春化途径。
烟草的早花对烟叶产量和品质影响很大,并可能与MADS-box家族基因密切相关。到目前为止,从烟草中克隆到的控制开花时间的FLC、SOC1类同源基因很少[17]。本研究利用RT-PCR的方法从低温敏感型烟草品种NC82茎尖cDNA中克隆了一批烟草MADS-box家族基因保守片段,分属于不同的MADS-box家族基因亚类,这为克隆控制烟草开花时间的低温敏感型基因,研究低温如何影响烟草开花时间的分子机制,以及培育低温不敏感型烟草新品种奠定基础。
1 材料与方法
1.1 试验材料及地点
普通烟草品种 NC82属于低温敏感品种。将NC82种子进行消毒、浸种和催芽,用塑料软盘播种种植于中国农业科学院烟草研究所温室,取NC82苗期茎尖用液氮速冻后,保存于-70 ℃ 冰箱中备用。
1.2 茎尖总RNA的提取与检测
采用TransZol法 (全式金公司)提取RNA:取200 mg 茎尖样品,加液氮于研钵中将其研磨成粉末, 将粉末状样品转移至2 mL 离心管中;加入1 mL TransZol,用匀浆仪进行匀浆处理,并用移液枪反复吹吸;室温静置5 min,加0.2 mL氯仿,剧烈振荡15 s,室温孵育3 min,10000 g 4 ℃ 离心15 min; 转移无色的水相于新的1 mL离心管中,加入0.5 mL 异丙醇,颠倒混匀,室温沉淀10 min,10000 g 4 ℃ 离心 10 min;去上清, 加入 1 mL 75%乙醇(DEPC处理的蒸馏水配制),剧烈涡旋,7500 g 4 ℃ 离心5 min;弃上清,室温晾干沉淀,沉淀溶于50~100 μL RNA溶解液(DEPC处理的双蒸水)中,55~60 ℃ 孵育 10 min,样品 -70 ℃ 保存以备长期使用。所提取 RNA用紫外分光光度计检测吸光度值,并在1% 非变性琼脂糖凝胶上电泳检测。
1.3 cDNA 第一链的合成
使用北京全式金公司的 TransScript II First-Strand cDNA Synthesis SuperMix试剂盒进行反转录合成cDNA第一链。其反应体系20 μL,其中 RNA 1 μL(500 mg/L 左右);Oligo(dT)20Primer(0.1 μg/μL ) 1 μL;2×TS II Reaction Mix 10 μL;TransScript II RT/RI Enzyme Mix 2 μL;用 DEPC 处理除去 RNase的双蒸水补充反应体系体积至 20 μL。然后轻轻混匀,于 50 ℃ 孵育 30 min,85 ℃ 加热5 min使TransScript II RT失活。
1.4 RT- PCR
采用宗成文[18]根据多种植物的 MADS-box家族基因的MADS盒保守区设计的3条上游和3条下游简并引物。
上游引物:
M1: 5' ATGGGRAGRGGDARRGTBCA 3'
M2: 5' ATGGGRAGRGGDARRGTBGA 3'
M3: 5' ATGGGRAGRGGDARRATHGA 3'
下游引物:
M4: 5' ATSARRGCDACYTCDGCRTC 3'
M5: 5' CKYTCNARDATNCKYTCCAT 3'
M6: 5' GAGAAGAYGATSARRGCDAC 3'
其中R:A or G;D:not C;B:not A;H:not G;Y:C or T;K:G or T;S:C or G;N:A、C、G or T 。这3条上游和3条下游引物可以自由组合成9对引物。
RT-PCR反应体系25 μL:第1链cDNA模板1 μL,上下游引物各 0.5 μL (10 μmol/L),dNTP Mixture ( 2.5 mmol/L ) 2 μL,10×TransStartTaq Buffer (含有 Mg2+) 2.5 μL,TransStart Taq Polymerase(5 U/μL)0.5 μL,用双蒸水补充体系体积到25 μL。PCR反应条件:首先95 ℃ 预变性5 min; 再进行 35 个循环(95 ℃ 变性 30 s,50 ℃ 退火 30 s,72 ℃ 延伸 20 s );最后 72 ℃ 保温 10 min。RT-PCR产物用1.5 % 琼脂糖凝胶电泳检测。
1.5 割胶回收和转化
RT-PCR扩增效果比较好的引物组合,使用EasyPure Quick Gel Extraction Kit对其RT-PCR产物进行割胶回收。用 pEASY-T3 Cloning Kit连接回收产物,根据回收产物的浓度,连接体系确定为,回收片段各 4 μL,pEASY-T3 Cloning Vector 1 μL,25℃15 min;将连接产物转化感受态细胞Trans1-T1(依照全式金公司试剂指南),涂布于氨苄抗性的LB平板培养基,加 IPTG 和 X-gal 试剂进行蓝白斑筛选;37 ℃ 培养过夜后挑取白色单菌落,使用通用M13正反向引物鉴定阳性克隆。每个组合挑取 10个阳性克隆,送上海生物工程公司测序,测得的序列按引物组合分别编号。
1.6 序列及系统发育分析
将测序获得的核酸序列及其推导的蛋白序列在NCBI上进行Blast分析(http://blast.ncbi.nlm.nih.gov/),确认其是否含有MADS-box家族基因保守结构域;然后用DNASTAR软件将其推测的氨基酸序列与GenBank数据库中已知的拟南芥等植物的 MADS-box 家族基因蛋白序列用ClustalW法进行多序列比对,并用Phylip3.68软件包的NJ(Neighbor Joining)算法生成系统发育树。
2 结 果
2.1 RNA提取
提取的茎尖总 RNA经紫外分光光度计测定,其OD260/OD280值在1.9~2.0,说明所提取的RNA纯度良好,浓度在500 mg/L 左右。提取RNA电泳检测呈现 3条带 (图 1),从上到下分别为 28S rRNA、18S rRNA和5S rRNA,3条带清晰没有拖带,且28S rRNA的亮度约为18S rRNA亮度的两倍,说明所提取的RNA质量较好,基本无降解。

图1 NC82茎尖总RNAFig.1 Total RNA isolated from shoot meristem of tobacco variety NC82
2.2 RT-PCR 扩增烟草MADS-box家族基因保守片段
从9对引物组合对烟草茎尖cDNA的RT-PCR扩增产物的电泳检测结果看,尽管有3对引物组合(M2和M4、M2和M6及M3和M4)的PCR产物中有非特异性条带被扩增,但均扩增出一条大约150 bp,而且比较清晰的特异条带(图 2),与预计的片段大小基本一致。 对M2和M4,M3和M4以及M2和M6引物组合的RT-PCR产物进行割胶、回收、转化和鉴定,3对引物组合扩增目的片段的克隆阳性率很高(图3)。
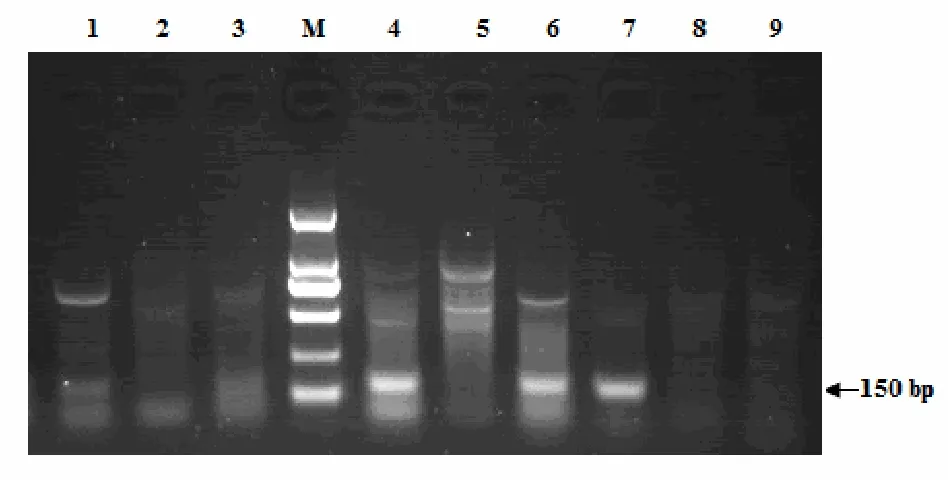
图2 RT-PCR扩增烟草MADS-box家族基因保守片段Fig.2 Conserved MADS-box family gene fragments of tobacco amplified by RT-PCR.

图3 M2和M4、M2和M6以及M3和M4引物组合克隆片段的鉴定Fig.3 Identification of amplified clone fragments with M2 and M4, M2 and M6, M3 and M4 prime combinations.
2.3 序列及系统发育分析
克隆片段测序后的序列长度为 122~146 bp,并带有起始密码子。在NCBI 上进行Blast分析,发现所获得的 27个片段中有 16条序列与MADS-box家族基因具有很高的同源性,其推导的蛋白序列具有MADS_MEF2类保守结构域(图4),利用部分有代表性的 MADS-box家族基因编码蛋白中的 MADS_MEF2类结构域序列,例如金鱼草的DEF (BAI68389.1),拟南芥的AG(CAA37642.1)、FLC (AAN04056.1)、SVP(NP_179840.2)、AGL20(NP_182090.1)以及 AGL6 (NP_182089.1)进行多序列比对(图 5),结果发现克隆的片段与拟南芥等MADS-box家族基因保守结构域含有很少的差异位点,其相似性平均能达到76%。多序列比对结果中,除了克隆片段第一位氨基酸为起始翻译的甲硫氨酸(M)外,还含有15个保守的蛋白位点, 为所有序列所共有,其中7个位点参与蛋白结合DNA功能,5个位点参与蛋白的二聚化(图 4、图 5),与植物 MADS-box家族基因编码蛋白中的 MADS盒所具有的功能相一致[19],说明克隆得到了烟草MADS-box家族基因的保守结构域片段。

图4 克隆的MADS-box家族基因保守片段推导氨基酸的结构域Fig.4 Conserved domain of deduced amino acids translated from obtained MADS-box family gene fragments

图5 克隆的MADS-box家族基因保守片段与部分已知MADS-box家族基因的蛋白序列比对Fig.5 Multi-alignment of obtained MADS-box family gene fragments with other known MADS-box family gene proteins
根据 Becker等(2003)[20]对植物 MADS-box家族基因的分类结果,将获得的 16条MADS-box家族基因保守片段与拟南芥 MADS-box家族基因构建系统发育树(图6),16条MADS-box家族基因保守片段可以划分到9个不同的MADS-box家族基因亚类,这些亚家族主要与植物花器官发育和开花时间有关。LyE04、LyE02和LyE05聚到FLC亚家族,LyD08和LyE06聚到STMADS11亚家族,LyD07聚到TM3亚家族,LyE01聚到AGL6亚家族,这 4个亚家族基因都具有控制开花时间的功能。LyE09和LyE11聚到AG亚家族,该家族属于C/D型花器官同源异型基因;LyD10和 LyD11聚到AGL2亚家族,属于E类基因;LyE10聚到DEF/GLO亚家族,属于B类基因;LyD12和LyE08聚到AGL15亚家族;LyD09聚到AGL12亚家族。LyE07和相邻的群都很近,暂时没有分到具体的某个群,可能属于烟草特有的一群。

图6 克隆的MADS-box家族基因保守片段与拟南芥MADS-box家族基因的系统发育树Fig.6 A phylogenetic tree of Arabidopsis and tobacco MADS-box containing genes
3 讨 论
烟草是一种重要的叶用经济作物,在农业种植生产过程中有早花现象,即烟草植株没有达到该品种在当地栽培条件下应有的株高和叶片数,便完成营养生长,过早进入生殖生长和提前开花[21],并且低温是导致烟草早花的主要环境因素之一。模式植物拟南芥的研究发现,MADS-box家族基因在调节植物开花时间上具有重要功能[19,22-23],而烟草早花可能与 MADS-box家族基因响应外界温光环境变化,调控开花密切相关,所以选用低温敏感型烟草品种NC82开展该类基因的同源克隆。
植物的 FLC、STMADS11、TM3和 AGL6类MADS-box亚家族基因与植物开花时间相关,所以聚到这些亚家族的 MADS-box家族基因保守片段LyE04、LyE02、LyE05、LyD08、LyE06、LyD07和LyE01可能参与了低温敏感型烟草NC82对环境温度的成花响应过程。在拟南芥中,FLC基因能感应外界环境并调节内生代谢途径,是拟南芥中某些生态型感应春化作用的关键因子[24],其能抑制TM3亚家族的SOC1基因。SOC1是CO对长日照反应和FLC对春化低温反应的下游靶标基因,调节开花时间,因为低温抑制FLC表达,从而使SOC1表达量增加而促进开花。STMADS11亚家族的SVP是一个成花转变抑制因子,SVP的突变体表现早花而不伴有其他明显表型变化[25],SVP通过与FLC形成复合体来抑制成花和开花[26];而 AGL24的功能突变使开花延迟,但 AGL24的强表达又促进早花[27],AGL24可能在 SOC1和花分生组织身份基因LEAFY (LFY)之间,通过诱导LFY的表达而作为一个调节因子。AGL6亚家族基因的原始功能在于控制胚珠发育,但AGL6也能调节开花时间[28]。所以聚到 FLC和 TM3亚家族的克隆片段 E04、LyLyE02、LyE05和LyD07可能与NC82的温度反应相关,并作为 FLC和 SOC1的同源基因;聚到STMADS11亚家族的LyD08和LyE06可能是SVP的同源基因,或在参与低温反应的相关基因间起调节作用;而LyE01可能是AGL6亚家族中新产生的具有控制开花时间功能的基因。
LyE09、LyE11、LyD10、LyD11和 LyE10克隆片段聚类到AG (C/D)、AGL2(E)和DEF/GLO(B)类MADS-box亚家族,说明这些克隆片段所代表的基因可能具有花器官身份基因的功能。LyD12和LyE08聚到AGL15亚家族,AGL15亚家族基因主要在胚和种子中表达[29],但其同样能够在拟南芥苗的茎顶端、花以及叶原基中瞬间表达[30];LyD09聚到 AGL12亚家族,该家族基因主要在根中表达[31],但其表达也会在花和茎端的某些类型细胞中表达[32]。所以 LyD12、LyE08和 LyD09可能是组织正常发育所表达的基因,不参与低温反应过程。AtAGL16和AtAGL17属于AGL17亚家族基因,其主要在根中表达[32-33],所以与开花时间,花器官身份,茎组织发育相关的基因片段没有聚到该亚家族。LyE07可能属于烟草特有的,不能归类到已有的植物MADS-box家族基因亚类。
4 结 论
NC82在苗期是其低温敏感期,利用该时期的茎尖总RNA反转录成cDNA进行MADS-box家族基因的同源克隆,得到了16条MADS-box家族基因保守片段,序列长度 122~146 bp,其推导的氨基酸序列与已知的 MADS-box家族基因具有很高的同源性,相似性平均能达到76%,并具有保守的MADS_MEF2类结构域,以及15个保守的氨基酸位点,其中 7个参与蛋白与 DNA的相互作用,4个参与蛋白的二聚化。系统发育分析将 16条保守片段归入拟南芥不同的MADS-box家族基因亚类,其中包括了参与开花时间调节的FLC、STMADS11、TM3和AGL6亚家族,以及与植物花器官发育相关的AG、AGL2和DEF/GLO亚家族。这些与烟草成花相关的保守片段将作为候选基因片段为克隆全长的低温敏感型MADS-box家族基因奠定基础。
[1]Passmore S, Maine G T, Elble R, et al.Saccharomyces cerevisiae protein involved in plasmid maintenance is necessary for mating of MAT alpha cells[J].J Mol Biol,1988, 204(3): 593-606.
[2]Yanofsky M F, Ma H, Bowman J L, et al.The protein encoded by the Arabidopsis homeotic gene agamous resembles transcription factors[J].Nature, 1990,346(6279): 35-39.
[3]Sommer H, Beltran J P, Huijser P, et al.A homeotic gene involved in the control of flower morphogenesis in Antirrhinum majus: the protein shows homology to transcription factors[J].EMBO J, 1990, 9(3): 605-613.
[4]Schwarz-Sommer Z, Hue I, Huijser P, et al.Characterization of the Antirrhinum floral homeotic MADS-box gene deficiens: evidence for DNA binding and autoregulation of its persistent expression throughout flower development[J].EMBO J, 1992, 11(1): 251-263.
[5]Norman C, Runswick M, Pollock R, et al.Isolation and properties of cDNA clones encoding SRF, a transcription factor that binds to the c-fos serum response element[J].Cell, 1988, 55(6): 989-1003.
[6]Messenguy F, Dubois E.Role of MADS box protein and their cofactors in combinatorial control of gene expression and cell development[J].Gene, 2003, 316:1-21.
[7]Distelfeld A, Li C, Dubcovsky J.Regulation of flowering in temperate cereals[J].Curr Opin Plant Biol, 2009, 12(2):178-184.
[8]Greenup A, Peacock W J, Dennis E S, et al.The molecular biology of seasonal flowering-responses in Arabidopsis and the cereals[J].Ann Bot, 2009, 103(8):1165-1172.
[9]Imaizumi T, Kay S A.Photoperiodic control of flowering:not only by coincidence[J].Trends Plant Sci, 2006,11(11): 550-558
[10]Moon J, Suh S S, Lee H, et al.The SOC1 MADS-box gene integrates vernalization and gibberellin signals for flowering in Arabidopsis[J].Plant J, 2003, 35(5):613-623.
[11]Valverde F, Mouradov A, Soppe W, et al.Photoreceptor regulation of CONSTANS protein in photoperiodic flowering[J].Science, 2004, 303(5660): 1003-1006.
[12]Jang S, Marchal V, Panigrahi K C, et al.Arabidopsis COP1 shapes the temporal pattern of CO accumulation conferring a photoperiodic flowering response[J].EMBO J, 2008, 27(8): 1277-1288.
[13]Michaels S D, Amasino R M.FLOWERING LOCUS C encodes a novel MADS domain protein that acts as a repressor of flowering[J].Plant Cell, 1999, 11(5):949-956.
[14]Sheldon C C, Burn J E, Perez P P, et al.The FLF MADS box gene: a repressor of flowering in Arabidopsis regulated by vernalization and methylation[J].Plant Cell,1999, 11(3): 445-458.
[15]Hepworth S R, Valverde F, Ravenscroft D, et al.Antagonistic regulation of flowering-time gene SOC1 by CONSTANS and FLC via separate promoter motifs[J].EMBO J, 2002, 21(16): 4327-4337.
[16]Michaels S D, Himelblau E, Kim S Y, et al.Integration of flowering signals in winter-annual Arabidopsis[J].Plant Physiol, 2005, 137(1): 149-156.
[17]Smykal P, Gennen J, De Bodt S, et al.Flowering of strict photoperiodic Nicotiana varieties in non-inductive conditions by transgenic approaches[J].Plant Mol Biol,2007, 65(3): 233-242.
[18]宗成文,房经贵,陶建敏,等.葡萄 MADS-box家族基因保守片段的克隆与序列分析[J].果树学报,2007,25(1):27-32.
[19]Shore P, Sharrocks A D.The MADS-box family of transcription factors[J].Eur J Biochem, 1995, 229(1):1-13.
[20]Becker A, Theissen G.The major clades of MADS-box genes and their role in the development and evolution of flowering plants[J].Mol Phylogenet Evol, 200329(3):464-89.
[21]王军,王益奎,韦建玉,等.烟草早花成因与控制[J].广西农业科学,2004,35(4):331-332.
[22]Blazquez M A, Weigel D.Integration of floral inductive signals in Arabidopsis[J].Nature, 2000, 404(6780):889-892.
[23]Samach A, Onouchi H, Gold S E, et al.Distinct roles of CONSTANS target genes in reproductive development of Arabidopsis[J].Science, 2000, 288(5471): 1613-1616.
[24]Sheldon C C, Rouse D T, Finnegan E J, et al.The molecular basis of vernalization: the central role of FLOWERING LOCUS C (FLC) [J].Proc Natl Acad Sci,2000, 97 (7): 3753-3758.
[25]Hartmann U, Höhmann S, Nettesheim K, et al.Molecular cloning of SVP: a negative regulator of the floral transition in Arabidopsis[J].Plant J, 2000, 21(4):351-360.
[26]Li D, Liu C, Shen L, et al.A repressor complex governs the integration of flowering signal in Arabidopsis[J].DevCell, 2008, 15(1): 110-120.
[27]Yu H, Xu Y, Tan EL, et al.AGAMOUS-LIKE 24, a dosage-dependent mediator of the flowering signals[J].Proc Natl Acad Sci, 2002, 99(25): 16336-16341.
[28]Koo S C, Bracko O, Park M S, et al.Control of lateral organ development and flowering time by the Arabidopsis thaliana MADS-box Gene AGAMOUS LIKE6[J].Plant J, 2010, 62(5): 807-816.
[29]Perry S E, Nichols K W, Fernandez D E.The MADS domain protein AGL15 localizes to the nucleus during early stages of seed development[J].Plant Cell, 1996,8(11): 1977-1989.
[30]Fernandez D E, Heck G R, Perry S E, et al.The embryo MADS domain factor AGL15 acts postembryonically.Inhibition of perianth senescence and abscission via constitutive expression[J].Plant Cell, 2000, 12(2):183-198.
[31]Rounsley S D, Ditta G S, Yanofsky M F.Diverse roles for MADS box genes in Arabidopsis development[J].Plant Cell, 1995, 7(8): 1259-1269.
[32]Alvarez-Buylla E R, Liljegren S J, Pelaz S, et al.MADS-box gene evolution beyond flowers: expression in pollen, endosperm, guard cells, roots and trichomes[J].Plant J, 2000, 24 (4): 457-466.
[33]Burgeff C, Liljegren S J, Tapia-López R, et al.MADS-box gene expression in lateral primordia, meristems and differentiated tissues of Arabidopsis thaliana roots[J].Planta, 2002, 214(3): 365-372.

