整合素α5β1和FAK在上皮卵巢肿瘤组织中的表达及意义
范丽丽,薛秀珍
(河南科技大学第一附属医院,郑州471003)
侵袭与远处转移是导致卵巢上皮癌治疗失败和死亡的主要原因之一。黏附是肿瘤侵袭和转移的始动因素,肿瘤细胞首先通过膜表面受体黏附于基底膜及细胞外基质(ECM),然后以蛋白酶降解基底膜和基质,最后定向运动穿越基底膜和ECM。整合素最基本的黏附功能决定了它在肿瘤的侵袭和转移中起了不可替代的作用。黏着斑激酶(FAK)是一非受体酪氨酸蛋白激酶,被认为是整合素依赖性信号转导通路的基础分子,在整合素介导的信号转导途径中起关键作用[1]。本研究应用免疫组化方法检测卵巢上皮肿瘤组织中的整合素α5β1和FAK的表达,分析其与临床病理特征的关系。现报告如下。
1 材料与方法
1.1 材料与试剂 收集我院病理科1998年1月~2001年12月手术切除的卵巢上皮癌组织蜡块49例(观察组)和卵巢上皮良性肿瘤组织蜡块15例(对照组)。观察组患者年龄>50岁29例,≤50岁20例;肿瘤直径>5cm 31例,≤5cm 18例;卵巢浆液性上皮癌26例,黏液性上皮癌11例,子宫内膜样癌12例;肿瘤分化程度:低分化9例,中分化25例,高分化15例;FIGO分期Ⅰ期+Ⅱ期21例,Ⅲ期+Ⅳ期28例。组织经常规固定、石蜡包埋、4 μm切片,分别进行HE染色和免疫组化染色。兔抗人integrin α5β1多克隆抗体购于北京博奥森生物试剂有限公司,工作浓度1∶150;鼠抗人FAK单克隆抗体购于美国Santa Cruz公司,工作浓度1∶100;免疫组化试剂盒及DAB显色试剂盒购于北京中杉金桥有限公司。
1.2 方法
1.2.1 免疫组化SP法 石蜡切片经常规处理脱蜡后行高温高压修复,滴加稀释的一抗,4℃孵育过夜后加入二抗,DAB显色,HE复染。每批染色均设立阴性对照(以PBS液代替一抗)和阳性对照。
1.2.2 染色结果判定标准 整合素α5β1和FAK阳性染色均主要定位于细胞质。染色结果判定以着色程度及阳性细胞数确定,于染色最多的区域计数1 000个细胞。阳性细胞百分数0为0分,≤25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分;着色强度:无色(-)为0分,浅黄色(+)为1分,棕黄色(++)为2分,深棕色(+++)为3分。着色强度与阳性细胞百分数评分之和≥3为阳性。
1.3 统计学方法 采用SPSS13.0软件。对数据进行χ2检验和Spearman等级相关分析。P≤0.05为差异有统计学意义。
2 结果
2.1 两组整合素α5β1和FAK的表达比较 观察组整合素α5β1表达阳性4例(26.7%),FAK表达阳性3例(20.0%);对照组分别为30(61.2%)、34例(69.4%)。两组整合素α5β1和FAK的表达阳性率比较均有统计学差异(P<0.05或<0.01)。
2.2 卵巢上皮癌组织中整合素α5β1、FAK表达与临床病理特征的关系 见表1。
2.3 卵巢上皮癌组织中整合素α5β1和FAK表达的相关性 Spearman等级相关分析显示,卵巢上皮癌组织中整合素α5β1与FAK的表达呈显著正相关(r=0.490,P <0.01)。
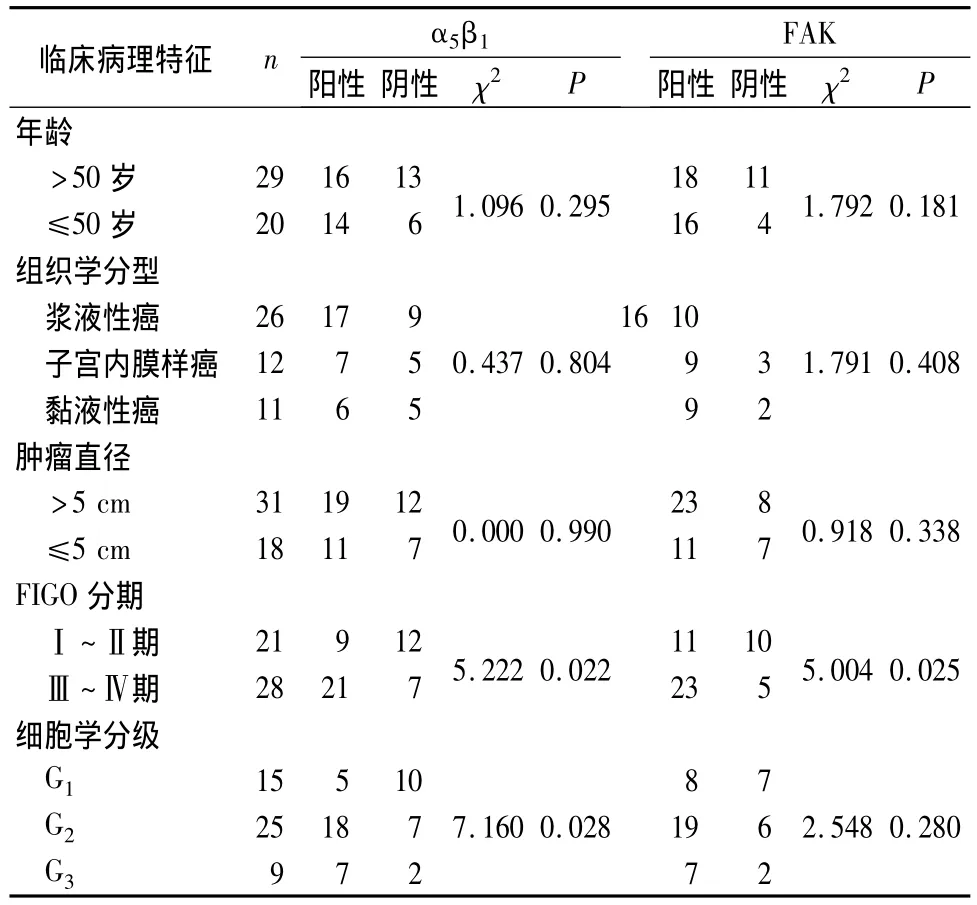
表1 卵巢上皮癌组织中整合素α5β1和FAK表达与临床病理特征的关系(例)
3 讨论
整合素家族作为细胞的黏附分子和ECM的主要受体,在胞外与ECM,胞内与细胞骨架、信号转导分子和其他一些蛋白结合,介导细胞内外的双向信号传递。一方面,细胞内信号通过整合素传导、活化,调节整合素与细胞外配体的亲和力,这是由内向外的信号传导过程;另一方面,整合素与配体结合后把胞外信号传入细胞内,导致细胞骨架、基因表达和细胞分化等,这是由外向内的信号传导过程[2]。整合素的异常信息传递可导致肿瘤细胞失控性生长、去分化与远处转移。
整合素α5β1可通过多个环节影响肿瘤细胞的黏附和凋亡、ECM的降解、肿瘤血管的生成等,从而在肿瘤的发生、发展、侵袭转移中起重要作用。整合素α5β1的主要配体是纤黏蛋白(FN)。韦德英等[3]在离体卵巢癌细胞培养中发现,在无FN的情况下整合素α5β1对细胞凋亡率没有影响;有FN作用时癌细胞中的凋亡调节基因bcl-2表达上升,bax表达下降。Banerjia等[4]认为,整合素是通过调节基质金属蛋白酶(MMP)的分泌和活化来促进肿瘤侵袭和转移。Mitra等[5]用抗整合素α5β1抗体处理胶质瘤细胞株,发现MMP-2表达上升,同时MMP-2前体被诱导激活。说明整合素α5β1与ECM结合后通过调节MMP从而分解基质、促进肿瘤细胞侵袭和转移。大量研究表明,整合素α5β1的表达与多种癌组织存在相关性。本研究结果显示,整合素α5β1在卵巢上皮癌中的表达显著高于卵巢上皮良性肿瘤,并且随着病理分期、组织学分级的增加呈上升趋势,说明整合素α5β1与卵巢上皮癌的发生发展有关。
整合素与ECM黏附可以促使黏着斑形成,进而激活FAK参与下游信号转导。去除细胞黏附可间接抑制FAK活性,进而诱导细胞凋亡。Zha[6]用竞争性多肽占领整合素β1亚基C端,FAK不能参与下游信号转导,最终导致细胞凋亡。表明即使细胞发生黏附,黏着斑也存在,只要胞内FAK功能被阻断,细胞同样发生凋亡。也说明FAK是介导细胞间、细胞与ECM信号转导的重要分子。在多种侵袭和转移细胞中FAK活性显著增加,其与肿瘤细胞生长及侵袭转移等生物学行为密切相关[7]。本研究结果显示,FAK在卵巢上皮癌中的表达显著高于卵巢上皮良性肿瘤;FAK在卵巢上皮癌中的表达主要与临床分期有关(P<0.05);与患者年龄、肿瘤组织学类型、细胞学分级、肿瘤大小无关(P>0.05)。说明FAK高表达在癌细胞的发生、浸润和转移过程中起重要作用。关于FAK的作用机制,田芳等[8]研究发现,绝大部分整合素可以激活 FAK转导的FAK-Cas-Crk-Ras-MAPK、FAKCas-Crk-MEK-ERK、FAK-PI3K-AKT、FAK-Ras-Rap-Raf-ERK等信号转导通路,FAK通过这些信号转导通路调节基因的转录以及细胞的增殖与凋亡。也有研究表明,FAK是胱冬肽酶(caspase)的底物,在凋亡的不同时期,多种caspase作用于FAK以去除FAK抑制凋亡的作用,使细胞最终凋亡。
综上所述,整合素α5β1和FAK的异常高表达与卵巢上皮癌的发生和进展密切相关,二者在卵巢上皮癌中的表达呈正相关,二者相互协同,促进卵巢上皮癌的发生、侵袭和转移,有望作为判定卵巢上皮癌预后、指导治疗的指标之一。
[1]Cox BD,Natarajan M,Stettner MR,et al.New concepts regarding focal adhesion kinase promotion of cell migrationand proliferation[J].J CellBiochem,2006,99(1):35.
[2]Gindberg MH,Partridge A,Shattil SJ.Integrin regulation[J].Curr Opin Cell Biol,2005,17(5):509-516.
[3]韦德英,刘鸣,汤春生.整合素及纤粘蛋白在调控卵巢癌细胞失巢凋亡过程中的作用[J].中国实用妇科与产科杂志,2007,23(12):926-928.
[4]Banerjia A,Chakrabartt J,Mitra A,et al.Effect of curcumin on gelatinase A(MMP-2)activity in B16F10 melanoma cells[J].Cancer Letters,2004,211(2):235-242.
[5]Mitra A,Chakrabartt J,Chatterjee A.Binding of α5 monoclonal antibody to cell surface α5β1integrin modulates MMP-2 and MMP-7 acsivity in B16F10 melanoma cells[J].J Environ Pathol Toxicol Oncol,2003,22(3):167-178.
[6]Zha XL.Progress of cell adhesion mediated singal--focal adhesion kinase[J].Acta Biochimicaet Biophysica Sinica,1999,31(1):5-8.
[7]Benlimame N,He Q,Jie S,et al.FAK signaling is critical for ErbB-2/ErbB-3 receptor cooperation for oncogenic.transformation and invasion[J].J Cell Biol,2005,171(3):505-516.
[8]田芳,缪泽鸿,章文雄,等.整合蛋白信号转导研究进展[J].生命科学,2005,17(3):240-245.

