初发 2型糖尿病患者血清铁蛋白水平的变化及意义
冯宪真,徐淑静,庄惠君,吴丹荣
(贵阳医学院附属医院,贵阳 550004)
氧化应激是胰岛素抵抗(IR)、糖尿病(DM)和心血管疾病的病理生理基础[1]。铁是氧自由基生成的一种催化剂,由铁催化形成 OH◦,是最活跃、最强力的氧自由基,可引起体内氧化应激水平增加,造成生物分子损伤。铁代谢影响糖代谢,而长期高血糖又损伤铁代谢通路,在相互关系中,氧化应激可能起到枢纽作用[2]。2009年 5~12月,我们观察了初发 T2DM患者血清铁蛋白(SF)水平及降糖药物治疗后 SF水平变化情况,以期探讨 SF与 T2DM的相关性。现报告如下。
1 资料与方法
1.1 临床资料 选择在我院住院的初发、未经治疗的 T2DM患者(T2DM组)50例,均符合 1999年WHO制定的诊断标准。其中,男 35例、女 15例,年龄(50.2±11.8)岁。同期选择我院健康体检者 32例作为对照组,男 22例、女 10例,年龄(49.1±11.9)岁,经口服 75 g葡萄糖耐量试验,排除 DM、空腹血糖及糖耐量异常者。入选对象均无急、慢性肝病史,肝功能正常;无急慢性感染、输血、贫血、血色病、肿瘤、妊娠、嗜酒;无服用铁剂史,并排除心、肾功能不全及其他内分泌疾病者。
1.2 方法 T2DM组采用胰岛素泵(诺和灵 R,诺和诺德公司)治疗,胰岛素从小剂量开始,根据血糖水平调整用量,并根据病情加用二甲双胍(格华止1.0~1.5 g/d,施贵宝公司),治疗 2周。分别于治疗前后检测各组 SF、空腹胰岛素(FINS)、空腹血糖(FPG)、血脂和血压等水平。采用双抗体夹心法测定 SF水平。用稳态模型评价胰岛素抵抗和 β细胞功能:HOMA-IR=FPG(mmol/L)×FINS(μIU/ml)/22.5;HOMA-B=20×FINS(μIU/ml)/[FPG(mmol/L)-3.5]。
1.3 统计学方法 采用 SPSS11.5统计软件,计量资料符合正态分布的用±s表示,偏态分布用中位数表示;计量资料正态分布比较采用 t检验、偏态分布采用秩和检验,计数资料采用 χ2检验;SF与临床资料的相关性采用 Pearson相关分析,HOMA-IR与其多个危险因素进行多元回归分析。P≤0.05为差异有统计学意义。
2 结果
2.1 两组临床检测指标比较 见表1。
2.2 治疗前后 FPG、SF水平比较 见表2。
2.3 T2DM组 SF与其临床指标的相关性分析T2DM组 SF与 BMI、腰围 、收缩压、FPG、TG、HOMAIR呈正相关 (r分别为 0.607、0.595、0.572、0.445、0.558、0.705,P均 <0.01),与 HDL-C呈负相关(r=-0.318,P<0.05);与舒张压、TC、LDL-C及 HOMA-B无明显相关性。
2.4 HOMA-IR与其它影响因素的多元回归分析以 HOMA-IR为应变量,以 SF、BMI、腰围、收缩压、TG、HDL-C为自变量进行多元回归分析,当选入变量的检验水准 α=0.05,SF、BMI进入回归方程,R2=0.674。
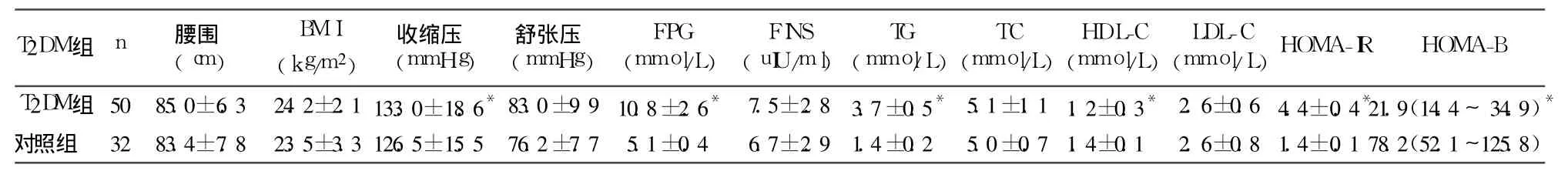
表1 两组基本特征及生化指标结果比较
表2 T 2DM组治疗前后 FPG、SF水平比较(±s)
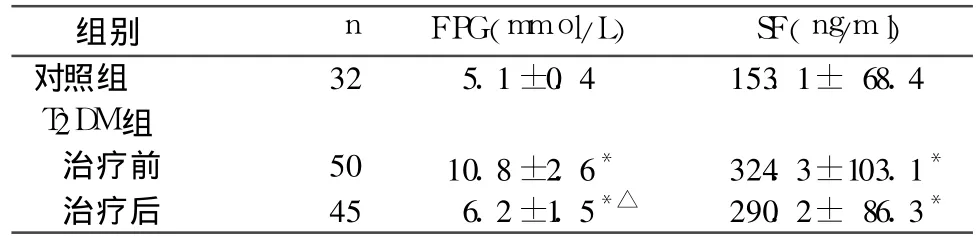
表2 T 2DM组治疗前后 FPG、SF水平比较(±s)
注:与对照组比较,*P<0.01;与同组治疗前比较,△P<0.01
组别 n FPG(mmol/L) SF(ng/ml)对照组 32 5.1±0.4 153.1± 68.4 T2DM组治疗前 50 10.8±2.6* 324.3±103.1*治疗后 45 6.2±1.5*△ 290.2± 86.3*
3 讨论
IR是 T2DM的发病机制之一。研究表明[3],体内铁过量与 IR关系密切。本研究发现,初发 T2DM患者HOMA-IR明显升高,提示T2DM患者存在明显的 IR。该组患者 SF水平明显增高,且与 HOMA-IR呈正相关,多元回归分析发现,SF是参与 HOMA-IR的独立变量,进一步支持上述观点。提示 SF水平可能在 T2DM的发生发展中起一定作用。但到目前为止,铁负荷过多导致 IR的确切机制还不清楚,可能通过以下 2条途径:①过多的铁沉积于肝脏导致对胰岛素摄取、灭活减少,造成外周高胰岛素血症[4]。②通过氧化应激反应产生过多的氧自由基,可降低肌肉组织、脂肪组织对糖的利用,同时影响细胞对胰岛素的摄取而引起 IR[5]。另外,高胰岛素血症可通过上调转录蛋白低氧诱导因子和下调铁调素表达,促进肠道对铁的吸收。胰岛素能促进脂肪细胞快速摄取铁,还可使转铁蛋白受体从胞内向细胞表面的重新分配,致体内铁储存增加[6]。
SF与血压的关系文献报道不一。Oshaug等[7]研究发现,SF水平能预测舒张压,而 Bains等[8]等报告 SF水平与 T2DM患者的收缩压呈正相关,与舒张压无关。本研究与 Bains的报告一致。但 SF对血压的影响机制尚不明确,可能是通过 IR间接影响血管壁弹性及阻力而起作用。因为 IR可直接使细胞膜钠钾泵、钙泵活性下降,细胞内钙增加,血管壁紧张性及对血管收缩物质的反应性增加,从而导致血压升高。另一可能机制是铁超载时自由基生成增多,体内氧化应激水平增加,产生过氧化物和氧化亚氮,降低血管舒张功能,从而使血压升高[9]。
代谢综合征以高血糖、高血压、血脂异常及肥胖为主要表现,共同的病理生理基础是 IR。无论在 DM患者还是非 DM患者,SF均与皮下脂肪、内脏脂肪、肝脏脂肪及 IR相关[10]。有学者认为,高 SF是代谢综合征的一个组成成分[11]。本研究发现,T2DM患者收缩压、TG明显升高,HDL-C水平明显降低,且 SF与腰围、BMI、TG、收缩压、FPG、HOMA-IR呈正相关 ,与HDL-C呈负相关,与上述研究结果一致。提示铁储备与 IR有密切关系,SF水平可能是临床评价 IR的一种有效指标。
给予改善 IR治疗或者降低血糖治疗对 SF水平的影响,目前研究报道尚不多见。本研究中初发T2DM患者经胰岛素和二甲双胍治疗 2周后,血糖明显下降,SF水平有所下降,但未达到统计学意义,可能与治疗时间不够有关。总之,我们认为 SF与IR的关系可能比与血糖的关系更为密切,而 IR的改善是一个相对缓慢的过程或铁代谢紊乱的恢复需要较长时间,延长治疗时间能否明显降低SF水平及不同种类降糖药对铁代谢有何影响有待进一步研究。
[1]Park K,Gross M,Lee DH,et al.Oxidative stress and insulin resistance:the coronary artery risk development in young adults study[J].Diabetes Care,2009,32(7):1302-1307.
[2]Fernandez-Real JM,Lopez-Bermejo A,Ricart W.Cross-talk between iron metabolism and diabetes[J].Diabetes,2002,51(8):2348-2354.
[3]Fargion S,Dongiovanni P,Guzzo A,et al.Iron and insulin resistance[J].Aliment Pharmacol Ther,2005,22(Suppl 2):61-63.
[4]Turlin B,Mendler MH,Moirand R,et al.Histologic features of the liver in insulin resistance-associated iron overload[J].Am J Clin Pathol,2001,116(2):263-270.
[5]Green A,Basile R,Rumberger JM.Transferrin and iron induce insulin resistance of glucose transport in adipocytes[J].Metabolism,2006,55(8):1042-1045.
[6]McCarty MF.Hyperinsulinemia may boost both hematocrit and iron absorption by up-regulating activity of hypoxia-inducible factor-1 alpha[J].Med Hypotheses,2003,61(5-6):567-573.
[7]Oshaug A,Bugge KH,Bjonnes CH,et al.Associationsbetween serum ferritin and cardiovascular risk factors in healthy young men:a cross sectional study[J].Eur J Cli Nutr,1995,49(6):430-438.
[8]Bains K,Kaur J.Food and nutrient intake in relation to cardiovascular disease among rural males of Punjob,Insia[J].Asia Pac JClin Nutr,2004,13(Suppl 1):S95.
[9]Ceriello A.Possible role of oxidative stressin the pathogenesisof hypertension[J].Diabetes Care,2008,31(Suppl 2):S181-S184.
[10]Iwasaki T,Nakajima A,Yoneda M,et al.Serumferritin isassociated with visceral fat area and subcutaneous fat area[J].Diabetes Care,2005,28(10):2486-2491.
[11]Jehn M,Clark JM,Guallar E.Serum ferritin and risk of the metabolic syndrome in U.S.adults[J].Diabetes Care,2004,27(10):2422-2428.

