磷霉素联合氨基糖苷类对产 ESBLs大肠埃希菌体外敏感性的影响
漆 坚,邓连瑞,周淑梅,任小菊
(南昌大学第四附属医院,南昌 330000)
抗菌药物联合应用是临床治疗严重细菌感染常采用的给药方案。大肠埃希菌是所有标本中分离率最高的细菌,且产超广谱 β内酰胺酶(ESBLs)的大肠埃希菌占所分离大肠埃希菌的 68.6%[1]。产 ESBLs的大肠埃希菌存在多重耐药,治疗困难。2010年 1~6月,我们观察了磷霉素(FOS)与 3种氨基糖苷类抗菌药物[庆大霉素(GM)、妥布霉素(TO)、阿米卡星(AMK)]单用及联用对产 ESBLs大肠埃希菌的抑菌效果并进行体外抗菌活性分析,旨在为临床联合用药治疗产 ESBLs大肠埃希菌感染提供依据。
1 材料与方法
1.1 材料 菌株来源:30株非重复产 ESBLs大肠埃希菌(分离自我院 2010年 1~6月各类标本中;按常规方法培养,挑取纯菌落接种到 NID2鉴定板,经美国德灵公司 Walk Away40型自动鉴定仪鉴定)。用双纸片扩散法检测 ESBLs。所选菌株经原始标本涂片革兰氏染色镜下观察及临床治疗符合致病菌。FOS、AMK、GM、TO(中国药品生物制品检定所);MH肉汤及琼脂(杭州天和微生物试剂有限公司)。美国德灵公司 Walk Away40型自动鉴定仪专用鉴定板(NID2);美国德灵公司 Walk Away40型全自动鉴定仪;比浊仪;96孔平板。
1.2 方法
1.2.1 细菌悬液配置 取已经分纯培养 24 h的 12种菌落接种于 MH肉汤中增菌 6 h,用生理盐水将菌液校正到 0.5麦氏比浊浓度,再用 MH肉汤将菌悬液稀释为 1.5×105cfu/ml。
1.2.2 药物敏感试验 严格按照《全国临床检验操作规程》行药物敏感试验(质控菌株为大肠埃希菌 ATCC25922),测定 30株产 ESBLs大肠埃希菌对FOS、GM、TO、AMK的耐药率。
1.2.3 FOS与 GM、TO、AMK的 MIC测定 依照临床实验室标准化协会(CLSI)推荐的方法,以微量肉汤稀释法测定 4种抗生素对 30株产 ESBLs大肠埃希菌的 MIC值。各药耐药折点:16μg/L≤GM,16 μg/L≤TO,64μg/L≤AMK,256μg/L≤FOS。
1.2.3 FOS与 GM、TO、AMK联合应用的抑菌指数(FIC指数)测定 采用棋盘稀释法将 FOS与其他 3种药物分别混合,根据所测定的 MIC,设置药物浓度为 1/16~2 MIC,按 2倍浓度递增后两两组合,加入96孔平板中,每种抗菌药物取 50μl,再将 1.5×105cfu/ml的菌液 100μl加入孔中,放置微量振荡仪上震荡 3 min,35℃孵育 18~24 h,以肉眼未见菌生长的两药最低浓度组合读取各药的联合 MIC,计算FIC指数。FIC指数 =MIC甲药联合/MIC甲药单用 +MIC乙药联合/MIC乙药单用。FIC指数≤0.5为协同作用;0.5<FIC指数≤1为相加作用;1<FIC指数≤2为无关作用;FIC指数 >2为拮抗作用。
2 结果
2.1 药物敏感试验 30株产 ESBLs大肠埃希菌对FOS、AMK、GM、TO的耐药率分别为 3.3%(1/30)、16.7(5/30)、66.7%(20/30)、43.3%(13/30)。
2.2 FOS与 GM、TO、AMK联合应用的 MIC值 见表1。
2.3 FOS与 GM、TO、AMK联合应用的 FIC指数见表2。
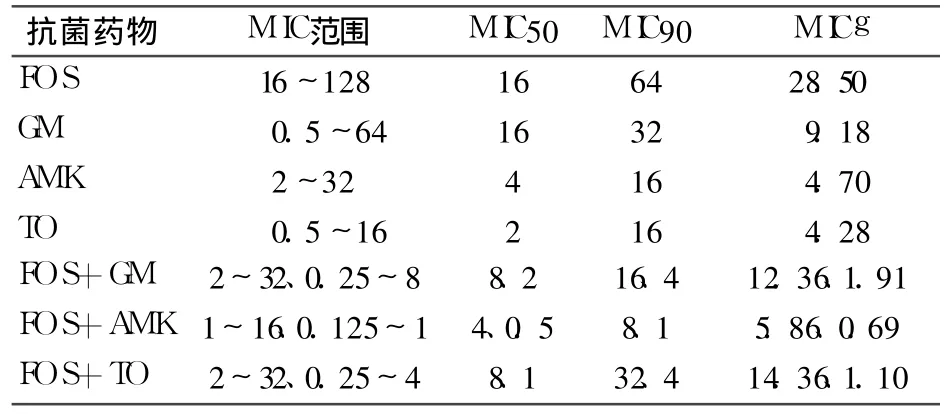
表1 30株产 ESBL大肠埃希氏菌对单药和联合用药的 MIC值(mg/L)

表2 抗菌药物联合作用的 FIC指数(n=30,%)
3 讨论
目前产 ESBLs大肠埃希菌引起的感染日益增多。自 1983年德国科学家首次从臭鼻克雷伯杆菌中分离出 HSV-2基因型 ESBL以来,其数量及种类在世界各地迅速增长,并有呈局部流行的趋势;其多重耐药,已引起世界各国的重视和关注。研究发现,产 ESBLs的大肠埃希菌不但对所有青霉素、头孢类及氨曲南耐药,且往往同时对喹诺酮类、大环酯类等多种抗生素多重耐药,临床治疗困难[1]。我们前期试验未发现对亚胺培南耐药的产 ESBLs的大肠埃希菌,FOS的耐药率为 3.4%,与头孢哌酮/舒巴坦耐药率 (1.7%)、哌拉西林/他唑巴坦耐药率(3.4%)相近,明显低于其他常用抗生素如左氧氟沙星、头孢西丁、AMK等,与文献报道一致[2]。
产 ESBLs的大肠埃希菌的治疗目前多使用碳青霉烯类或头孢类 +酶抑制剂的复合药物,临床可使用的抗菌药物有限。近年来青霉素类或头孢类 +酶抑制剂复合药物的耐药性逐步增加,且部分患者对上述药物过敏;碳青霉烯类抗菌药物抗菌谱广,对产 ESBLs大肠埃希菌有独特的抗菌作用,但其可诱导细菌同时产生 L2头孢菌素酶、L1金属锌酶,使其成为耐碳青霉烯类的细菌,同时诱导真菌等二重感染,且价格昂贵。有研究表明磷霉素联合氨基糖苷类抗菌药物可以提高后者的杀菌速度,降低其耳、肾毒性[3]。Mikuniya等[4]发现磷霉素对大肠埃希菌有强杀菌力,呈剂量依赖型,且磷霉素诱导 β-内酰胺酶只有头孢菌素的 1/25~1/65,认为磷霉素基本不选择、诱导 β-内酰胺酶产生,抗菌谱广;其因此成为治疗产 ESBLs的大肠埃希菌的新的选择[5]。氨基糖苷类抗菌药物对于细菌的作用主要是抑制其蛋白质合成,其性质稳定,抗菌谱广,对产 ESBLs的大肠埃希菌有较强的抗菌活性,但具有一定的肾毒性、耳毒性和神经肌肉接头阻断作用,限制了其临床应用。FOS具有独特的化学结构和抗菌作用机制,能够抑制细菌细胞壁合成,破坏其完整性,从而有利于其他抗菌药物进入细菌体内,通过不同的作用机制而杀灭细菌。FOS虽然抗菌谱广,但抗菌活性不强,临床常用于敏感菌引起的轻中度以下感染,中度以上尤其是重度感染应采用与其他抗菌药物联用的方式[6]。FOS与氨基糖苷类抗菌药物的作用靶点不同,联合应用可以明显增强药效,降低不良反应。此外 FOS与其他抗菌药无交叉耐药性,且有良好的协同作用,并能减轻其他抗生素对肝肾和神经系统的毒性,同时还能提高机体免疫机能。本研究结果显示,FOS与 3种氨基糖苷类抗菌药物联用主要为协同和相加作用,无关作用较少,未发现拮抗作用。证实 FOS分别与 AMK、GM、TO联合应用可明显降低产 ESBLs的大肠埃希菌的 MIC值,抗菌效果显著增强;临床治疗产 ESBLs大肠埃希菌感染时可考虑 FOS与氨基糖苷类抗菌药物联合应用。
[1]漆坚,程献,周淑梅,等.产 ESBLs大肠埃希菌对磷霉素的体外药敏结果分析[J].中国热带医学,2010,10(6)734-756.
[2]Hernández M,García J,Munoz J.In vitro activity of fosfomycin against ESBL-producing enterobacteria of urinary origin[J].Rev Esp Quimioter,2009,22(1):25-29.
[3]范燕,裴雯,梁蓓蓓,等.磷霉素与五种氨基糖苷类抗菌药物对20株铜绿假单胞菌的联合药敏研究[J].中国药物应用与检测,2007,18(1):47-49.
[4]Mikuniya T,Hiraishi T,Maebashi K,et al.Antimocrobial activity of fosfomycin under various conditions against standard strains,betalactam restant strains,and multidrug efflux system mutantslpn-J-Antibiot[J].Jpn J Antibio,2005,58(2):105-122.
[5]Akyar I.Antibiotic resistance rates of extended spectrum beta-lactamase producing Escherichia coli and Klebsiella spp.strains isolated from urinary tract infections in a private hospital[J].Mikrobiyol Bul,2008,42(4):713-715.
[6]黄祥,王健民,李勇.磷霉素的药动力药效学特性与临床应用[J].中国医院药学杂志,2005,25(2):156.

