抑制剂SB203580对肠易激综合征大鼠后连合核中小胶质细胞P38、ERK表达的影响
崔曼莉, 王景杰, 王旭霞, 杨 琦, 黄裕新 (第四军医大学唐都医院消化内科, 西安 710038;通讯作者,E-mail:jingjie@fmmu.edu.cn)
内脏高敏感性是肠易激综合征(irritable bowel syndrome,IBS)的重要病理特征。有研究表明IBS患者对肠扩张性刺激的疼痛阈值明显降低、疼痛强度增加,出现内脏高敏感现象,或导致正常肠道功能状态敏感性的显著增高(即异常性疼痛),甚至使内脏相对应的躯体牵涉痛的范围扩大[1]。IBS患者内脏的高敏感性具有放大效应,这一过程被称为致敏或刺激性痛觉过敏。有研究发现,外周神经的损伤可以产生放大的疼痛反应,同时激活脊髓神经胶质细胞,进一步采用NMDA拮抗剂MK801可以抑制产生的痛觉过敏和异常性疼痛,同时也抑制了神经胶质细胞[2]。上述研究提示,胶质细胞在病理性痛的产生和维持中有重要作用。有研究证实,MAPK-p38广泛存在于神经元和胶质细胞。MAPK-p38在调节和维持神经元和胶质细胞的稳态上发挥着重要的作用[3],而且对于活化和维持神经元、胶质细胞状态上也具有重要作用。
本实验在以旋毛虫感染大鼠成功制作IBS大鼠模型的基础上,采用直肠气囊充水造成压力感受刺激的方法,研究给予模型大鼠结肠扩张刺激和椎管内插管注射MAPK-p38特异性阻断剂SB203580,观察其腹直肌肌电、脊髓背角中MAPK-p38、ERK表达的变化,为研究IBS内脏敏化提供理论依据。
1 材料与方法
1.1 IBS动物模型制作 ①毛虫幼虫制备及传代由河南省CDC提供的保虫昆明鼠种鼠(旋毛虫系云黑龙江株)3只,脊髓脱臼法处死后剔除皮毛及内脏,剔取肌肉。将肌肉剪碎置于300 ml 2.5%胃蛋白酶和0.5%盐酸消化液中,置37℃水浴中消化12-20 h。经筛过滤,滤液用生理盐水反复沉淀洗涤3-5次,收集旋毛虫幼虫胞囊并计数。取昆明鼠20只,25 g左右,灌胃法给予0.1 ml含250-300条幼虫的生理盐水悬液。②感染大鼠后将传代感染的昆明鼠以颈椎脱臼法处死收集旋毛虫(方法同前)。③实验组大鼠灌胃法给予1 ml含4 000条幼虫囊胞的生理盐水悬液。被感染鼠饲养8周,抽检测定感染情况,确立模型成功制作[4]。
1.2 实验分组 15只IBS大鼠随机分为3组:IBS组(C组,n=5)、IBS结肠扩张刺激组(D组,n=5)、抑制剂组(E组,n=5);另10只正常大鼠随机分为2组:正常对照组(A组,n=5)、正常结肠扩张刺激组(B 组,n=5)。
1.3 结肠扩张刺激 对结肠扩张刺激组、IBS刺激组、抑制剂组进行结肠扩张刺激。将气囊缓慢插入大鼠直肠,进入到结肠距离肛门35 mm处固定,用注射器给气囊注入 1.0 ml蒸馏水[5]。
1.4 椎管内置管给药 对于IBS抑制剂组5只大鼠腹腔注射3%戊巴比妥钠(40 mg/kg)麻醉,按Yaksh等[6]方法鞘内置入PE-10导管至脊髓腰膨大处,插入深度2.5-4.0 cm。鞘内注射2%利多卡因20 μl,30 s内出现双下肢麻痹,表明导管位置准确。大鼠置于安静、温暖、避光的环境中饲养5 d,取置管后3 d无运动功能障碍的大鼠,取标本2 h前抑制剂组鞘内注射 SB203580 10 μl(30 μg,溶媒为2%DMSO),注药后均用0.9%NaCl 10 μl冲洗导管[7]。其余各组只打开椎板,不损伤脊髓,插入导管后固定缝合,不给予任何处理。
1.5 切片制备 将两组大鼠于戊巴比妥钠(40 mg/kg)麻醉下,开胸经左心室至升主动脉插管,先以100 ml生理盐水冲洗血液,随后用冷的(4℃)含40 g/L多聚甲醛的0.1 mol/L磷酸盐缓冲液(PB,pH7.4)先快后慢灌流固定2 h,取骶髓置于300 g/L蔗糖中(4℃)直至组织沉底,冰切片机以做冷冻连续冠状切片,片厚30 μm,切片分套,置于0.01 mol/L PBS中存放。
1.6 免疫荧光化学标记 P38-OX42免疫荧光染色:取3套切片在0.01 mol/L PBS中漂洗后,入含0.3%Triton X-100 的 0.01 mol/L PBS 中浸泡 30 min(室温)。然后分别入小鼠抗大鼠P38单克隆抗体稀释液(1∶500,Sigma)、兔抗大鼠OX42单克隆抗体稀释液(1∶500,Sigma)孵育24 h(室温);加入结合了荧光素的二抗:驴抗小鼠FITC(1∶500,Molecular Probes)单染P38以及山羊抗兔DyLight荧光标记OX42,避光孵育2 h(室温)。0.01 mol/L PBS洗3次后,DAPI染色液染细胞核(美国 Molecular Probes),80%甘油封片后,将各组切片各取10张,在confocal激光共聚焦显微镜下观察并采图,采用Image J 1.43图像分析软件,分析P38、ERK的荧光光度值。
ERK-OX42免疫荧光染色:染色步骤同上,一抗为小鼠抗大鼠ERK单克隆抗体稀释液(1∶500,Sigma)、兔抗大鼠OX42单克隆抗体稀释液(1∶500,Sigma),二抗为 FITC标记驴抗小鼠抗体(1∶500,Sigma)、山羊抗兔 DyLight荧光标记二抗(1∶500,Molecular Probes)。
1.7 统计学分析 所有数据采用SPSS15.0软件进行分析,以±s表示;荧光半定量经ImageJ 1.43软件进行处理,各组间差异采用ANOVA方差分析进行比较,P<0.05为差异有统计学意义。
2 结果
2.1 骶髓后角中 P38、ERK表达的变化 P38-OX42实验结果显示,在给予刺激后结肠扩张刺激组大鼠脊髓后角中P38、OX42表达水平升高(P<0.05);IBS组大鼠 P38、OX42表达亦较高,且与正常对照组和结肠扩张刺激组比较差异明显(P<0.05);IBS扩张刺激组大鼠骶髓后角中P38、OX42表达处于较高水平,与正常对照组大鼠比较差异显著(P <0.01,见表 1、图 1,见第 693 页)。抑制剂组在给予SB203580后P38表达明显下降,同时OX42水平降低,且差异显著(P<0.01),虽仍高于正常大鼠表达水平,但二者比较无统计学差异(P>0.05,见表1、图1,)。
骶髓后角ERK表达情况与P38类似,在给予刺激后,结肠扩张刺激组大鼠骶髓后角中ERK、OX42表达亦处于较高水平,与正常对照组大鼠比较差异显著(P<0.05);IBS组大鼠 ERK、OX42表达水平高于正常组和结肠扩张刺激组(P<0.05);IBS扩张性刺激组大鼠骶髓后角中P38表达处于较高水平,与正常组大鼠比较差异显著(P<0.01),抑制剂组大鼠在给予SB203580后ERK、OX42表达略下降,但差异无统计学意义(P>0.05),见表1、图2。
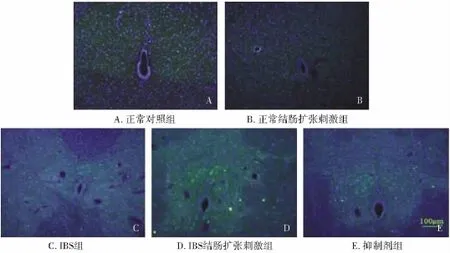
图1 抑制剂SB203580对骶髓DCN中P38和OX42表达的影响Fig 1 Effect of inhibitor SB203580 on expression of P38,OX42 in sacral DCN

图2 抑制剂SB203580对骶髓DCN中ERK和OX42表达的影响Fig 2 Effect of inhibitor SB203580 on expression of ERK,OX42 in sacral DCN
表1 骶髓DCN中P38、ERK表达荧光光度值(OD)变化(n=5,±s)Tab 1 OD value of P38,ERK expression in sacral DCN(n=5,±s)
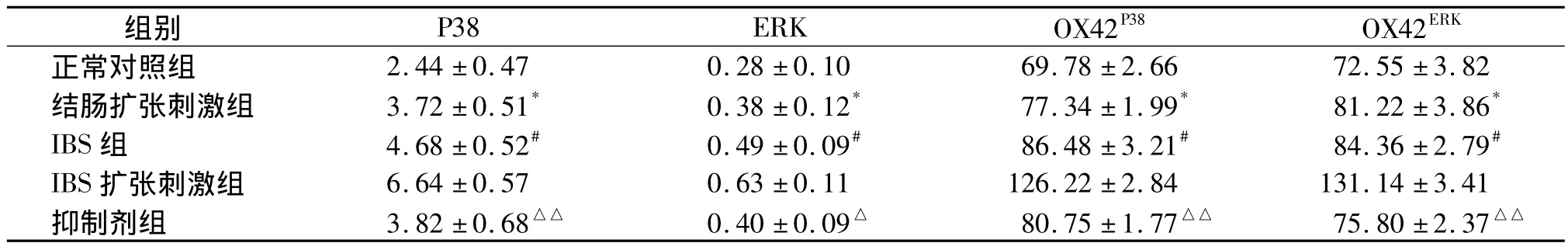
表1 骶髓DCN中P38、ERK表达荧光光度值(OD)变化(n=5,±s)Tab 1 OD value of P38,ERK expression in sacral DCN(n=5,±s)
与正常对照组比较,*P<0.05;与结肠扩张刺激组比较,#P <0.05;与 IBS扩张刺激组比较,△P <0.05,△△P<0.01
组别 P38 ERK OX42P38 OX42ERK 2.44 ±0.47 0.28 ±0.10 69.78 ±2.66 72.55 ±3.82结肠扩张刺激组 3.72 ±0.51* 0.38 ±0.12* 77.34 ±1.99* 81.22 ±3.86*IBS 组 4.68 ±0.52# 0.49 ±0.09# 86.48 ±3.21# 84.36 ±2.79#IBS 扩张刺激组 6.64 ±0.57 0.63 ±0.11 126.22 ±2.84 131.14 ±3.41抑制剂组 3.82 ±0.68△△ 0.40±0.09△ 80.75 ±1.77△△ 75.80 ±2.37正常对照组△△
2.2 各组腹直肌肌电变化 对各组大鼠进行腹直肌肌电检测可见IBS组与正常对照组大鼠腹直肌肌电相似,频率和波幅无明显差异(P>0.05);结肠扩张刺激组与IBS扩张刺激组肌电变化明显,频率及波幅明显高于对照组(P<0.05);然而给予抑制剂SB203580后,肌电频率及波幅明显趋于平稳,与IBS结肠扩张刺激组比较差异明显(P<0.05),与正常对照组和IBS组大鼠比较无明显差异(P>0.05),见图3,表2。

图3 抑制剂SB203580对结肠扩张刺激引起的IBS大鼠腹直肌肌电影响Fig 3 Effect of inhibitor SB203580 on myoelectricity of rectus abdominis in IBS rats caused by stimulation of colorectal distention
表2 抑制剂SB203580对结肠扩张刺激引起的IBS大鼠腹直肌肌电频率、波幅变化(n=5,±s)Tab 2 Effect of inhibitor SB203580 on myoelectricity frequency and amplitude of rectus abdominis in IBS rats caused by stimulation of colorectal distention(n=5,±s)

表2 抑制剂SB203580对结肠扩张刺激引起的IBS大鼠腹直肌肌电频率、波幅变化(n=5,±s)Tab 2 Effect of inhibitor SB203580 on myoelectricity frequency and amplitude of rectus abdominis in IBS rats caused by stimulation of colorectal distention(n=5,±s)
与正常对照组比较,*P<0.05;与IBS结肠扩张刺激组比较,#P <0.05
组别 频率/(min-1) 波幅/μV 3.23 ±0.33 23.42 ±6.89结肠扩张刺激组 3.52 ±0.61* 50.20 ±8.77*IBS 组 3.55 ±0.19 24.88 ±8.35 IBS结肠扩张刺激 3.83 ±0.11* 76.34 ±10.71*抑制剂组 3.48 ±0.28# 26.74 ±7.67正常对照组#
3 讨论
有丝分裂原激活蛋白激酶p38(mitongen-activated protein kinase,MAPK)是一组酶兼底物的蛋白分子,其中MAPK更具有广泛的催化活性,MAPK在胞质信号转导中起着重要作用,主要包括:Ras/ERK,JNK/SAPK和MAPK-p38,分别通过三种信号转导通路表达[8]。以往的研究表明,在组织和神经损伤后MAPK通过不同的细胞和分子生物学途径促成疼痛敏化。MAPK-p38广泛存在于神经元和胶质细胞,在调节和维持神经元和胶质细胞的稳态及对于活化和维持神经元、胶质细胞状态上也具有重要作用。活化的MAPK-p38可能通过多种机制参与IBS内脏痛敏的形成和发展:伤害性刺激诱发的伤害性神经递质,如谷氨酸和P物质的释放均能引起Ca2+内流,引起细胞内Ca2+浓度升高,促使p38MAPK激活和磷酸化[9],p-p38MAPK 活化磷酯酶 A2(PLA2),作用于细胞膜磷脂使花生四烯酸的表达明显增加,花生四烯酸再通过环氧化酶(COX)的作用而生成前列腺素(PG)[10]。因此,p38作为特异的反应在小胶质细胞的细胞信号转导途径中的调节通路,其意义十分重要。
P38主要位于细胞质中,其余MK5共表达并锚定掩盖MK5的NSL,使得MK5转移至细胞质中;而MK5的T182的磷酸化可以激活NES,使得MK5从胞核转移至细胞质中,但以前者为主。除了能被p38激活外,MK5还能被ERK3持续激活,P38通过与MK5结合将其锚定在胞质中,MK5随即以自主磷酸化或其他方式激活。有研究发现在MK5缺陷细胞中ERK3的水平显著下降,而ERK3缺陷时MK5的活性也会下降,说明二者之间也可以形成类似于p38-MK2的稳定复合体,来参与机体的调节。
本实验室前期研究提示[11-13],当单纯电针刺激足三里穴位时,调节胃肠运动的神经中枢DCN中cfos的表达明显增加,提示神经元被激活,而且DCN中的GFAP和OX42的表达明显增高,提示神经胶质细胞也被显著激活。同时,同步观察到胃电的波幅和频率亦产生明显变化。给予胶质细胞代谢阻断剂后发现神经元的活化功能也降低,说明神经胶质细胞和神经元之间是相互影响的。而且同步记录的胃电活动情况与正常对照组均有明显的降低。由此得出,电针刺激足三里穴调节胃运动,不完全是神经元活动的结果,胶质细胞也参与了该调节运动。胶质细胞的活化及其释放的促炎症释放因子是痛觉过敏产生的基础。
本实验通过给予IBS大鼠MAPK抑制剂发现,脊髓DCN中P38、ERK表达明显受到抑制,同时OX42表达水平亦明显降低,说明小胶质细胞活动也受到抑制,进一步证实在IBS内脏高敏感情况下DCN中小胶质细胞功能与P38信号转导途径密切相关。电生理学角度亦表明给予抑制剂后大鼠腹肌电波幅、频率均与IBS结肠扩张刺激组大鼠比较有明显降低。由此分析,在脊髓层面上给予治疗不但可以抑制中枢神经系统疼痛神经递质的传递,更可有效缓解IBS内脏痛敏。为今后治疗IBS内脏高敏感的药物探索和研发提供了新的靶点和途径。
[1] 孙刚,杨云生,彭丽华,等.肠易激综合征大鼠内脏敏感性和脊髓背角5-HT和 c-fos的表达[J].世界华人消化杂志,2007,15(25):2718 -2722.
[2] 孙怡宁,罗金燕,商澎,等.脊髓背角N-甲基-D-天冬氨酸受体在结肠炎大鼠内脏高敏感性中的作用[J].中南大学学报:医学版,2005,30(5):123 -126.
[3] Ji Ru-Rong,Suter MR.P38 MAPK,microglial signaling,and neuropathic pain[J].Mol Pain,2007,3(1):33 -41.
[4] 夏德雨,王景杰,颜云龙,等.直肠扩张刺激引起IBS大鼠痛行为学以及腹肌电活动的变化[J].胃肠病学和肝病学杂志,2007,16(3):260 -263.
[5] 黄裕新,王景杰,姜惠玲,等.大鼠结肠扩张性刺激引起内脏活动变化的实验研究[J].胃肠病学和肝病学杂志,2006,15(2):119-122.
[6] Yaksh TL,Rudy TA.Chronic catheterization of the spinal subarachnoid space[J].Physiol Behav,1976,17:1031 -1036.
[7] 龚琴,胡兴国,刘艳阳,等.脊髓背角p38MAPK活化在大鼠切口痛形成中的作用[J].中国疼痛医学杂志,2009,15(4):226-228.
[8] Ru-Rong JI,Robert W,Gereau IV,et al.MAP kinase and pain[J].Brain Res Rev,2009,60(1):135 -148.
[9] Enslen H,Tokumitsu H,Stork PJ,et al.Regulation of mitogen-activated protein kinases by a calcium/calmodulin-dependent protein kinase cascade[J].Proc Natl Acad Sci USA,1996,93:10803-10808.
[10] Samad TA,Moore KA,Sapirstein A,et al.Inter-leukin-1beta-mediated induction of Cox-2 in the CNS contributes to inflammatory pain hypersensitivity[J].Nature,2001,410:471 -475.
[11] 夏德雨,王景杰,陆松鹤,等.直肠扩张刺激引起IBS大鼠痛行为学以及骶髓DCN中神经元和胶质细胞的变化[J].胃肠病学和肝病学杂志,2007,16(6):589 -593.
[12] 王景杰,王胜智,夏德雨,等.结肠扩张刺激对P2X4受体在IBS大鼠神经中枢中表达的影响[J].胃肠病学和肝病学杂志,2008,17(10):813 -817.
[13] 黄裕新,王景杰,王胜智,等.胶质细胞参与电针足三里对胃运动的调节作用[J].山西医科大学学报,2007,38(10):886-889.

