副猪嗜血杆菌江西分离株药物敏感性及四环素耐药基因tet(B)分析
宋德平,肖根辉,王 萍,何后军,邬向东,黄冬艳,邓舜洲,张文波
(江西农业大学动物科技学院/预防兽医学,江西 南昌 330045)
副猪嗜血菌(Haemophilus parasuis,Hps)是格拉泽氏病(Glasser's disease)的病原菌,是健康猪上呼吸道的常在菌,在机体受应激或感染导致免疫力下降时引起保育仔猪及青年猪发生纤维素性多发性浆膜炎[1]。近年来,猪繁殖与呼吸综合征、猪圆环病毒病等免疫抑制性疾病常继发Hps感染而增加发病率和死亡率,给养猪业造成了严重的损失[2]。
Hps分为15个血清型,各血清型间缺乏有效的交叉保护力,常由于疫苗血清型与发病菌血清型不同而导致免疫失败。所以,目前多用药物进行预防和治疗。但这也使得该菌对药物的敏感性发生改变。报道显示,近些年来Hps的耐药性越来越严重,而且不同时间不同地域分离株的药物敏感性存在较大的差异[3-5]。获得关于Hps的药物敏感性信息将有助于该地区对该菌引发疾病的防制。
目前,关于Hps耐药机制的研究较少。已报道的有四环素耐药基因tet(B)、青霉素耐药基因blaROB及林可胺类耐药基因lnu(C),这些耐药基因均位于质粒中[6-7]。检测四环素耐药基因(tet)是检测四环素耐药性的重要手段。在众多tet中,tet(B)是介导肠道菌四环素耐药性的重要基因[8-9]。Lancashire等在对澳大利亚分离株耐药性分析时发现两个介导四环素耐药的质粒pHS-Tet和pHS-Rec,均含有tet(B)[5]。前者还含有一个质粒转运基因mobABC,提示Hps的四环素耐药性可能是获得性的。本实验检测了20株江西株的药物敏感性,获得对江西株敏感的药物,从而为该菌的防制提供依据。同时设计特异性引物检测tet(B),为研究江西株耐药的分子机制及其与血清型和毒力之间的关系奠定基础。
1 材料和方法
1.1 待检测菌株 2008年11月~2010年3月从江西省4个市32个规模化养猪场的80份发生纤维素性心包炎、浆膜炎、关节炎及脑膜炎的经临诊为Hps感染的病例中分离得到20株革兰氏阴性、细小的多形态杆菌。经细菌形态、生化鉴定及PCR鉴定确定为Hps,并由本实验室保存。
1.2 主要试剂 TSA和TSB购自DficoTM公司;新生小牛血清购自杭州四季青有限公司;NAD购自上海生工生物工程技术服务有限公司;标准药敏试纸片、青霉素G等共9大类57种抗生素购自杭州天和微生物试剂有限公司;ExTaqDNA聚合酶和dNTPs购自北京全式金生物有限公司;600 bp DNA Marker购自宝生物工程(大连)有限公司;DL2000 DNA Ladder购自北京天根生物科技有限公司。
1.3 培养基 每100 mL TSA和TSB培养基中各加入经过滤除菌的0.05%烟酰胺腺嘌呤二核苷酸(NAD)1 mL及无菌新生小牛血清5 mL,混匀后立即倾倒平板。
1.4 菌株的复壮 将保存菌种以100 μL 37℃TSB溶解后接种于含NAD及新生小牛血清的TSA培养基,37℃培养24 h后挑取单个菌落接种于新平板上,过夜培养。
1.5 药物敏感性试验 挑取复壮后的菌落3个~5个接种于TSB培养基中,每株菌接种2管~3管,37℃180 r/min振荡培养16 h。将菌液调至与麦氏比浊管第3管(大约3×108cfu/mL)一致。将制备的菌液涂布TSA培养基,于恒温箱内作用15 min,待液体稍干后贴标准药敏试纸片。37℃培养24 h后测量抑菌圈直径,并重复1次,取其平均值为最终抑菌直径。依据CLSI/NCCLS标准,区分为耐药(R)、中介(I)、敏感(S)3种药物感受态。
1.6 tet(B)的PCR检测 根据NCBI登录的标准序列(AY862435.1)设计引物,Tet(B)-1a:5'-TGGTTA GGGGCAAGTTTTGG-3',Tet(B)-1b:5'-GAGCATTG GTAAGGCTC-3',预期目的条带大小为640 bp,由Invetrogen公司合成。PCR反应条件为:94℃5 min;95℃ 60 s、50℃ 60 s、72℃ 90 s,35个循环。产物琼脂糖凝胶电泳分析,阳性产物由上海英俊生物有限公司进行双向测序。并进行特异性和灵敏度试验。采用建立的方法对江西株进行tet(B)分析。
2 结 果
2.1 Hps江西株的药物敏感性试验 参照CLSI/NCCLS标准判定结果,各分离株对各药物的敏感性存在一定的差异。其中,对该菌敏感性较好的药物有:氨苄西林/舒巴坦、阿莫西林/棒酸、头孢呋辛、头孢噻吩、阿奇霉素、左氟沙星及奈替米星。所有试验菌株对阿洛西林、万古霉素均高度敏感。80%及以上的分离株对氨苄西林/舒巴坦、阿莫西林/棒酸、头孢洛克、头孢呋辛、头孢噻吩、妥布霉素、阿奇霉素、左氟沙星、奈替米星等高度敏感。所有菌株对头孢菌素的敏感性较高,在使用的14种头孢菌素中除头孢唑林和头孢曲松敏感性较差外,其他药物的敏感率为65%~90%(表1)。

表1 HPs江西株的药物敏感性分析Table 1 Analysis of drug sensitivity in Hps Jiangxi isolates
2.2 Hps江西株的耐药性 20株试验菌存在不同程度的耐药性,其中,对恩诺沙星、氨曲南、四环素、头孢唑林、洛洛美沙星、青霉素G、羧苄青霉素、头孢曲松、链霉素及林可霉素的耐受性较强(表2)。全部菌株均对多种药物具有抗性,部分菌株能够耐受5种以上的药物,甚至有2株菌能够耐受多达22种药物(表2)。
2.3 Hps江西株的耐药性与血清型之间的关系 20株江西分离株对抗生素均存在耐药性,每一种血清型均存在耐药菌株。由表3可见,高毒力血清型(血清4型、5型和13型)的耐药频数为69,占总耐药频数的60%,比中低毒力及无毒力血清型的耐药频率高,血清4型菌株的耐药频率与其血清型频率相差较大,可能是由于临床用药种类与本实验统计药物不同所致。经卡方检验表明高毒力菌株与中低毒力及无毒力血清型的耐药性差异不显著(p>0.05)。3株不可分型菌株的耐药频数为28,占总耐药频数的24.35%(图 1)。
2.4 Hps江西株与其他分离株的药物敏感性比较本实验江西株的耐药性普遍高于其他研究报道结果。与Zhou等的结果比较,耐药性增幅较大的药物有:青霉素、氨苄西林、红霉素、四环素、庆大霉素[10]。而青霉素、氨苄西林曾被认为是治疗Hps病较为有效的药物,长期的大量使用势必会导致耐药性的积累。四环素和庆大霉素也是猪场的常用药物。本研究与其他国家分离株相比也存在很大的耐药性差异,整体的耐药性比英国分离株强,但与西班牙分离株相近。除对恩诺沙星的耐药性远高于西班牙分离株外,对青霉素、氨苄西林、磺胺甲恶唑/TMP等药物的耐药性略低于西班牙分离株,而对头孢噻呋和恩诺沙星的耐药率高于西班牙分离株。因此,本实验结果再一次证实了不同地区、不同时间分离的菌株药物敏感性存在较大的差异。

表2 Hps江西株的耐药表型Table 2 Resistence phenotype of Hps isolates from Jiangxi Province
表3 Hps江西株血清型与耐药频率分布Table 3 Distribution foH.parasuisserovars and antimicrobial antimicrobial resistance among different serovars

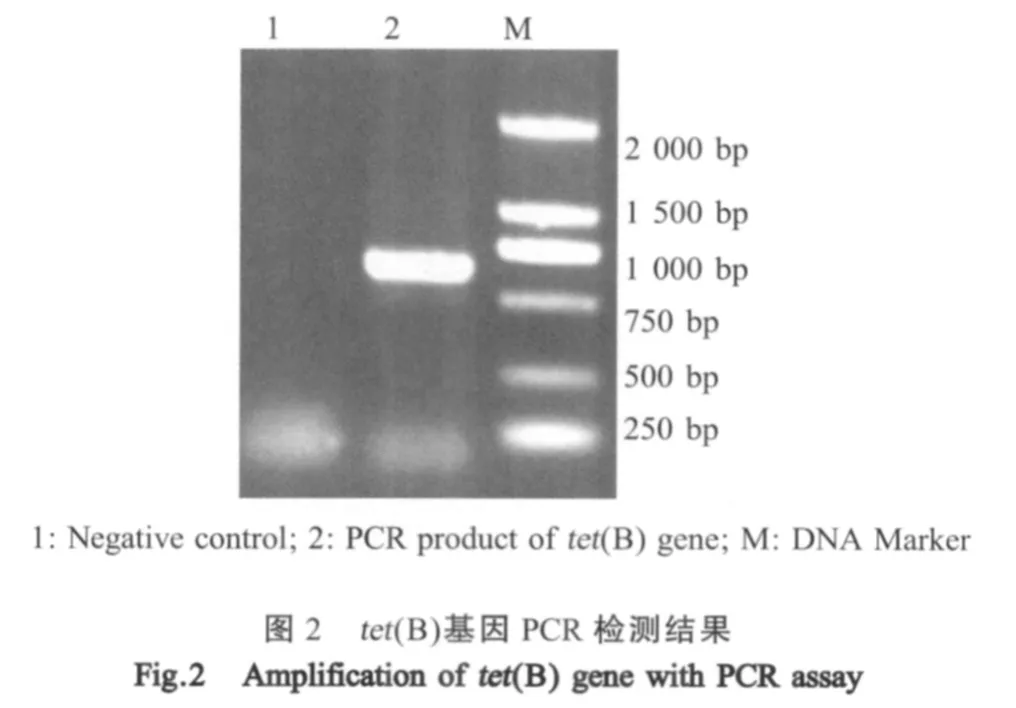
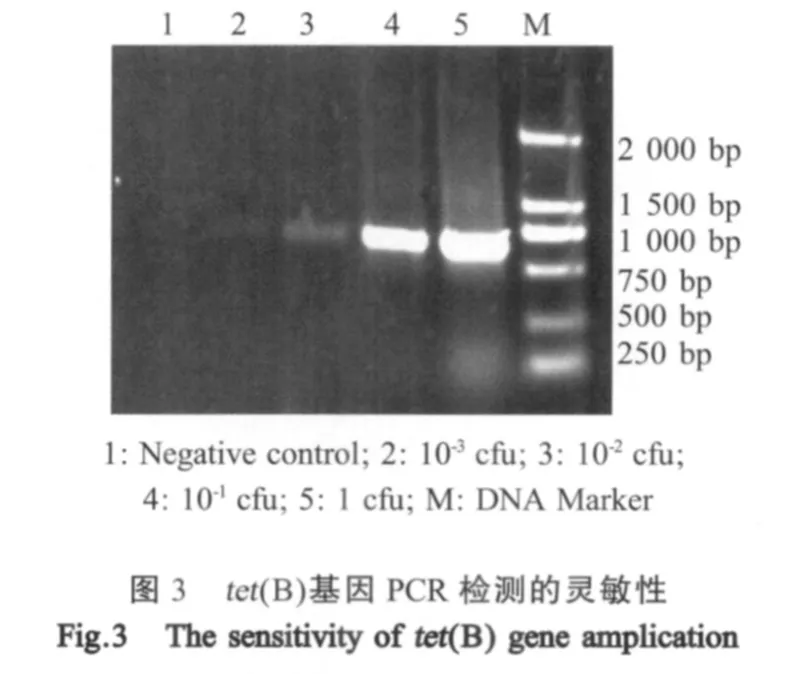
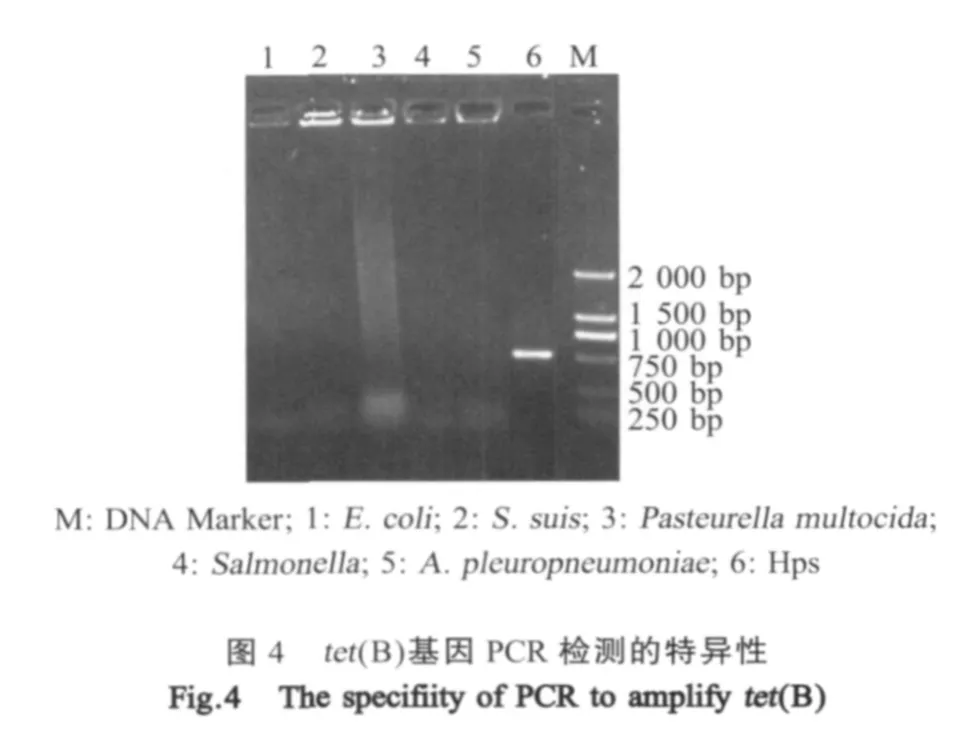
2.5 tet(B)PCR检测方法的建立 应用本研究建立的方法从江西分离株中对耐四环素的Hps中扩增出大小约为640 bp的产物,与预期相符,产物测序后经比对表明所扩增的条带为tet(B),与NCBI上登录的tet(B)基因序列同源性为97%~98%(图2)。所建立的方法具有较高的灵敏度,最少检出菌量为10-3cfu(图3)。特异性试验表明该方法只能扩增出对四环素耐药的Hps中的tet(B)基因,不能从对四环素敏感的Hps中检测出该基因,也不能检测出对四环素耐药的链球菌、葡萄球菌、巴氏杆菌、胸膜肺炎放线杆菌、猪沙门氏菌中的耐药基因tet(B)(图4)。
2.6 Hps江西株四环素耐药基因tet(B)的检测 运用建立的方法检测20株江西分离株的tet(B)基因。结果表明,在14株对四环素耐药的菌株中,有8株菌存在tet(B)基因,7株四环素敏感菌株中未检出该基因,另外有一株未进行血清分型但对四环素有抗性的景德镇分离株也检测到了tet(B)基因。
3 讨论
本实验检测了20株江西株对57种药物的敏感性,系统地研究了Hps江西株的药物敏感性。结果表明存在一些对江西株高度敏感的药物,这些药物可以用于猪场对该病进行预防和治疗。但江西株也存在较为严重的耐药性,与其他不同地区和时间段分离株相比,江西株对四环素、青霉素及恩诺沙星等的耐药性大大增加。全部菌株均存在多重耐药,但大多在5种药物以下,有部分菌株能够耐受5种以上的药物,甚至有2株菌能够耐受多达22种药物,这可能与现今养猪业大量不合理的使用抗生素有关。研究报道,在细菌分离之前使用药物治疗对细菌的分离以及分离菌对药物的抗性有较大影响。因此,文献报道中的差异非常大的抗药性很可能与细菌分离前使用抗生素有关[11]。本研究采集的样品前期大多使用抗生素治疗过,但这也许更真实地反应当前分离株对药物的耐受情况。
四环素是猪场经常使用的保健和治疗药物,其作用机理主要通过阻止氨酰tRNA与细菌核糖体结合来抑制细菌蛋白质合成[11],但不影响哺乳动物细胞核糖体及细胞功能。自1980年Mender等第一次在肠杆菌科和假单胞菌质粒中发现四环素耐药基因以来,在多种病原菌内已经发现和鉴定至少29个不同的tet基因和3个otr基因[12]。四环素耐药性的分布存在多样性,不同细菌、宿主种类及地理位置等都表现出四环素耐药基因的差异。一般认为,革兰氏阴性基因细菌的耐药机制以抗生素的导出泵机制为主,对猪体内细菌及肠道细菌而言,其决定导出泵的耐药性基因以tet(B)为主[13]。本研究建立了检测tet(B)的PCR方法,并从20株江西分离株中检测出9株菌含tet(B)基因,表明tet(B)是介导HPs对四环素耐药的主要原因之一,但还可能存在其他的机制介导这些菌株对四环素的耐药性,这有待于进一步研究。
[1]Oliveira S,Pijoan C.Haemophilus parasuis:new trends on diagnosis,epidemiology and control[J].Vet Microbiol,2004,99:1-12.
[2]Narita M,Kawashima K,Matsuura S,et al.Pneumonia in pigs infected with pseudorabiesvirusand Haemophilusparasuis serovar 4[J].J Comp Pathol,1994,110:329-339.
[3]Fuente A J,Tucker A W,Navas J,et al.Antimicrobial susceptibility patterns of Haemophilus parasuisfrom pigs in the United Kingdom and Spain[J].Vet Microbiol,2007,120:184-191.
[4]Aareatrup F M,Seyfarth A M,Angen O.Antimicrobial susceptibility of Haemophilus parasuisandHistophilus somnifrom pigs and cattle in Denmark[J].Vet Microbiol,2004,101:143-146.
[5]John F L,Tamsin D T,Blackall P J.Plasmid-Encoded tetB tetracycline resistance inHaemophilus parasuis[J].Antimicrobial Agentsand Chemotherapy,2005,49:1927-1931.
[6]Alvaro S M,Jose A E.β-Lactam resistance inHaemophilus parasuisis mediated by plasmid pB1000 bearing blaROB-1[J].Antimicrob Agents Chemother,2007,5(6):2260.
[7]Chen Li-ping,Cai Xu-wang,Wang Xiang-ru,et al.Characterization of plasmid-mediated lincosamide resistance in a field isolate of Haemophilus parasuis[J].J Antimicrob Chemother,2010,10:2256-2258.
[8]Chopra I,Roberts M.Tetracycline antibiotics:mode of action,application,molecularbiology and epidemiology of bacterical resistance[J].Microbiol Biol Rev,2001,65(2):232.
[9]刘维红,徐引弟,郭爱珍,等.致病性猪沙门氏菌四环素耐药基因tetB的PCR检测[J].中国抗生素杂志,2006,31(11):51-54.
[10]Zhou Xue-li,Xu Xiao-juan,Zhao Ya-xin,et al.Distribution of antimicrobial resistance among different serovars of Haemophilus parasuisisolates[J].Vet Microbiol,2010,141:168-173.
[11]McMurry L M,Levy S B.Tetracycline resistance in gram-positive bacteria[A].Washington D C:Amer Soc Microbiol,2000,660-667.
[12]Manabu F,Tsuneo S,Toshimichi M,et al.Similarity of tetracycline resistance genes isolated from fish farm bacteria to those from clinical isolates[J].Appl Environ Microbiol,2003,9:5336-5342.
[13]Lee C,Langlois B E,Dawson K A.Detection of tetracycline resistance determineants in pig isolates from tree herds with different histories of antimicrobial agent exposure[J].Appl Environ Microbiol,1993,59(5):1467.

