GOLFIG-1方案治疗进展期大肠癌的临床疗效与免疫反应之间的关系Δ
朱志图,刘阳阳,王锴,李恩泽,郁云龙(.辽宁医学院附属第一医院肿瘤科,锦州市 00;.天津市海洋石油总院普内科,天津市 30045)
大肠癌患者初诊时大约20%~25%的新病例为伴有转移的晚期大肠癌[1],而那些接受根治性治疗的早期患者,也有1/3的病例会出现疾病转移复发而成为晚期,也即在所有大肠癌患者中大约有一半的病人最终属于晚期大肠癌[2]。多药联合化疗仍是晚期大肠癌最重要的治疗手段之一,代表方案有FOLFIRI和FOLFOX,单独应用这些方案或联合贝伐单抗及西妥昔单抗,这些治疗方案对晚期结肠癌患者可诱导高反应率和延长疾病进展时间以及总生存期,但无论应用以上何种组合方案,患者生存时间(OS)仍然不超过20~25个月[3]。因此,当患者花费了巨额的医疗费用、承受了沉重的心理负担以及经受反复的药物毒副反应,而仅仅换来了数月的生存期延长时,我们不得不面对一个严肃的问题:性价比。Correale应用GOLFIG-1方案治疗晚期大肠癌已经证实其安全性、有效性以及强大免疫生物学活性[4]。GOLFIG-1是一种创新型的生物化学免疫治疗方案,是由GOLF(吉西他滨、奥沙利铂、亚叶酸钙、及5-氟尿嘧啶)以及IG生物免疫方案(重组人粒巨噬细胞集落刺激因子、白介素-2(IL-2))共同组成[5]。Correale在前期试验验研究中证实本方案可诱导转移性大肠癌患者高反应率,特别是在那些出现自身免疫反应的患者[3]。本研究重点讨论这种全新治疗方案在转移性大肠癌患者所引起自身免疫反应与临床结论之间的关系。
1 资料与方法
1.1 临床资料
1.1.1 纳入标准。年龄在18岁以上、组织学证实为结直肠腺癌并伴有远处转移、美国东部肿瘤协作组行为状态评分(ECOG PS)≤3、肝肾功能正常、白细胞计数≥2500·mm-3、血红蛋白≥9 g·dL-1、血小板计数≥100000·mm-3及心功能正常。
1.1.2 排除标准。任何重要器官的衰竭、中枢神经系统受累、继发恶性肿瘤、急性感染期、自身免疫性疾病以及获得性免疫缺陷综合征(AIDS)或严重的免疫抑制。
1.1.3 病例特点。根据入组标准,2009年1月共有结肠癌患者8例、直肠癌患者4例进入研究。患者年龄35~65岁,中位年龄45岁,其中男性7例,女性5例;6例伴有肝转移,4例伴有肺转移,2例伴腹膜转移,10例接受过手术治疗。所有患者均接受过包括FOLFOX和/或FOLFIRI以及XELOX方案治疗。病例特点见表1。

表1 病例特点(n)Tab 1 Characteristics of medical cases(n)
1.2 治疗计划
所有病人签署知情同意书并且接受双周的化疗方案。共用药物为:吉西他滨1.0mg·m-2,静脉注射,第1天;奥沙利铂85mg·m-2,静脉注射,第2天;亚叶酸钙100mg·m-2,静脉注射,第1、2天;5-氟尿嘧啶 400mg·m-2,静脉注射,第1、2天,800mg·m-2,持续静脉输注(civ)第1、2天;重组人粒巨噬细胞集落刺激因子100μg,皮下注射,第3~7天;IL-20.5×106u ,皮下注射,bid,第8~14天。
1.3 治疗评估
1.3.1 不良反应评估。按NCI-CTCAE v3.0分级标准执行[6],分为0~4级。
1.3.2 评价标准。近期疗效评价按RECIST1.1实体瘤疗效评价标准对客观缓解率进行评价[7],即完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。CR和PR在首次评价4周后进行疗效确认。以CR+PR率作为客观有效率(RR),以CR+PR+SD率作为临床收益率(CBR)。远期观察的主要终点定为OS,OS定义为从入组之日开始至任何原因导致死亡之日之间的时间。
1.4 统计学方法
所有数据用SPSS16.0版软件进行统计、处理及分析,计数资料采用χ2检验,均数采用t检验,以P<0.05为差异有统计学意义。采用Kaplan-Meier方法进行生存分析,应用Cox模型进行多因素分析,确立影响预后的独立因素。
2 结果
2.1 不良反应
全组患者总共完成化疗64周期(中位6周期),2例应用到第2周期因病情进展停止治疗。化疗中出现的不良反应有发热、骨髓抑制、恶心呕吐、腹泻、黏膜炎等。50%患者在应用IL-2后出现低热;20%患者出现中度乏力和疲劳、Ⅰ~Ⅱ°血液毒性(包括白细胞降低、贫血及血小板下降,发生率分别为33%、32%、10%)、可逆性Ⅲ~Ⅳ°的贫血和血小板下降(发生率分别为4%、10%);Ⅰ~Ⅱ°的恶心呕吐发生率为20%;Ⅰ~Ⅲ°腹泻和黏膜炎占18%。这些副反应一般发生在应用化疗药物后的7~10 d并持续数天之久。应用重组人粒巨噬细胞集落刺激因子引起的骨痛和应用奥沙利铂后引起的神经毒性也在一部分患者中出现。没有证据表明这些表现是免疫介导的反应。4例在治疗结束后的4~6个月出现单个或多个关节炎症,表现为关节的疼痛肿胀,急性炎症表现为非特异性炎性标志物升高。其中,关节炎症主要集中在膝关节、肘关节、肩关节、手腕或手等部位,并经过超声及核磁共振证实滑膜积液或腱鞘炎存在,经非类固醇类抗炎药治疗后缓解而有些患者表现为自限性。需要指出这4名患者在治疗开始前从未出现过上述症状,也未曾患过此类疾病。
2.2 疗效观察
截至2010-05-10,8名病例死亡,除2例因治疗过程中病情进展未完成计划周期数外,其余患者均接受评价,3例CR,2例PR(RR为41.7%),2例SD(CBR为58.3%),5例PD。出现免疫反应症状患者与未出现者疗效比较见表2。

表2 出现免疫反应症状患者与未出现者疗效比较Tab 2 Comparison of clinical efficacy between patients with immune response and patients without immune response
12例的中位OS为235 d(77~478 d),其中未出现免疫反应患者均已死亡,出现免疫反应的4名患者至今仍存活。以Kaplan-Meier方法所作生存分析见图1。
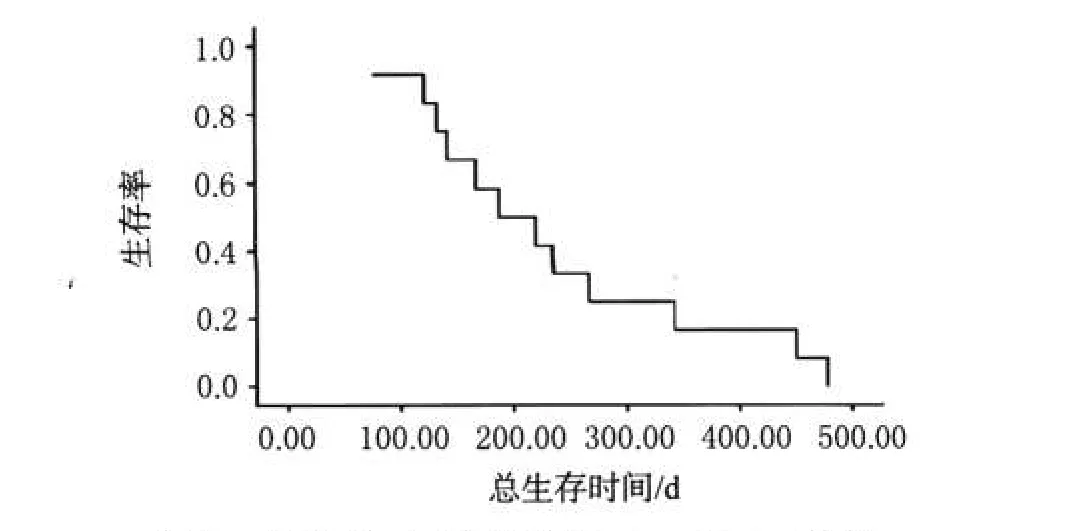
图1 患者总生存时间的Kaplan-Meier曲线Fig 1 Kaplan-Meier curve of overall survival time of patients
4例出现自身免疫反应的患者的OS明显长于未出现自身免疫反应的患者。多因素分析证实了出现自身免疫反应为最重要的预测变量,其OS延长。不同的预后变量的多因素Cox回归分析见表3。
3 讨论
肿瘤是机体和环境多因素多环节共同作用所产生。这也就决定了肿瘤的治疗注定是多学科多手段的综合治疗。然而多学科的综合治疗不仅仅是简单的治疗方法的罗列,我们希望出现1+1>2的效果。这必然要求我们所应用的治疗方法间有密切的契合点,并能起到疗效放大作用。为此,国外学者设计了以吉西他滨、奥沙利铂、亚叶酸钙、5-氟尿嘧啶、重组人粒巨噬细胞集落刺激因子及IL-2为基础的GOLFIG-1方案。

表3 不同的预后变量的多因素Cox回归分析Tab 3 Multivariate Cox regression analysis of different prognostic variables
GOLFIG-1方案是基于以下几种假设[5]:(1)GOLF化学方案可诱导肿瘤细胞凋亡,使肿瘤细胞分子层面发生改变并释放肿瘤相关抗原;(2)IG生物免疫方案可增加外周树突状细胞以及细胞毒性T淋巴细胞的数量和活性;(3)释放的抗原特异性细胞毒性T淋巴细胞特异性杀伤肿瘤细胞;(4)肿瘤免疫格局的改变[8]。GOLF方案作用机制为诱导细胞凋亡而且诱导大肠癌细胞上调一些相关抗原的释放和产生,例如癌胚抗原、胸苷酸合成酶以及含肽丰富的热休克蛋白,可以刺激树突状细胞及抗原特异性细胞毒T淋巴细胞(简称特异性CTL)前体引发更为有效的免疫反应;同时可导致淋巴细胞减少,但它不仅仅是改变了淋巴细胞的数量,各淋巴细胞亚群的比例及功能也发生选择性的变化,而且对淋巴细胞诱生的免疫微环境也产生了改变。更为重要的是它打破了此微环境中的肿瘤免疫的格局,即抑制肿瘤免疫的调节性T细胞的比例和功能下调,供给肿瘤抗原特异性淋巴细胞增殖的细胞因子相应增多,抗原提呈细胞能力增强,肿瘤特异性淋巴细胞增殖加速。免疫应答的出现有利于打破肿瘤免疫耐受、诱导抗肿瘤免疫的方向发展。以上机制也恰恰是应用重组人粒巨噬细胞集落刺激因子和IL-2的应用基础。应用重组人粒巨噬细胞集落刺激因子和IL-2增强了抗原提呈从而产生更强而且有效的抗原特异性CTL反应,促进了肿瘤免疫向正常方向的发展,且增进了肿瘤免疫的重建。粒细胞的减少以及肿瘤免疫改建的高峰期出现在应用化疗药的7~14 d,这也正是应用IL-2以及重组人粒巨噬细胞集落刺激因子的最佳时机。
癌症患者中出现自身免疫反应与治疗效果和生存期有紧密的联系,其他学者在不同的试验及临床观察中也发现了这种关系。Correale在GOLFIG-1的临床试验中发现在出现皮损和关节炎这些自身免疫临床症状患者的OS均明显高于其他患者[3]。在本实验中出现自身免疫反应的4名患者也证明了这一点。同时在Correale的前期基础试验中发现病人出现中性粒细胞、红细胞、血小板下降的过程中,外周的淋巴细胞嗜酸细胞以及活化的中心记忆性T淋巴细胞数目增加。更为重要的是调节性T细胞的亚群也进行性下降[9]。调节性T细胞具有免疫调节、维持自身耐受的功能,在防治自身免疫疾病中起关键作用。然而,调节性T细胞抑制抗肿瘤免疫反应。随着肿瘤的进展,调节性T细胞的比例在肿瘤引流淋巴结中上升。以上论述也正是治疗过程中自身免疫反应出现的原因,同时也是本方案化学治疗和生物治疗的契合点。而导致之一事件发生的使动因素是肿瘤抗原的表达和构象的改变。总之,GOLFIG-1方案抗肿瘤活性和自体免疫反应是紧密相关的。
化疗序贯生物治疗进展期大肠癌是一种安全、有效的治疗方法,有较高的有效率和临床收益率。在临床上,对此类患者又多了一种较好的治疗方法,但要评价其长期疗效还需进一步增加样本量和随访时间。
[1]McCracken M,Olsen M,Chen MS,et al.Cancer incidence,mortality,and associated risk factors among Asian Americans of Chinese,Filipino,Vietnamese,Korean,and Japanese ethnicities[J].CA Cancer J Clin,2007,57(4):190.
[2]He J,Gu D,Wu X,et al.Major causes of death among men and women in China[J].N Engl Med,2005,353(11):1124.
[3]Correale P,Tagliaferri P,Fioravanti A,et al.Immunity feedback and clinical outcome in colon cancer patients undergoing chemoimmunotherapy with gemcitabine+FOLFOX followed by subcutaneous granulocyte macrophage colony-stimulating factor and aldesleukin(GOLFIG-1 Trial)[J].Clin Cancer Res,2008,14(13):4192.
[4]Correale P,Fioravanti A,Bertoldi I,et al.Occurrence of autoimmunity in a long-term survivor with metastatic colon carcinoma treated with a new chemoimmunotherapy regimen[J].J Chemother,2008,20(2):278.
[5]Correale P,Cusimg,Tsang KY,et al.Chemo-immunotherapy of metastatic colorectal carcinoma with gemcitabine plus FOLFOX 4 followed by subcutaneous granulocyte macrophage colony-stimulating factor and interleukin-2 induces strong immunologic and antitumor activity in metastatic colon cancer patients[J].J Clin Oncol,2005,23(35):8950.
[6]Basch E,Iasonos A,McDonough T,et al.Patient versus clinician symptom reporting using the National Cancer Institute Common Terminology Criteria forAdverse Events:results of a questionnaire-based study[J].Lancet Oncol,2006,7(11):903.
[7]Shanbhogue AK,Karnad AB,Prasad SR.Tumor response evaluation in oncology:current update[J].J Comput Assist Tomogr,2010,34(4):479.
[8]储以微,温锦娣,熊思东.淋巴细胞减少状态下的肿瘤免疫格局改变及其意义[J].中国肿瘤生物治疗杂志,2007,14(1):7.
[9]林榕波,范南峰,陈 玲.GOLFIG-1在化疗耐药转移性结肠癌中的疗效[J].世界华人消化杂志,2009,17(32):3346.

