罗格列酮对糖尿病视网膜病变大鼠视网膜NF-κB表达的影响△
苟文军 欧阳科 吕红彬 李青兰
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最常见的微血管并发症和人类最严重的致盲眼病之一。由于DR发病机制错综复杂,关于其确切有效的治疗方法尚不明确。目前,有学者指出早期控制DR炎症有望成为对DR进行早期治疗的新靶点[1]。而过氧化物酶体增生物激活受体-γ(peroxisome proliferator-activated receptor-γ,PPAR-γ)激动剂罗格列酮可以通过增加PPAR-γ的活性促进血糖控制,同时还具有降低血脂、抑制纤维蛋白溶酶原激活因子抑制物-1、改善血管内皮细胞功能以及调节炎症反应等作用[2-3]。因此,本实验通过观察罗格列酮对链脲佐菌素(streptozotocin,STZ)诱导的早期DR大鼠模型视网膜上核因子-κB(nuclear factor-κB,NF-κB)表达的影响,探讨PPAR-γ激动剂和NF-κB之间的关系,以帮助我们进一步了解PPAR-γ激动剂在DR过程中发挥抑制炎症反应的作用,从而研究PPAR-γ激动剂对早期DR的保护作用,为预防及早期治疗DR提供一种新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组 健康雄性Wistar大鼠90只,体质量180~200 g,SPF级,购自重庆腾鑫生物技术有限公司。动物一般情况良好,皮毛光泽,进食与活动正常。自由光线条件下适应性喂养7 d。随机分为3组:正常对照组(C组)、DR+罗格列酮组、DR组,每组大鼠各30只。
1.1.2 试剂与仪器 STZ(美国Sigma公司);罗格列酮(北京上草生物科技有限公司);兔抗大鼠NF-κB p65单克隆抗体(北京中杉公司);Accu-CHEK型血糖仪及其配套血糖试纸(瑞士罗氏公司);眼科显微剪、显微镊(美国Alcon公司);前房穿刺刀(美国Alcon公司)。
1.2 实验方法
1.2.1 STZ液的配制 临用前将STZ溶解于0.1 mmol·L-1柠檬酸三钠-柠檬酸缓冲液中(pH 4.5),制成10 g·L-1STZ液。其中,柠檬酸三钠-柠檬酸缓冲液由 0.1 mmol·L-1柠檬酸三钠母液和 0.1 mmol·L-1柠檬酸母液按体积比1∶1.32配制而成。
1.2.2 模型的建立 建模前将90只Wistar大鼠禁食12 h(禁食不禁饮),DR组与DR+罗格列酮组一次性腹腔注射50 mg·kg-1STZ,C组一次性给予等体积的柠檬酸三钠-柠檬酸缓冲液(pH 4.5)腹腔注射,注射后使用代谢笼单只喂养,每天观察垫料湿润程度和进食、饮水量。72 h后尾静脉测血糖(罗氏Accu-CHEK型血糖仪及配套血糖试纸),空腹血糖超过16.7 mmol·L-1视为造模成功。自糖尿病模型建立后第3天起,DR+罗格列酮组每天给予罗格列酮(3 mg·kg-1)灌胃,DR组和C组每天给予等体积的生理盐水灌胃。每隔2周测一次血糖及体质量(在实验进程中,当大鼠的血糖 >30.0 mmol·L-1时,用精蛋白重组人胰岛素注射液3~4 U皮下注射,以降低死亡率),分别于给药后4周、8周及12周时测血糖并处死各组大鼠。
1.2.3 取材及眼杯制作 分别于给药后4周、8周和12周处死各组大鼠。处死大鼠前先测各组大鼠的血糖。然后禁食12 h,称体质量后以10 g·L-1戊巴比妥钠溶液4 mL·kg-1腹腔内注射,待麻醉显效后将大鼠固定于手术台上。剪开大鼠胸部皮肤及胸廓组织后暴露出心脏,剪开左心室尖,插入供灌注用的自制专用9号灌注针头至升主动脉,止血钳夹闭主动脉并固定灌注针头,先用生理盐水100 mL以40 mL·min-1推注,后快速推注40 g·L-1多聚甲醛200 mL左右(防止视网膜神经节细胞变性),直到大鼠全身僵硬。完整取出大鼠的左右眼球,分别放入事先已编号且盛有含40 g·L-1多聚甲醛的青霉素瓶中,30 min后用前房穿刺刀穿刺前房,2 h后将角膜、晶状体剔去制成眼杯(大鼠的玻璃体极少)[4]。再将眼杯置于同一瓶中,取出眼杯后依次梯度酒精脱水,二甲苯透明,石蜡包埋供免疫组织化学使用。
1.2.4 HE染色 每个石蜡块取1张切片行HE常规染色。光学显微镜下观察大鼠眼球壁及视网膜各层组织结构情况。
1.2.5 免疫组织化学染色 石蜡切片常规脱蜡至水,PBS 浸泡 5 min,抗原修复(0.1 mmol·L-1枸橼酸盐缓冲液预热至92~98℃,放入微波炉内92~98℃加热5 min,自然冷却至室温),PBS冲洗5 min,3 mol·L-1过氧化氢孵育10 min消除内源性过氧化物酶活性,PBS冲洗5 min,滴加10 mol·L-1正常山羊血清(PBS缓冲液稀释)封闭游离的结合位点,减少非特异性染色,室温孵育15 min倾去,分别滴加1∶20稀释的NF-κB p65单克隆一抗。阴性对照组用PBS代替一抗,4℃过夜,PBS冲洗5 min,滴加生物素标记的二抗IgG,37℃孵育15 min,PBS冲洗5 min,滴加辣根酶标记链霉卵白素工作液,37℃孵育15 min,PBS冲洗,DAB显色,自来水冲洗,苏木素复染后封片。胞核或胞浆被染成棕黄色或棕褐色为阳性细胞,在高倍镜下(400×)每张切片选取视网膜3~5个不连续视野,用Image-ProPlus 6.0彩色图像分析系统对图像中阳性反应部位进行分析。用棕黄色或棕褐色阳性颗粒的积分光密度(integral optical density,IOD)值表示 NF-κB p65 的表达。
1.3 统计学处理 采用SPSS 13.0软件分析系统对所得数据进行统计分析,各指标采用±s表示。组间均数比较用单因素方差分析,组间多重比较采用q检验(Student-Newman-Keuls)法,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 模型组大鼠腹腔注射STZ后72 h血糖明显升高。随着病程进展,DR组与DR+罗格列酮组大鼠血糖持续稳定在21~30 mmol·L-1,并逐渐出现多饮、多食、多尿、消瘦等糖尿病典型症状,皮毛逐渐失去光泽、精神萎靡、活动减少等。
2.2 大鼠视网膜组织的病理学观察(HE染色)
光学显微镜下观察发现,C组大鼠视网膜组织在光镜下分为10层,各层排列有序、层次分明:视锥、视杆层细胞排列整齐,外核层、外丛状层、内核层、内丛状层各层细胞无肿胀,视网膜神经节细胞层细胞无水肿;神经纤维排列有序。DR组大鼠视网膜视锥、视杆层细胞排列紊乱、水肿,外核层、外丛状层、内核层、内丛状层各细胞排列疏松、紊乱,细胞水肿,视网膜神经节细胞层细胞水肿、溶解(图1)。
2.3 模型建立后各时间点血糖与体质量测定结果
3 组大鼠造模后血糖值的比较见表1,由表1可以看出:在给药后4周、8周和12周时,DR组大鼠血糖明显高于 C 组(q4周=20.72、q8周=23.78、q12周=30.98,均为P<0.01),DR+罗格列酮组大鼠血糖值亦高于 C 组(q4周=19.91、q8周=22.96、q12周=29.75,均为P<0.01);而DR+罗格列酮组与DR组大鼠血糖值相比,差异无统计学意义(q4周=0.81、q8周=0.82、q12周=1.23,均为P>0.05)。3 组大鼠造模后体质量变化比较见表2,由表2可以看出:在给药后4周、8周和12周时,DR组大鼠体质量较C组降低(q4周=4.28、q8周=2.97、q12周=4.46,均为P<0.05),DR+罗格列酮组大鼠体质量亦低于 C组(q4周=3.86、q8周=3.86、q12周=3.72,均为P<0.05),但DR+罗格列酮组与DR组大鼠体质量相比变化不大,差异均无统计学意义(q4周=0.43、q8周=0.87、q12周=0.76,均为P>0.05)。
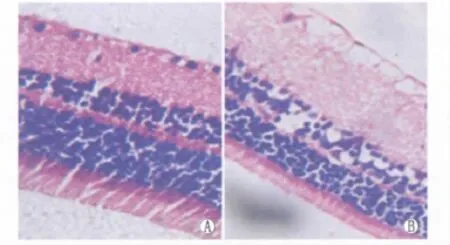
Figure 1 Structure of rat retina in C group and DR group under light microscope(HE,×200).A:Retina of rats in C group;B:Retina of rats in DR group 光镜下观察C组与DR组大鼠视网膜各层组织结构(HE,×200)。A:C组大鼠视网膜;B:DR组大鼠视网膜
表1 3组大鼠造模后血糖值的比较Table1 Comparison of blood glucose among three groups after injecting STZ(±s,c/mmol·L-1)

表1 3组大鼠造模后血糖值的比较Table1 Comparison of blood glucose among three groups after injecting STZ(±s,c/mmol·L-1)
Note:Compared with C group,*P <0.01
Group n Blood glucose among three groups at differenttime 4 weeks 8 weeks 12 weeks C 10 4.48 ±0.884 4.58 ±0.897 4.05 ±0.633 DR 10 21.74 ±3.340* 21.58 ±2.437* 24.33 ±2.219*DR+rosiglitazone 10 21.06 ±2.978* 21.38 ±2.263* 23.52 ±2.723*F 137.7 182.3 307.8 P <0.01 <0.01 <0.01
表2 3组大鼠体质量变化的比较Table2 Comparison of weight among three groups(±s,w/g)
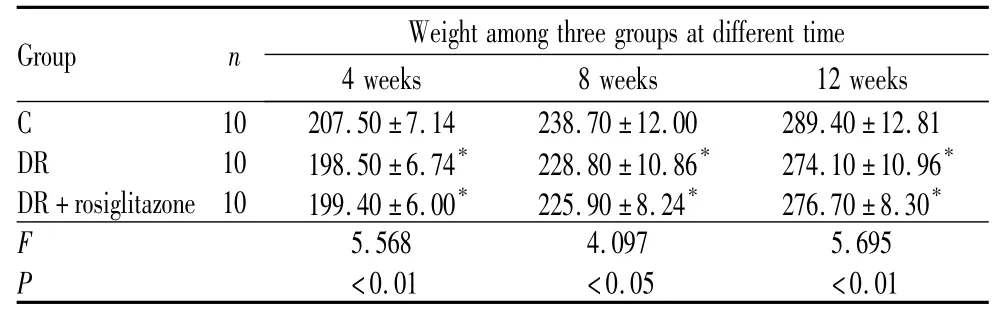
表2 3组大鼠体质量变化的比较Table2 Comparison of weight among three groups(±s,w/g)
Note:Compared with C group,*P <0.05
Group n Weight among three groups at different time 4 weeks 8 weeks 12 weeks C 10 207.50 ±7.14 238.70 ±12.00 289.40 ±12.81 DR 10 198.50 ±6.74* 228.80 ±10.86* 274.10 ±10.96*DR+rosiglitazone 10 199.40 ±6.00* 225.90 ±8.24* 276.70 ±8.30*F 5.568 4.097 5.695 P <0.01 <0.05 <0.01
2.4 免疫组织化学染色观察视网膜上NF-κB p65蛋白的表达 光学显微镜下观察发现,C组大鼠视网膜神经节细胞层NF-κB p65无表达或弱表达(图2);在给药后4周、8周和12周时,DR组大鼠视网膜上NF-κB p65的表达较C组明显增多(图3),差异有统计学意义(q4周=48.41、q8周=146.50、q12周=108.30,均为P<0.01,表3)、DR+罗格列酮组大鼠视网膜上NF-κB p65的表达亦高于C组(图4),差异均有显著统计学意义(q4周=46.01、q8周=128.70、q12周=92.99,均为P<0.01,表3);在给药后 8 周和12周时,DR+罗格列酮组大鼠视网膜上NF-κB p65的表达较DR组减少,差异均有显著统计学意义(q8周=17.77、q12周=15.30,均为P< 0.01,表3);而在4周时,DR+罗格列酮组大鼠视网膜上仍可见大量NF-κB p65阳性表达,与DR组相比差异无统计学意义(q4周=2.40,P>0.05,表3)。
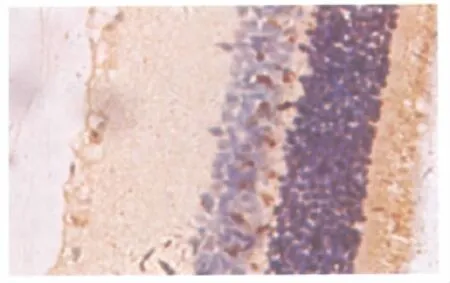
Figure 2 There was no expression of NF-κB p65 expression in rat retina of C group under light microscope(SABC staining,×400)光镜下观察C组大鼠视网膜神经节细胞层未见NF-κB p65表达(SABC染色,×400)
表3 3组大鼠NF-κB p65的IOD值比较Table3 Comparison of IOD value of NF-κB p65 among three groups (¯± s)

表3 3组大鼠NF-κB p65的IOD值比较Table3 Comparison of IOD value of NF-κB p65 among three groups (¯± s)
Note:Compared with control group,*P <0.01;Compared with DR group,**P <0.01
Group n IOD value of NF-κB p65 4 weeks 8 weeks 12 weeks C 10 1.52 ±0.27 1.58 ±0.12 1.56 ±0.13 DR 10 35.62 ±2.99* 67.59 ±2.23* 85.62 ±3.55*DR+Rosiglitazone 10 33.94±2.40* 59.58±1.06** 73.74±2.32**F 744.4 6 388.0 3 435.0 P <0.01 <0.01 <0.01
3 讨论
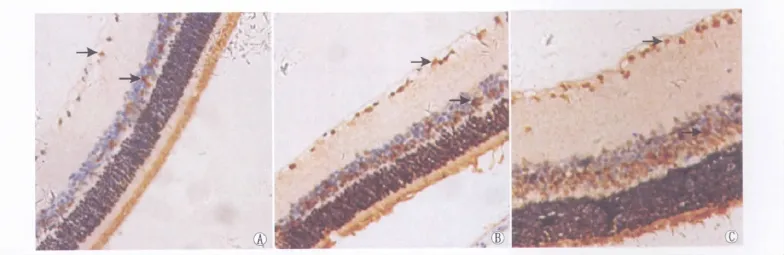
Figure 3 NF-κB p65 expression in rat retina of DR group at 4 weeks,8 weeks and 12 weeks under light microscope(SABC staining,×400).A:At 4 weeks,there was expression of NF-κB p65 in rat retina(black arrow);B:At 8 weeks,there was more expression of NF-κB p65 in rat retina(black arrow);C:At 12 weeks,there was lots of expression of NF-κB p65 in rat retina(black arrow) 光镜下观察给药后4周、8周和12周时DR组大鼠视网膜上NF-κB p65的表达 (SABC染色,×400)。A:在给药后4周,大鼠视网膜见NF-κB p65表达(黑色箭头);B:在给药后8周,大鼠视网膜上NF-κB p65表达较多(黑色箭头);C:在给药后12周,大鼠视网膜上见大量NF-κB p65表达(黑色箭头)
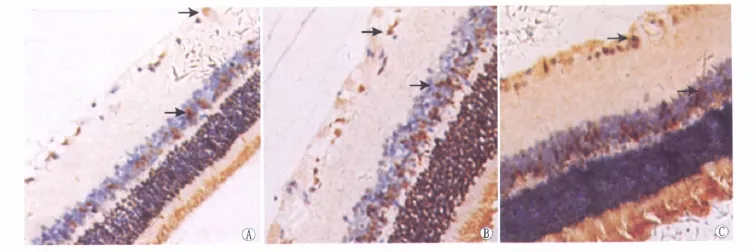
Figure 4 NF-κB p65 expression in rat retina of DR+rosiglitazone group at 4 weeks,8 weeks and 12 weeks under light microscope(SABC staining,×400).A:At 4 weeks,NF-κB p65 expression was almost same in rat retina in DR+rosiglitazone group compared with DR group(black arrow);B:At 8 weeks,NF-κB p65 expression was lower significantly in rat retina in DR+rosiglitazone group compared with DR group(black arrow);C:At 12 weeks,NF-κB p65 expression was lower significantly in rat retina in DR+rosiglitazone group compared with DR group(black arrow) 光镜下观察给药后4周、8周和12周时DR+罗格列酮组大鼠视网膜NF-κB p65的表达(SABC染色,×400)。A:在给药后4周,大鼠视网膜上仍可见大量NF-κB p65阳性表达(黑色箭头);B:在给药后8周,大鼠视网膜上NF-κB p65的表达较DR组明显减少(黑色箭头);C:在给药后12周,大鼠视网膜上NF-κB p65的表达较DR组明显减少(黑色箭头)
应用一次性腹腔注射大剂量STZ的方法诱导的糖尿病大鼠模型是目前公认的经典的研究DR的动物模型。本实验采用一次性腹腔注射50 mg·kg-1STZ制作糖尿病大鼠模型,并在给药后4周、8周和12周时分别测定血糖发现DR组和DR+罗格列酮组大鼠血糖值明显高于C组,差异均有显著统计学意义(均为P<0.01),且随着病程的进展血糖稳定>21 mmol·L-1并出现“三多一少”糖尿病典型症状。在糖尿病模型建立后,我们通过HE染色观察各组大鼠视网膜组织发现,C组大鼠视网膜组织在光镜下分为10层,各层排列有序、层次分明,各层细胞均完整无水肿,视网膜神经节细胞无溶解;而DR组大鼠视网膜组织各层排列紊乱、松散,各细胞排列紊乱,并出现细胞水肿、肿胀,且在视网膜神经节细胞层发现有细胞溶解。因此,应用一次性腹腔注射50 mg·kg-1STZ的方法制作的糖尿病大鼠模型具有成模率高、稳定性好的特点,基本符合人类疾病自然发病情况,有利于DR的科学研究。
DR是糖尿病最常见的微血管并发症之一,其主要的特征是视网膜微血管的闭塞和渗出,最终可导致视网膜新生血管的形成和失明。其发病机制和代谢通路现在仍不明确。目前,有学者提出DR是一种炎症性疾病[5],持续的高血糖可导致视网膜代谢功能异常,从而激活NF-κB等核转录因子,使炎症因子产生增加,导致视网膜毛细血管内皮细胞功能障碍和周细胞丢失、血-视网膜屏障损害,最终导致视网膜缺血缺氧和新生血管的形成。NF-κB是一种广泛存在于真核细胞胞浆中的核转录因子,与DR的发生发展关系密切。NF-κB的活化导致纤维连接蛋白(fibronectin,FN)表达上调,降低内皮细胞的运动和复制,使视网膜毛细血管内皮细胞增殖和毛细血管基底膜增厚[6],导致视网膜内皮细胞增殖,促进视网膜新生血管的形成。Yoshida等[7]研究发现,缺氧诱导的NF-κB激活可导致中性粒细胞趋化剂产生,参与诱导视网膜新生血管的形成。他们还应用NF-κB抑制剂吡咯烷二硫代氨基酸酯注入视网膜新生血管小鼠模型眼内,发现新生血管生成明显减少[8]。因此,他们认为,视网膜新生血管的形成需要NF-κB的激活,而吡咯烷二硫代氨基酸酯可通过抑制NF-κB而抑制新生血管的生成。本实验通过免疫组织化学观察发现,DR组和DR+罗格列酮组大鼠视网膜NF-κB p65蛋白的表达明显高于正常对照组(均为P<0.01),且随病程延长表达进一步增多。说明NF-κB参与了DR的病程进展。
PPAR-γ是配体激活的核转录因子,最先被定义为调节脂肪细胞特定基因表达和诱导前脂肪细胞分化的转录因子。目前,对于PPAR-γ激动剂作用的研究主要集中在其对眼部新生血管形成的影响。Murata等[9]通过PPAR-γ激动剂对虹膜新生血管影响的研究发现,PPAR-γ激动剂能有效抑制虹膜新生血管的形成,并有可能成为治疗与虹膜新生血管形成有关的并发症的有效药物。他们还应用PPAR-γ激动剂罗格列酮和曲格列酮干预培养基中的视网膜内皮细胞,发现它们可以通过抑制血管内皮生长因子信号肽的反应从而抑制视网膜内皮细胞的迁移、增殖和管腔形成[10]。另外有研究表明,PPAR-γ激动剂同时还具有抑制炎症反应的作用。Muranaka等[11]研究表明,糖尿病 PPAR-γ+/-的杂合子大鼠视网膜白细胞阻滞和渗漏明显高于糖尿病野生型大鼠,罗格列酮可以显著抑制实验性糖尿病大鼠视网膜白细胞阻滞和渗漏。为了进一步探讨PPAR-γ激动剂在抗炎方面的作用,本实验应用PPAR-γ激动剂罗格列酮对DR大鼠进行干预发现,在应用罗格列酮治疗后,DR+罗格列酮组给药后4周大鼠视网膜NF-κB p65的表达较 DR组降低不明显(P>0.05),而DR+罗格列酮组给药后8周和12周大鼠视网膜上NF-κB p65的表达较DR组明显降低,差异均有显著统计学意义(P<0.01)。说明随着给药时间的延长,罗格列酮能够抑制糖尿病大鼠视网膜上NF-κB的表达。
综上所述,NF-κB与DR病程的发生发展关系密切。而外源性PPAR-γ激动剂罗格列酮可以通过抑制NF-κB的表达发挥对视网膜的保护作用。因此,有望成为DR新的治疗靶点。
1 Kern TS.Contributions of inflammatory processes to the development of the early stages of diabetic retinopathy[J].Exp Diabetes Res,2007,2007:95103.
2 Keshamouni VG,Arenberg DA,Reddy RC,Newstead MJ,Anthwal S,Standiford TJ.PPAR-gamma activation inhibits angiogenesis by blocking ELR+CXC chemokine production in non-small cell lung cancer[J].Neoplasia,2005,7(3):294-301.
3 Fenner MH,Elstner E.Peroxisome proliferator-activated receptor-gamma ligands for the treatment of breast cancer[J].Expert Opin Investig Drugs,2005,14(6):557-568.
4 吕红彬,袁援生,李 燕,李 俊.大鼠青光眼模型视网膜神经节细胞中热休克蛋白27表达的研究[J].中华眼科杂志,2005,41(6):533-539.
5 Adamis AP.Is diabetic retinopathy an inflammatory disease[J]?Br J Ophthalmol,2002,86(4):363-365.
6 Chen S,Khan ZA,Cukiernik M,Chakrabarti S.Differential activation of NF-kappa B and AP-1 in increased fibronectin synthesis in target organs of diabetic complications[J].Am J Physiol Endocrinol Metab,2003,284(6):E1089-E1097.
7 Yoshida A,Yoshida S,Hata Y,Khalil AK,Ishibashi T,Inomata H.The role of NF-kappa B in retinal neovascularization in the rat.Possible involvement of cytokine-induced neutrophil chemoattractant(CINC),a member of the interleukin-8 family[J].J Histochem Cytochem,1998,46(4):429-436.
8 Yoshida A,Yoshida S,Ishibashi T,Kuwano M,Inomata H.Suppression of retinal neovascularization by the NF-kappa B inhibitor pyrrolidine dithiocarbamate in mice[J].Invest Ophthalmol Vis Sci,1999,40(7):1624-1629.
9 Murata T,He S,Hangai M,Ishibashi T,Xi XP,Kim S,et al.Peroxisome proliferator-activated receptor-gamma ligands inhibit choroidal neovascularization[J].Invest Ophthalmol Vis Sci,2000,41(8):2309-2317.
10 Murata T,Hata Y,Ishibashi T,Kim S,Hsueh WA,Law RE,et al.Response of experimental retinal neovascularization to thiazolidinediones[J].Arch Ophthalmol,2001,119(5):709-717.
11 Muranaka K,Yanagi Y,Tamaki Y,Usui T,Kubota N,Iriyama A,et al.Effects of peroxisome proliferator-activated receptor gamma and its ligand on blood-retinal barrier in a streptozotocin-induced diabeticmodel[J].Invest Ophthalmol Vis Sci,2006,47(10):4547-4552.

