PSTI1可提高大肠杆菌应答胁迫能力
刘士德,陈汗英,张建华,田生礼,李水明,李慧丽,李明华,邢 苗
深圳大学生命科学学院,深圳市微生物基因工程重点实验室,深圳 518060
PSTI1可提高大肠杆菌应答胁迫能力
刘士德,陈汗英,张建华,田生礼,李水明,李慧丽,李明华,邢 苗
深圳大学生命科学学院,深圳市微生物基因工程重点实验室,深圳 518060
指出含典型34肽重复序列结构域 (tetratricopeptide repeat,TPR)的胁迫诱导蛋白 (stress-inducible protein-1,STI1)是真核生物特有的一类与胁迫应答有关的分子伴侣蛋白.作者从多头绒泡菌分离出一个STI1类似蛋白cDNA,因其编码蛋白含有两个非典型的TPR结构域,命名为PSTI1.为了解PSTI1对原核生物胁迫应答功能的影响,观察表达PSTI1的大肠杆菌(Escherichia coli,E.coli)与原菌株的增殖差异,发现PSTI1表达菌耐受盐、渗透压、重金属离子、氧化、缺氧和酸碱变化胁迫的能力均增强,但对高温敏感.PSTI1保守结构域TPR1能提高E.coli耐受渗透压胁迫的能力,但TPR2会使E.coli对盐和渗透压胁迫敏感,说明TPR1和TPR2在PSTI1调控胁迫应答中可能扮演不同角色.通过pull-down和质谱分析技术检测了与PSTI1作用的E.coli蛋白,发现PSTI1能与E.coli的HtpG(Hsp90)、La蛋白酶和过氧化氢酶HpII等作用,说明PSTI1具有原核生物非典型TPR结构域蛋白的类似功能,是类似STI1的胁迫应答蛋白.
微生物细胞生物学;多头绒泡菌;STI1类似蛋白;cDNA文库;大肠杆菌;胁迫应答;真菌;基因工程;基因编码
真核生物普遍存在的胁迫诱导蛋白 (stress-inducible protein-1,STI1)是一类进化保守的、调节细胞胁迫应答的分子伴侣蛋白.STI1家族成员的共同特征是都含有2个以上的34肽重复序列结构域(tetratricopeptide repeat domian,TPR),TPR由3个含有螺旋-转角-螺旋二级结构、序列长度为34氨基酸 (amino acid,aa)的重复序列构成[1].细胞在应答热胁迫时,STI1通过TPR结构与热休克蛋白 (heat shock protein,Hsp)Hsp70和Hsp90作用[2],调节Hsp70和Hsp90的构像及其三磷酸腺苷酶 (adenosine triphosphatase,ATPase) 活 性[3-5],指导Hsp70和Hsp90与其配体蛋白作用[4-7],参与Hsp90 对配体蛋白生物活性的调节[4,6-7].此外,STI1还通过Hsp复合体调节蛋白折叠和变性蛋白的重折叠[3,8-9],调节细胞的胁迫应答,影响细胞的生长、分化和繁殖[2,6-7,10].Hernández 等[11]分析了多种细菌编码蛋白发现,原核生物存在含非典型TPR结构域的TPR-DP(TPR followed by asparatate-proline dipeptide repeats domain)结构蛋白,但尚未发现含有典型TPR结构域的STI1蛋白.
多头绒泡菌(Physarum polycephalum)是一种介于原核和真核生物之间的过渡态真核生物,具有最基本的胁迫应答机能.当环境不利时,多头绒泡菌以孢子形式生存;当环境条件适宜时,则以原质团形式繁殖.多头绒泡菌蛋白质大多只具备真核生物蛋白质最基本的结构和功能,研究多头绒泡菌STI1蛋白的功能有助于了解生物最基本的胁迫应答机制.本课题组在前期研究中,以多头绒泡菌14-3-3蛋白 (P14-3-3)为饵蛋白[12],通过酵母双杂交,从多头绒泡菌cDNA文库[13]中分离出一个由696碱基对 (base pair,bp)组成的STI1类似蛋白cDNA片段.本研究通过5'-端cDNA快速扩增技术(rapid amplification of cDNA ends,RACE)获得了该基因的完整cDNA,并检测了表达该蛋白的大肠杆菌(Escherichia coli,E.coli)对不同胁迫作用的应答反应;通过pull-down和质谱分析技术,检测了E.coli内与PSTI1作用的部分蛋白;初步探索了该蛋白提高原核生物耐受胁迫的能力,确定了该蛋白与胁迫应答的关系.
1 材料与方法
1.1 多头绒泡菌的培养
参照Daniel等[14]的方法悬浮培养多头绒泡菌(p.polycephalumPpII(-)strain, ATCC 编 号24467,德国雷根斯堡大学生物物理所 Eggehard Holler教授惠赠)微原质团.
1.2 PSTI1完整cDNA的分离
取100 mg多头绒泡菌微原质团 (湿重),用RNeasy Plant试剂盒 (Qiagen,德国)提取总RNA.用GeneRacerTM试剂盒 (Invitrogen,美国)将含5'-帽子结构的mRNA制备成完整cDNA.根据PSTI1 3'-cDNA序列设计两条符合GeneRacerTM试剂盒要求的PCR下游引物R1(5'-TATGCGGTGCAGGGCTTG GGACGCTGTT-3')和R2(5'-GGGGTTCCTGG CTCT AATTCCGTCACTT-3').分别组成引物对①GeneRacerTM5'-引物(5'-CGACTGGAGCACGAGGACACTGA-3')和R1,引物对②GeneRacerTM5'-套式引物 (5'-G GACACTGACATGGACTGAAGGAGTAGAA-3')和 R2.利用两组引物从完整cDNA中克隆PSTI1的5'-cDNA,然后用PCR Cleave试剂盒 (Axygen,美国)纯化PCR产物,并将PCR获得片段连接到pMD18-T载体(Takara),在E.coliTop10(Novagen,美国)中克隆重组质粒.通过Mini-Preps试剂盒 (Takara)提取重组质粒,利用引物对②进行PCR鉴定,并测定插入片段的基因序列.拼接PSTI1的5'-cDNA和3'-cDNA序列获得PSTI1的完整cDNA序列.
1.3 PSTI1及其功能结构域TPR1和TPR2的重组表达
以PSTI1完整cDNA为模板,用引物5'-CGG GATCCATGTCAAAAGCAAAACAACAAGCAC-3'(下划线表示酶切位点BamH I)和5'-ACGCGTCGAC TTACTTTCCAGCGCGTTC-3'(SalI)克隆PSTI1编码基因.将PCR产物插入载体pET-32a(+)(Novagen,美国),在E.coliTop10中克隆质粒pET-psti1.提取质粒 pET-psti1后,转化E.coliOrigamiTM(DE3),在含50 μg/mL氨苄青霉素和30 μg/mL卡那霉素的LB培养基 (lysogeny broth medium)平板上筛选阳性转化子PSTI1(+).
以pET-psti1为模版,用引物对③(5'-CGGGATC CGGCAACAAATCTTTCGCTG-3'(BamHI)与5'-AC GCGTCGACAGGATCAATTTTAAGGCCA-3'(SalI))和引物对④ (5'-CGGGATCCAAAAAGGAGGGAAA CGAA-3'(BamH I)与5'-ACGCGTCGACAGGATCA ATTTTAAGGCCA-3'(SalI))分别克隆PSTI1保守肽段TPR1(15~107 aa)和TPR2(135~233 aa)的基因片段tpr1和tpr2,然后重组到载体pET-32a(+)上,制备质粒pET-tpr1和 pET-tpr2,并分别转化E.coliOrigamiTM(DE3),制备转化子TPR1(+)和TPR2(+).通过Western blot检测与硫氧还蛋白 (Thioredoxin,Trx,标签蛋白)融合表达的Trx-PSTI1、Trx-TPR1和 Trx-TPR2.以含 pET-32a(+)质粒、表达 Trx的E.coliOrigamiTM(DE3)转化子PSTI1(-)为对照.
1.4 免疫印迹
用 LB培养基将 Trx、Trx-PSTI1、Trx-TPR1、Trx-TPR2表达菌 PSTI1(-)、PSTI1(+)、TPR1(+)和 TPR2(+)培养至光密度值 OD600为0.5~0.6,之后加入终浓度为1 mmol/L的异丙基-β-D-硫代吡喃半乳糖苷 (isopropyl β-D-1-thiogalactopyranoside,IPTG)于30℃继续培养4 h,以诱导Trx及与Trx融合的PSTI1、TPR1和TPR2表达.取1 mL菌液的菌体进行十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecylsulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析,聚丙烯凝胶体积分数为12%.将聚丙烯凝胶中的蛋白转移到硝酸纤维膜后,用脱脂奶粉封闭过夜,用鼠抗Trx标签多抗(Abgent,美国)和碱性磷酸酶标记的羊抗鼠IgG(Proteintech,美国)检测 Trx、Trx-PSTI1、Trx-TPR1和Trx-TPR2.显色底物使用5-溴-4-氯-3-吲哚磷酸盐/氯化硝基四氮唑蓝 (bromo-chloro-indolyl phosphate/nitro blue tetrazolium,BCIP/NBT).
1.5 质谱检测PSTI1 pull-down的大肠杆菌蛋白
取湿重1 g的PSTI1(+)和PSTI1(-)菌体分别与30 mL Tris-HCl缓冲液 (pH=8.0,500 mmol/L NaCl,50 mmol/L Tris-HCl)混合、破碎、取上清,加甘油至终浓度为2.5%(体积分数),加60 μL Ni2+鳌合琼脂糖凝胶 (Pharmacia公司,美国),2 h后用Tris-HCl缓冲液洗涤3次,收集凝胶进行SDSPAGE分析.
考马斯亮蓝染色后,切取胶片上存在Trx-PSTI1 pull-down蛋白而不存在Trx pull-down蛋白的蛋白带;用纯水洗胶粒 3次;加 100 μL浓度为 25 mmol/L的NH4HCO3平衡20 min;去液体,加100 μL体积分数为50%乙腈 (acetonitrile,ACN)溶液(溶于25 mmol NH4HCO3),脱色2次,30 min/次,至胶粒透明;去液体,加100 μL浓度为25 mmol/L的NH4HCO3平衡20 min;去液体,加100 μL二硫基苏糖醇 (DL-Dithiothreitol,DTT)溶液 (100 mmol/L DTT、25 mmol/L NH4HCO3),56℃反应60 min;去液体,加100 μL碘乙酞胺 (iodoacetamide,IAA)溶液(55 mmol/L IAA、25 mmol/L NH4HCO3),暗处反应30 min;去液体,加100 μL浓度为25 mmol/L的NH4HCO3溶液平衡20 min;去液体,用乙腈浸泡胶粒2次,40 min/次,去乙腈,干燥10 min;加5 μL质量浓度为20 g/mL的质谱分析用胰酶 (Trypsin),4℃酶解30 min;去酶液,加5 μL体积分数为10% 的CAN溶液 (溶于40 mmol/L NH4HCO3)洗胶粒;去液体,再加入5 μL体积分数为10%CAN溶液,37℃水浴10 h.取1 μL多肽提取液与等体积饱和α-氰基-4-羟基肉桂酸 (α-Cyano-4-hydroxycinnamic acid,α-CHCA)溶液混匀;取1 μL样品点在不锈钢基质辅助激光解吸附电离(matrix-assisted laser desorption ionization,MALDI)靶面上,室温下干燥;用基质辅助激光解吸附电离飞行时间质谱仪 (matrix-assisted laser desorption ionization time of flight mass spectrometry,MALDI-TOF/TOF)4800(ABI,美国)检测水解肽段,用Mascot搜索引擎的MS/MS Ions模式在NCBInr蛋白质数据库检索质谱结果.
1.6 表达菌的胁迫培养
从6方面观察胁迫培养对 PSTI1、TPR1和TPR2表达菌PSTI1(+)、TPR1(+)、TPR2(+)生长的影响,以Trx表达菌PSTI1(-)为对照.
盐和渗透压胁迫 用LB培养基将PSTI1(+)、TPR1(+)、TPR2(+)和PSTI1(-)培养至OD600为0.5~0.6,加入终浓度为 1 mmol/L的 IPTG诱导PSTI1、TPR1、TPR2和Trx的表达,30℃培养4 h后,取菌液3 μL进行倍比稀释,将不同浓度的菌液分别滴加到含不同浓度NaCl和山梨醇的培养平板上,37℃培养3 d,观察菌落生长差异.
重金属胁迫 观察PSTI1(+)和PSTI1(-)菌落在含有不同浓度CuSO4的LB培养平板上的生长差异.
氧化胁迫 将不同浓度的H2O2涂布在LB培养板上,20 min后,吸去多余H2O2液,观察PSTI1(+)和PSTI1(-)菌落在培养板上的生长差异.
缺氧胁迫 取1 mL OD600为0.6的PSTI1(+)和PSTI1(-)菌液,分别加入到100 mL的LB培养液(含1 mmol IPTG)中,其中一组在100 r/min的摇瓶中培养,另一组在200 r/min的摇瓶中培养.之后定期取样测量PSTI1(+)和PSTI1(-)菌液的OD600值.
酸碱胁迫 用NaOH和HCl调节LB培养基至不同pH值,再观察PSTI1(+)和PSTI1(-)菌落在不同酸碱度LB培养基上的生长差异.
温度胁迫 观察PSTI1(+)和PSTI1(-)菌落在不同温度下的生长差异.
2 结果及分析
2.1 PSTI1基因的克隆和表达
通过5'-RACE技术,从多头绒泡菌完整mRNA中克隆出一段773 bp的cDNA,与PSTI1 3'-cDNA序列拼接,得到一个996 bp编码260个氨基酸的cDNA序列(GenBank编号为HQ993094).序列比对结果如图1,可见,PSTI1与其他物种STI1同源的序列主要集中在两个TPR结构域上,本研究将这两个类似的TPR结构域分别命名为TPR1(15~107 aa,理论相对分子质量10 kDa)和TPR2(135~233 aa,理论相对分子质量11 kDa).比对结果显示,TPR1与TPR2间的连接序列(109~126 aa)比其他物种STI1s对应序列短很多,C-末端序列也比其他STI1s对应序列短,是序列最短的STI1家族成员.

图1 Blast P2.2.22软件分析的PSTI1 TPRs所在位置和关键氨基酸位置Fig.1 A sketchmap of TPR domains,TPR motifs and binding sites of PSTI1 predicted using software Blast P2.2.22
Trx的理论相对分子质量为17 kDa,而Trx-PSTI1、Trx-TPR1和Trx-TPR2的理论相对分子质量分别为46、27和28 kDa.通过 Western blot检测发现,PSTI1(+)、TPR1(+)、TPR2(+)和 PSTI1(-)表达产物中与抗Trx抗体结合的蛋白的相对分子质量分别为46、27、28和17 kDa(图2的2~5泳道),与预测结果一致,说明PSTI1、TPR1和TPR2能在E.coliOrigamiTM(DE3)中与Trx融合表达.
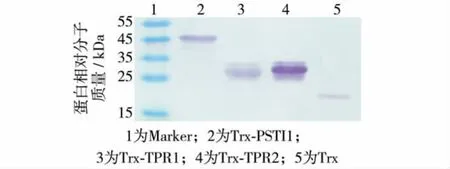
图2 Western blot检测E.coli OrigamiTM(DE3)表达的Trx-PSTI1、Trx-TPR1和Trx-TPR2Fig.2 Western blot analysis of Trx fusion PSTI1,TPR1 and TPR2 expressed in E.coli OrigamiTM(DE3)
2.2 PSTI1 pull-down的部分大肠杆菌蛋白

图3 Trx-PSTI1和Trx pull-down蛋白SDS-PAGE检测结果Fig.3 Coomassie blue stained SDS-PAGE pattern of Trx-PSTI1 and Trx pull-down proteins
Trx-PSTI1和Trx pull-down的大肠杆菌蛋白的SDS-PAGE检测结果如图3.可见,Trx-PSTI1 pulldown的蛋白带 (泳道2)明显多于Trx pull-down的蛋白带 (泳道3),说明大肠杆菌存在与PSTI1作用的蛋白.从泳道2取5条在泳道3未出现的蛋白带(图中箭头所指位置)进行质谱分析,在带a(约100 kDa)检测到丙酮酸脱氢酶(pyruvate dehydrogenase)和二氧酸脱氢酶(2-oxo-acid dehydrogenase);在带 b(84~89 kDa)检测到过氧化氢酶 Hpii(Catalase Hpii)、由lon基因表达的La蛋白酶 (lon protease La)、依赖ATP的蛋白酶 (ATP-dependent proteinase)以及依赖ATP结合DNA的La蛋白酶(DNA-binding ATP-dependent protease La);在带c(64~71 kDa)检测到HtpG(Hsp90类似蛋白)、D-果糖-6-磷酸酰胺转移酶 (D-fructose-6-phosphate amidotransferase)和谷氨酸-果糖-6-磷酸转氨酶(glutamine-fructose-6-phosphate transaminase);在带d(约57 kDa)检测到alkyl-hydro-peroxide reductase(烷甲基还原酶);在蛋白带e(约23 kDa)检测到30S核糖体蛋白 (30S ribosomal protein)亚基S3和S4.
2.3 胁迫作用对PSTI1表达菌生长的影响
将对数生长期的Trx-PSTI1表达菌PSTI1(+)和Trx表达菌PSTI1(-)倍比稀释,分别滴加到含0.5、0.8、1.0 和1.2 mol/L NaCl的 LB 培养板上培养 (图4),发现PSTI1(+)比PSTI1(-)生长效果好,即使在1.2 mol/L NaCl的LB培养板上 PSTI1(+)仍然能够长出菌落,说明PSTI1能提高E.coli抗盐胁迫的能力.采用同样方法检测Trx-TPR1表达菌TPR1(+)和Trx-TPR2表达菌TPR2(+)耐盐胁迫的能力 (图5),发现在不同浓度NaCl下生长的TPR1(+)与 PSTI1(-)没有显著差异;TPR2(+)的生长能力甚至比PSTI1(-)还差,而PSTI1(+)的生长能力普遍优于TPR1(+)、TPR2(+)和PSTI1(-),说明完整的PSTI1能提高E.coli抗盐胁迫的能力,但PSTI1的保守肽段TPR1和TPR2则不能提高E.coli抗盐胁迫的能力.

图4 PSTI1对E.coli耐盐胁迫的影响Fig.4 E.coli expressing Trx fusion PSTI1 are resistance to salt

图5 PSTI1、TPR1和TPR2对E.coli耐盐胁迫的影响Fig.5 E.coli expressing PSTI1,TPR1 and TPR2 are resistant to salt
采用同样方法,观察了PSTI1(+)、TPR1(+)和TPR2(+)在不同浓度山梨醇培养板上的生长差异 (图6),发现PSTI1(+)均比PSTI1(-)生长旺盛,说明过表达PSTI1能提高E.coli耐渗透压胁迫的能力.与 PSTI1(+)相比,TPR1(+)和 TPR2(+)在山梨醇胁迫下的生长情况显然不如PSTI1(+)好,但TPR1(+)比PSTI1(-)生长旺盛,而TPR2(+)与PSTI1(-)相比差异不显著 (图7中1.4 mol/L山梨醇胁迫下的菌落),说明过表达TPR1也能提高E.coli耐渗透压胁迫的能力,但不如完整的PSTI1效果好,而过表达TPR2对E.coli耐渗透压胁迫的能力没有显著的影响.

图6 PSTI1对E.coli耐渗透压胁迫的影响Fig.6 E.coli expressing Trx-PSTI1 are resistant to osmosis
为确定PSTI1对E.coli耐重金属胁迫的影响,观察PSTI1(+)和PSTI1(-)在不同浓度CuSO4培养板上的生长差异 (图8),发现PSTI1(+)均比PSTI1(-)生长旺盛,说明过表达 PSTI1能提高E.coli耐Cu2+胁迫的能力.同样,为确定PSTI1对E.coli耐氧化胁迫的影响,我们观察了PSTI1(+)在不同浓度H2O2培养板上的生长差异 (图9),发现PSTI1(+)均比PSTI1(-)生长旺盛,说明过表达PSTI1能提高E.coli耐氧化胁迫的能力.

图7 PSTI1、TPR1和TPR2对E.colii耐渗透压胁迫的影响Fig.7 E.coli expressing PSTI1,TPR1 and TPR2 are resistant to osmosis

图8 PSTI1对E.coli耐Cu2+胁迫的影响Fig.8 E.coli expressing PSTI1 are resistant to Cu2+

图9 PSTI1对E.coli耐氧化作用胁迫的影响Fig.9 E.coli expressing PSTI1 are resistant to oxidation
为确定PSTI1对E.coli耐缺氧胁迫的影响,我们测定了PSTI1(+)和PSTI1(-)在不同摇速下的增殖曲线 (图10).当摇速为200 r/min时,PSTI1(+)与PSTI1(-)的生长曲线没有显著差异;当摇速为100 r/min时,PSTI1(+)和PSTI1(-)的增殖速率呈明显下降,PSTI1(-)增殖速率下降的幅度比PSTI1(+)的增殖速率下降的幅度大,说明PSTI1过表达能提高E.coli耐缺氧胁迫的能力.
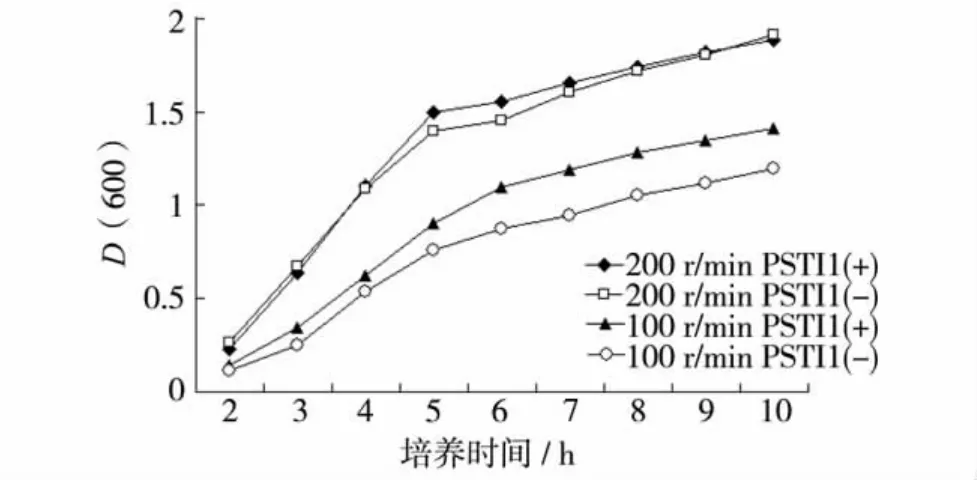
图10 PSTI1对E.coli耐缺氧胁迫的影响Fig.10 E.coli expressing PSTI1 are resistant to hypoxia
为确定PSTI1对E.coli耐受酸碱胁迫的影响,我们观察了PSTI1(+)和PSTI1(-)在不同pH培养板上的生长差异 (图11),发现pH=5.0和pH=10胁迫条件下PSTI1(+)均比PSTI1(-)生长旺盛,说明过表达PSTI1能在一定程度上提高E.coli耐酸碱胁迫的能力.
为确定PSTI1对E.coli受温度胁迫的影响,我们观察了PSTI1(+)和PSTI1(-)在不同温度下的生长差异 (图12),发现PSTI1(+)在各种温度下的生长均不如 PSTI1(-)好,PSTI1(+)和PSTI1(-)菌株在低于28℃下的生长差异没有在高温下生长差异的显著,说明PSTI1过表达会导致E.coli对高温更敏感.
上述检测结果说明,过表达PSTI1可以提高大肠杆菌耐受盐、渗透压、重金属离子、氧化作用、缺氧和酸碱变化胁迫的能力,但也会引起E.coli对高温敏感,说明PSTI1调节E.coli应答热胁迫的机制与调节E.coli应答盐、渗透压、重金属离子、氧化作用、缺氧和酸碱变化胁迫的的机制不同.

图11 PSTI1对E.coli耐酸碱变化的影响Fig.11 E.coli expressing PSTI1 are resistant to pH change

图12 PSTI1表达引起E.coli对温度敏感的变化Fig.12 E.coli expressing PSTI1 are sensitive to temperature
3 讨论
人、利什曼原虫、大豆和酵母的STI1分别由543、546、569和589个氨基酸组成,而PSTI1只有260个氨基酸,是STI1家族最小的成员.哺乳动物STI1含有3个TPR结构域 (TPR1、TPR2A和TPR2B)和2个 DP结构域 (DP1和 DP2)[1],但PSTI1没有DP结构域,与其他STI1同源的序列主要集中在两个非典型的TPR结构域上,TPR结构域间的连接序列 (18个氨基酸,酵母STI1的对应序列为250个氨基酸)和C-末端非TPR序列 (2个氨基酸,酵母STI1的对应序列为68个氨基酸)比其他STI1对应序列都短,说明PSTI1是结构最简单的STI1类似蛋白,可能具备STI1蛋白最基本的功能.
现有报道显示,STI1蛋白主要通过其TPR结构域与热休克蛋白作用[1],并调节热休克蛋白与其配体蛋白作用[4-7],以及通过热休克蛋白调节配体蛋白生物活性[4,6-7].除 STI1家族成员外,含有典型和非典型TPR结构域的蛋白也具有STI1蛋白类似的功能.Brychzy等[15]发现,含有2个TPR结构域和1个DnaJ(E.coli的Hsp40)类似结构域的共伴侣蛋白Tpr2不仅通过TPR结构域识别Hsp70和Hsp90,还能通过Hsp70和Hsp90调节体内的肾上腺皮质激素受体 (glucocorticoid receptor,GR)活性.Hernández[11]发现,原核细胞存在非典型的TPR结构蛋白,YbbN是在E.coli发现的与热胁迫应答和DNA合成有关的共分子伴侣蛋白,其N端存在1个Trx结构域,C-端存在1个由4个非典型TPR序列构成的TPR类似结构域.Lin等[16]发现,YbbN能够温和地抑制GroESL(GroEL(Hsp60)/GroES(Hsp10))的功能和ATP酶活性,也能显著提高DnaK(Hsp70)/DnaJ/GrpE(Hsp20)分子伴侣系统的功能,说明真核和原核细胞表达的典型和非典型TPR结构域蛋白可能都具有STI1蛋白的类似功能.
为了解PSTI1及其保守结构域TPR1和TPR2的功能以及对E.coli胁迫应答功能的影响,我们观察了表达PSTI1、TPR1和TPR2的E.coli在胁迫条件下的生长变化,发现过表达PSTI1可以提高大肠杆菌耐受盐、渗透压、重金属离子、氧化作用、缺氧和酸碱变化胁迫的能力,但会导致大肠杆菌对高温敏感,说明含有非典型TPR结构域的PSTI1可以广泛影响大肠杆菌的胁迫应答功能.本文还发现,PSTI1保守肽段TPR1的表达菌耐受山梨醇胁迫的能力虽然没有PSTI1表达菌强,但比阴性对照菌强,说明TPR1在PSTI1应答渗透压胁迫时扮演着正调控的角色.与TPR1表达菌的耐胁迫作用相反,PSTI1保守肽段TPR2表达菌在盐和山梨醇胁迫下的增殖能力显著低于阴性对照菌,说明TPR2可导致大肠杆菌对盐和渗透压胁迫敏感,TPR2可能在PSTI1应答胁迫作用时扮演负调控的角色.
LIN等[16]通过 pull-down检测发现,除 GroEL外,与YbbN作用的E.coli蛋白还包括多个核糖核蛋白亚基.本研究通过pull-down和质谱技术检测了与PSTI1作用的部分E.coli蛋白,发现与PSTI1作用的蛋白包括热休克蛋白HtpG(Hsp90的类似蛋白[17]),胁迫应答蛋白 protease La[18],具有抗变性、抗氧化功能的catalase Hpii[19-20]等,说明PSTI1不仅通过HtpG等热休克蛋白参与了E.coli的胁迫应答,还可能在调节E.coliprotease La和 catalase Hpii的胁迫应答功能上扮演着重要角色.此外,PSTI1作用的E.coli蛋白还包括丙酮酸脱氢酶、D-果糖-6-磷酸酰胺转移酶、氨基葡萄糖,果糖-6-磷酸转移酶等代谢酶以及30S核糖核蛋白S3和S4,说明PSTI1具有E.coli非典型TPR结构蛋白类似的功能,是一个与胁迫应答相关的STPI1类似蛋白.
[1]Flom G,Behal R H,Rosen L,等.Sti1二聚体形成序列以及与Hsp70和Hsp90作用的序列 [J].生物化学杂志,2007,404(1):159-167.(英文版)
[2]Gaiser A M,Brandt F,Richter K.从线虫分离的非典型Hop蛋白具有与Hsc70或Hsp90形成复合体的作用[J].分子生物学杂志,2009,391(3):621-634.(英文版)
[3]Prodromou C,Siligardi G,O'Brien R,等.含有TPR结构域的共分子伴侣蛋白具有调节Hsp90 ATPase活性的功能[J].欧洲分子生物学协会杂志,1999,18(3):754-762.(英文版)
[4]Richter K,Muschler P,Hainzl O,等.Sti1是 Hsp90 ATPase功能的非竞争性抑制剂,在ATP酶循环中二者结合可阻止Hsp90的N-端的二聚体化 [J].生物化学杂志,2003,278(12):10328-10333.(英文版)
[5]Hessling M,Richter K,Buchner J.ATP诱导分子伴侣蛋白Hsp90结构循环变化的剖析 [J].天然结构与分子生物学,2009,16(3):287-293.(英文版)
[6]Chang H C,Nathan D F,Lindquist S.Hsp90共伴侣蛋白Sti1(p60)在体内的作用 [J].分子和细胞生物学,1997,17(1):318-325.(英文版).
[7]Ran F,Bali M,Michels C A.通过非诱导的组成型等位基因突变确定Hsp90/Hsp70分子伴侣机器调节酵母MAL基因激活因子 [J].遗传学,2008,179(1):331-343.(英文版)
[8]Johnson B D,Schumacher R J,Ross E D,等.Hop在蛋白折叠时调节Hsp70与Hsp90的作用 [J].生物化学杂志,1998,273(6):3679-3686.(英文版)
[9]Wegele H,Wandinger S K,Schmid A B,等.受调节蛋白从分子伴侣Hsp70转移到Hsp90[J].分子生物学杂志,2006,356(3):802-811.(英文版)
[10]Mir S S,Fiedler D,Cashikar A G.Ssd1是酵母耐热蛋白Hsp104是酵母蛋白降解过程中的调节蛋白 [J].分子和细胞生物学,2009,29(1):187-200.(英文版)
[11]Hernández T J,Papandreou N,Chomilier J.序列分析显示两端带内含子的TPR-DP单元可能源于真核蛋白Hop和 Hip的 TPR-DP结构域以及原核蛋白 GerD[J].细胞胁迫和分子伴侣,2009,14(3):281-289.(英文版).
[12]刘士德,李明华,张建华,等.多头绒泡菌14-3-3蛋白激活酵母Gal4蛋白调节的基因与其二聚体结合结构域及磷酸化位点有关 [J].微生物学文献集,2009,192(1):33-40.(英文版)
[13]欧阳秋玲,刘士德,张建华,等.采用酵母双杂交法筛选PSRPK相关蛋白基因 [J].深圳大学学报理工版,2006,23(3):222-229.
[14]Shai Shaham.细胞生物学方法 [M].纽约:学术出版社,2005:9-41.(英文版)
[15]Brychzy A,Rein T,Winklhofer K F,等.连接 2个TPR和1个J结构域的共伴侣因子Tpr2调节Hsp70/Hsp90分子伴侣系统 [J].欧洲分子生物学协会杂志,2003,22(14):3613-3623.(英文版)
[16]LIN Jiu-sheng,Wilson M A.含有一个非典型34肽重复序列的大肠杆菌硫氧还蛋白类似蛋白YbbN是Groel负调控因子.生物化学杂志,2011,286(22):19459-19469.(英文版)
[17]Krukenberg K A,Förster F,Rice L M,等.大肠杆菌Hsp90在溶液中展现多种构像:透视Hsp90的构像动力学 [J].结构,2008,16(5):755-765.(英文版)
[18]Ingmer H,Brøndsted L.蛋白酶在细菌病理中的作用[J].微生物学研究,2009,160(9):704-710.(英文版)
[19]Switala J,O'Neil J O,Loewen P C.大肠杆菌过氧化氢酶HPII具有提高抗变性的功能 [J].生物化学,1999,38(13):3895-3901.(英文版)
[20]Anand A,Duk B T,Singh S,等.氧化还原反应调节VHb(透明颤菌血红蛋白)与抗氧化蛋白的作用:氧胁迫下VHb生物合成调节的新发现 [J].生物化学杂志,2010,426(3):271-280.(英文版)
[1]Flom G,Behal R H,Rosen L,et al.Definition of the minimal fragments of Sti1 required for dimerization,interaction with Hsp70 and Hsp90 and in vivo functions[J].The Biochemical Journal,2007,404(1):159-167.
[2]Gaiser A M,Brandt F,Richter K.The non-canonical Hop protein fromCaenorhabditis elegansexerts essential functions and forms binary complexes with either Hsc70 or Hsp90 [J].Journal of Molecular Biology,2009,391(3):621-634.
[3]Prodromou C,Siligardi G,O'Brien R,et al.Regulation of Hsp90 ATPase activity by tetratricopeptide repeat(TPR)-domain co-chaperones[J].European Molecular Biology Organization Journal,1999,18(3):754-762.
[4]Richter K,Muschler P,Hainzl O,et al.Sti1 is a noncompetitive inhibitor of the Hsp90 ATPase.Binding prevents the N-terminal dimerization reaction during the atpase cycle [J].The Journal of Biological Chemistry,2003,278(12):10328-10333.
[5] Hessling M,Richter K,Buchner J.Dissection of the ATP-induced conformational cycle of the molecular chaperone Hsp90 [J].Nature Structural and Molecular Biology,2009,16(3):287-293.
[6]Chang H C,Nathan D F,Lindquist S.In vivo analysis of the Hsp90 cochaperone Sti1(p60) [J].Molecular and Cellular Biology,1997,17(1):318-325.
[7]Ran F,Bali M,Michels C A.Hsp90/Hsp70 chaperone machine regulation of theSaccharomycesMAL-activator as determined in vivo using noninducible and constitutive mutant alleles [J].Genetics,2008,179(1):331-343.
[8]Johnson B D,Schumacher R J,Ross E D,et al.Hop modulates Hsp70/Hsp90 interactions in protein folding[J].The Journal of Biological Chemistry,1998,273(6):3679-3686.
[9]Wegele H,Wandinger S K,Schmid A B,et al.Substrate transfer from the chaperone Hsp70 to Hsp90 [J].Journal of Molecular Biology,2006,356(3):802-811.
[10]Mir S S,Fiedler D,Cashikar A G.Ssd1 is required for thermotolerance and Hsp104-mediated protein disaggregation inSaccharomyces cerevisiae[J].Molecular and Cellular Biology,2009,29(1):187-200.
[11]Hernández T J,Papandreou N,Chomilier J.Sequence analyses reveal that a TPR-DP module,surrounded by recombinable flanking introns,could be at the origin of eukaryotic Hop and Hip TPR-DP domains and prokaryotic GerD proteins[J].Cell Stress and Chaperones,2009,14(3):281-289.
[12]LIU Shi-de,LI Ming-hua,ZHANG Jian-hua,et al.Activation of the transcription of Gal4-regulated genes byPhysarum14-3-3 in yeast is related to dimer-binding motif-2 and three phosphorylation sites[J].Archives of Microbiology,2009,192(1):33-40
[13] OUYANG Qiu-ling,LIU Shi-de,ZHANG Jian-hua,et al.Screening of the PSRPK-related protein genes with yeast two-hybrid method [J].Journal of Shenzhen University Science and Engineering,2006,23(3):222-229.(in Chinese)
[14]Shai Shaham.Methods in Cell Biology[M].New York:Academic Press,2005:9-41.
[15]Brychzy A,Rein T,Winklhofer K F,et al.Cofactor Tpr2 combines two TPR domains and a J domain to regulate the Hsp70/Hsp90 chaperone system [J].European Molecular Biology Organization Journal,2003,22(14):3613-3623.
[16]LIN Jiu-sheng,Wilson M A.Escherichia colithioredoxinlike protein YbbN contain an atypical tetratricopeptide repeat motif and is a negative regulator of Groel[J].The Journal of Biological Chemistry,2011,286(22):19459-19469.
[17]Krukenberg K A,Förster F,Rice L M,et al.Multiple conformations ofE.coliHsp90 in solution:insights into the conformational dynamics of Hsp90 [J].Structure,2008,16(5):755-765.
[18]Ingmer H,Brøndsted L.Proteases in bacterial pathogenesis[J].Research in Microbiology,2009,160(9):704-710.
[19]Switala J,O'Neil J O,Loewen P C.Catalase HPII fromEscherichia coliexhibits enhanced resistance to denaturation [J].Biochemistry,1999,38(13):3895-3901.
[20]Anand A,Duk B T,Singh S,et al.Redox-mediated interactions of VHb(Vitreoscilla haemoglobin)with OxyR:novel regulation of VHb biosynthesis under oxidative stress[J].The Biochemical Journal,2010,426(3):271-280.
A novel STI1-like protein fromPhysarum
polycephalumcan enhanceE.coliresponse to stress†
LIU Shi-de,CHEN Han-ying,ZHANG Jian-hua,TIAN Sheng-li,LI Shui-Ming,LI Hui-li,LI Ming-hua,and XING Miao
Shenzhen Key Laboratory of Microbial and Gene Engineering College of Life Sciences Shenzhen University Shenzhen 518060 P.R.China
Stress-inducible protein-1(STI1)family members are conserved from human to yeast,functioning as adaptors to help client proteins to transfer from one heat shock protein to another in response to biologic and abiotic stress.A cDNA encoding 260 amino acids PSTI1 with homologue of STI1 was isolated fromPhysarum polycephalum,termed as PSTI1.This protein contains two atypical TPR domains.To determine the PSTI1 functions in protist response to stress,PSTI1 and its conserved peptides,TPR1 and TPR2,were expressed inE.coliOrigamiTM(DE3).The interacted proteins with PSTI1 were detected and analyzed by pull-down and MALDI-TOF/TOF.The results indicate that theE.coliproteins obtained by PSTI1 pull-down include stress response proteins HtpG(a 90-KDa bacteria Heat shock protein),catalase Hpii,protease La and metabolic proteins pyruvate dehydrogenase,etc.The growth of the recombinantE.coliunder NaCl,sorbitol,CuSO4,H2O2,hypoxia,acid,alkali and temperature stress showed that PSTI1 expression could enhanceE.coliresistance to the stress except temperature.TPR1 expression could enhanceE.coliresistance to osmosis stress,while TPR2 expression could induceE.colisensitive to salt and osmosis.The results of TPRI expression suggest that PSTI1 is widely involved in cellular response to diversity of stress.Its conserved domains TPR1 and TPR2 may play different roles on PSTI1 functions.
microbiologyandcellbiology;Physarumpolycephalum;STI1-likeprotein;cDNA library;Escherichia coli(E.coli);stress response;fungi;genetic engineering;gene encoding
Q 932;Q 256
A
1000-2618(2011)04-0347-09
2011-01-25;
2011-04-07
国家自然科学基金资助项目 (30470113)
刘士德 (1962-),男 (汉族),吉林省公主岭市人,深圳大学副教授、博士.E-mail:liusd@szu.edu.cn
邢 苗 (1954-),男 (汉族),深圳大学教授、博士生导师.E-mail:xingmiao@szu.edu.cn
Abstract:1000-2618(2011)04-0354-EA
† This work was supported by National Natural Science Foundation of China(30470113).
book=355,ebook=85
【中文责编:晨 兮;英文责编:艾 琳】
——2017年渗透压相关高考真题赏析

