6周游泳训练对注射D-半乳糖致衰老大鼠学习记忆能力及海马区NGF及其下游信号分子表达的影响
刘涛 白石 胡海涛
1 西安体育学院运动人体科学系(西安 710068) 2 西安交通大学医学院解剖与组织胚胎学系
衰老患者神经细胞凋亡可引起其学习记忆能力严重下降[1,2],因此,减缓或阻止神经元凋亡是治疗老年性疾病如阿尔茨海默氏病(Alzheimer’ s disease,AD)和帕金森氏病(Parkinson’s disease, PD)的重要手段。一些神经营养因子,如神经生长因子(NGF),通过与其相应受体结合能激活细胞存活通路,如磷脂酸肌醇-3激酶(phosphatidylinositol 3-kinase,PI3-K)信号通路,PI3-K通路的下游分子Akt(又称蛋白激酶B)及B细胞淋巴癌/白血病 -2(B-cell lymphomia/leukemia-2,Bcl-2) 是 促细胞存活,阻止细胞凋亡的重要分子[3]。因此,通过促进脑内源性神经生长因子的表达,进而激活细胞存活通路,对受损神经元进行修复是目前治疗老年性疾病的热点研究之一。近年来国内外对长期适宜负荷运动(包括跑台、转笼或游泳运动)对大鼠脑内神经营养因子表达的影响进行了研究,结果表明长期适宜负荷的运动可使大鼠脑内神经生长因子(NGF)、脑源性神经生长因子(BDNF)等表达量显著增加,同时大鼠的空间学习能力也加强[4,5]。但目前针对运动对衰老大鼠神经营养因子的表达及其下游信号通路影响的研究还较少,尤其是运动对衰老大鼠神经生长因子产生的诱导作用及其下游信号分子的影响机制还不明确,而针对中等负荷游泳训练对D-半乳糖诱导的大鼠衰老模型的Akt信号通路上、下游分子影响的研究国内外尚未见报道。所以本研究通过注射D-半乳糖制作大鼠衰老模型,观察6周中等负荷游泳训练后衰老大鼠的行为学特征、海马神经元凋亡情况及脑内NGF及其下游Akt信号分子的表达,探讨运动训练对衰老大鼠脑功能影响的机制,为运动延缓衰老和防治老年性疾病的机制提供实验依据。
1 材料与方法
1.1 实验动物与分组
雄性2月龄SD大鼠30只,体重213±14g,由西安交通大学医学院动物实验中心提供,许可证号SCXK(陕)2007-003。国家标准啮齿类动物饲料喂养,自由饮食饮水。动物饲养环境室温(23±1)℃,湿度45%~75%,自然光照。大鼠游泳池为90 cm×70 cm×60 cm的透明玻璃器皿,水深50 cm,水温(33±1)℃。实验前,随机将大鼠分为正常对照组(normal control group,NC组)、衰老模型对照组(aging control group,AC组)、衰老模型训练组(aging exercise group,AE组)3组,每组10只。
1.2 动物模型的建立
正常对照组(NC组)按常规饲养,自由活动,每日在颈背皮下注射1次生理盐水(125 mg/kg),共6周。衰老模型对照组(AC组)常规喂养,自由活动,每日在颈背皮下注射1次D-半乳糖(125 mg/kg),共6周。衰老模型训练组(AE组)常规喂养,每日在颈背皮下注射D-半乳糖(125 mg/kg),共6周[6],并从第1周开始无负重游泳训练,第1天游泳30 min,以后每天增加10 min,直至90 min后保持不变,每周训练5天,周四、周日休息,共训练6周。每次训练结束后,动物均能自己抖干身上的水,无疲劳症状出现。
1.3 大鼠行为学测试
第7周,采用Morris水迷宫(荷兰NOLDUS公司ETHOVISON轨迹记录分析系统)对3组大鼠进行定位航行和空间探索行为实验,判断其学习记忆和空间记忆的认知能力。①定位航行实验:共5天,将大鼠从标记的4个入水点依次朝向池壁轻轻放入水中,记录大鼠在120s内寻找并爬上平台所用时间,即逃避潜伏期。②空间探索实验:在定位航行实验结束后即第6天进行,撤除平台,将大鼠放入水池,记录大鼠在120s内穿越平台所在区域的次数。行为学测试结束后,AE组有2只死亡,剩8只大鼠。
1.4 海马CA3区TUNEL染色
水迷宫测试全部结束后24 h,各组随机取3只进行TUNEL染色。大鼠经腹腔注射2%戊巴比妥钠(60 mg/kg),经升主动脉灌注肝素化生理盐水150 ml,4%多聚甲醛400 ml灌注。参照大鼠脑立体定位图谱,切取左侧海马置于4%多聚甲醛溶液中后固定24 h,常规石蜡包埋。取石蜡切片冠状面连续切片(厚5 µm),切片放入60℃烤箱烤12 h。切片脱蜡至水,PBS漂洗5 min×2次,2%蛋白酶K 50µl室温孵育30 min,PBS漂洗5 min×2次,3% H2O2室温下封闭 10 min,PBS漂洗 5 min×2次,滤纸吸干;加50 µl TdT反应液37℃避光反应60 min;PBS漂洗5 min×3次,滤纸吸干;加50 µl Streptavidin-HRP工作液,37℃避光反应30 min;PBS漂洗5 min×3次,加TUNEL染液,每片加50µl,37℃避光反应45 min;PBS漂洗5 min×3次,荧光封片液封片,盖上盖玻片,指甲油封好盖玻片,倒置荧光显微镜(Olympus,Japan)下观察计数。细胞质被染成绿色荧光的细胞为凋亡细胞。对各组每张切片分别取5个视野进行凋亡细胞计数,取平均值,荧光显微镜拍照。TUNEL检测试剂盒购自碧云天生物技术公司。
1.5 Western Blot 检测
3组大鼠随机各取5只,用10%水合氯醛腹腔麻醉,立即断头取脑。切取海马置于预冷的细胞裂解液中充分匀浆后冰上静置30 min;沸水中煮5 min;冰上冷却5 min;以12000g转速于4℃离心30 min;弃沉淀,留上清液。取小部分上清液用BCA法测定蛋白浓度,剩余上清液分装,置-80 ℃冰箱待用。等量蛋白样品(50 µg)经12.5% SDS聚丙烯酰胺凝胶电泳分离后,电转移至硝酸纤维素膜上。经5%脱脂奶粉室温下封闭1 h,分别用兔多抗NGF(1:1000,Santa Cruz)、兔多抗 Phospho-Akt(Ser473)、Akt(1:2000,Cell Signaling Technology)、兔多抗 Bcl-2、Bax(1:500,Santa Cruz)及兔单抗-action(1:1000,Santa Cruz)室温孵育1 h后,4℃过夜;TBST洗膜10 min ×3次,分别加入相应的HRP结合的羊抗兔IgG(1:2000,Pierce)室温孵育1 h;TBST洗10 min ×3次,加入ECL发光液1 min后于暗室内进行胶片曝光、显影、定影、晾干。实验重复3次,-actin作为内参照。以目的条带与内参的吸光度比值表示蛋白表达。应用Bandscan.5.0进行分析。
1.6 统计学分析
2 结果
2.1 大鼠行为学测试结果
表1显示,各组大鼠在5天的游泳训练中对寻找平台均有一定的学习记忆能力,随着训练时间延长,大鼠逃避潜伏期逐渐缩短。从第3天开始,与NC组相比,AC组大鼠逃避潜伏期显著延长(P <0.01),与AC组相比,训练第4天、第5天AE组大鼠逃避潜伏期显著缩短(P < 0.01)。
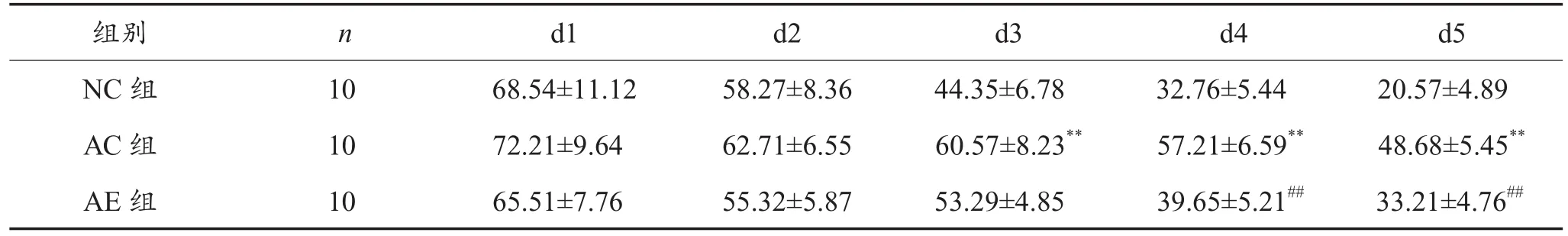
表1 定位航行试验中三组大鼠逃避潜伏期比较(s)
空间探索试验中,NC组、AC组和AE组跨越平台次数分别为10.79±1.21、5.93±0.94与8.48±0.82。经双因素方差分析,与NC组比较,AC组大鼠跨越平台次数明显降低(P < 0.01);与AC组比较,AE组大鼠跨越平台次数明显增加(P < 0.01)。
2.2 大鼠海马CA3区TUNEL染色结果
图1显示:NC组海马CA3区凋亡细胞少,AC组绿色荧光强度明显增强。表2显示,与NC组比较,AC组海马CA3区凋亡细胞数显著增加(P< 0.01),AE组显著少于AC组(P < 0.01)。
2.3 Western Blot 检测结果
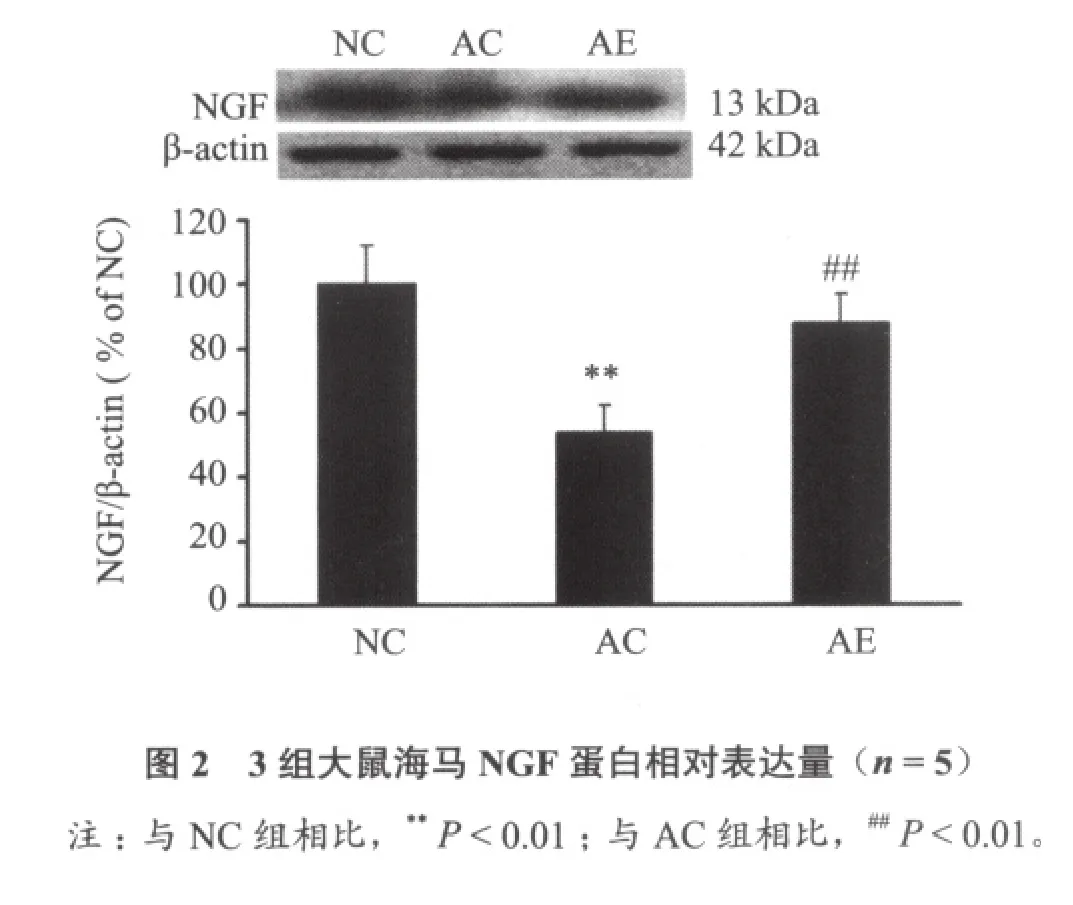
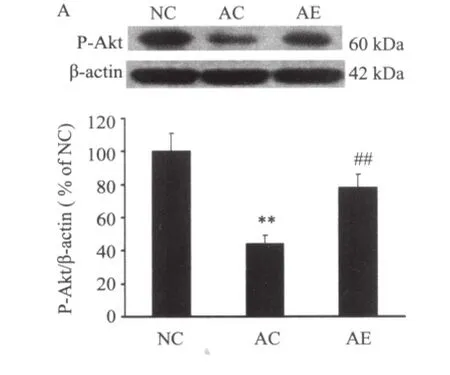
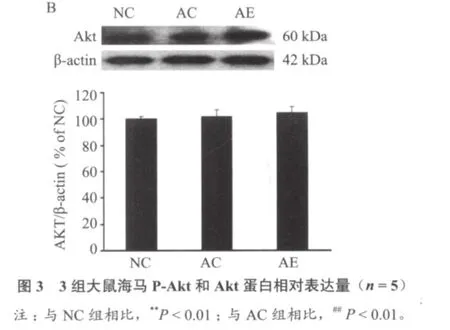
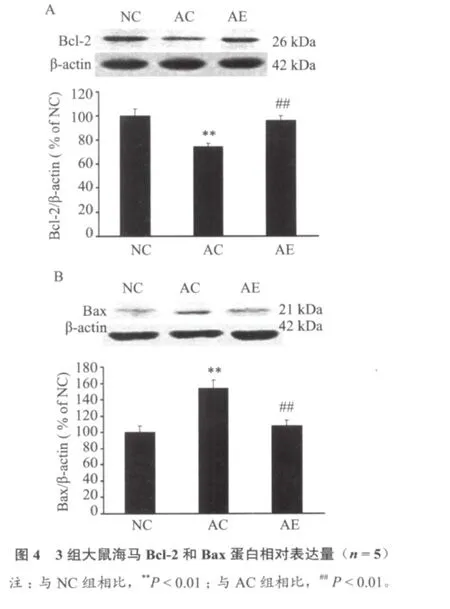
图2~图4显示,与NC组比较,AC组NGF、P-Akt和Bcl-2蛋白表达明显降低(P < 0.01);与AC组相比,AE组NGF、P-Akt和Bcl-2蛋白表达明显增加(P < 0.01)。3组Akt表达无明显差异(P> 0.05);与NC组比较,AC组Bax蛋白表达显著增加(P < 0.01),与AC组相比,AE组Bax蛋白表达显著减少(P < 0.01)。
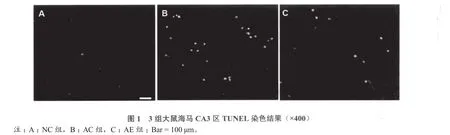

表2 3组大鼠海马神经元凋亡细胞数(n = 3)
3 讨论
注射D-半乳糖致亚急性衰老大鼠模型是抗衰老研究的较好模型之一[7]。青年大鼠长期注射D-半乳糖后由于其代谢产物半乳糖醇不能被进一步代谢而堆积在细胞内,影响渗透压,导致细胞肿胀,代谢紊乱,体内活性氧水平升高,细胞膜脂质受损,以致产生机体多器官、多系统的功能衰退,这些变化和自然衰老的变化一致。Morris水迷宫是通过让实验动物学习在水中寻找隐藏平台并通过分析其寻找平台所用时间和所走路径测试实验动物对空间位置觉和方向觉(空间定位)的学习记忆能力,进而判断实验动物记忆功能好坏的一种行为学测试方法。本实验结果显示,与正常对照组相比,注射D-半乳糖所致衰老大鼠逃避潜伏期明显延长,跨越平台次数明显减少,说明在本实验中,注射D-半乳糖可致大鼠学习记忆能力明显下降。而与安静衰老大鼠比较,经6周游泳训练的衰老大鼠逃避潜伏期明显缩短,跨越平台次数明显增加,差异有统计学意义,表明6周游泳负荷训练可以提高衰老大鼠的空间学习记忆能力。这些结果与文献报道[6,8,9]一致,因此长期适宜的体力活动可以改善衰老引起的认知功能低下和学习记忆能力降低。
海马是与学习记忆关系最密切的解剖结构。衰老的病理变化主要表现为广泛的大脑皮层神经元丧失,尤其是海马和基底前脑胆碱能神经元发生退化[10]。神经细胞在衰老过程中的死亡主要是以凋亡形式发生的,神经元凋亡导致的突触丢失是记忆功能障碍最主要的原因。本实验结果表明,注射D-半乳糖可引起大量海马神经元凋亡,而6周游泳训练可减少D-半乳糖引起的大鼠海马神经元凋亡,表现为TUNEL阳性细胞数明显减少,说明6周的游泳训练对海马神经元具有保护作用。Chae等[11]研究指出,8周中等负荷跑台训练可有效降低海马神经元凋亡率。而田野等[12]提出,过度负荷游泳训练可使大鼠海马神经元的细胞形态及超微结构发生损伤性改变。这说明运动负荷的控制对其影响海马神经元是一个关键。
已有文献报道,NGF可促进胆碱能神经元生长、分化和生存。外源性NGF可恢复因年龄因素引起的胆碱能神经元的损害,从而改善衰老大鼠的记忆[13,14]。本实验结果显示,与正常对照组相比,衰老大鼠海马神经元NGF表达明显降低,而6周游泳训练可明显增加衰老大鼠NGF表达量,说明6周游泳训练可增加本实验衰老大鼠海马内源性NGF表达。Chae等[15]对糖尿病大鼠进行中等负荷的跑台训练后发现大鼠脑内NGF表达明显增加。Neeper等[16]研究结果表明在7天自愿转笼运动后大鼠海马NGF表达迅速显著增加。以上研究表明,NGF变化与运动刺激密切相关,适宜负荷的运动可以增加NGF分泌,促进受损神经元功能的恢复。NGF等生长因子与其细胞膜表面相应受体结合后可以激活一些细胞信号传导通路,PI3-K/Akt信号通路是其中之一。PI3-K被NGF等胞外信号活化后,激活下游蛋白激酶Akt,活化的Akt可促进凋亡基因失活,从而抑制神经元凋亡以及促进神经元的存活[17]。Vaillant等[18]发现 Akt能维持 NGF 诱导的交感神经元的存活。本实验观察到AC组海马神经元P-Akt表达明显低于NC组,6周游泳训练后AE组P-Akt表达明显高于AC组,这说明6周游泳训练可以提高衰老大鼠海马神经元磷酸化Akt水平,已有研究[17,19]表明,Akt只有在磷酸化状态下才能发挥其活性作用。而本实验中3组海马神经元非磷酸化Akt表达无显著性差异。丁树哲等[20]研究指出,耐力训练可以增加衰老小鼠心肌Akt mRNA表达,从而提高衰老小鼠心肌细胞蛋白合成效率。Chen[21]等对大鼠进行2周的自愿转笼运动训练后发现,伴随着BDNF表达的增加,磷酸化Akt表达也增加。
Bcl-2是Akt信号通路的下游分子之一。关于运动对Bcl-2家族蛋白影响的研究较多,Kang等[22]指出16周的跑台训练可上调AD模型大鼠脑内Bcl-2的表达,并下调Bax的表达。张钧等[23]指出长期中等强度训练可提高大鼠心肌中Bcl-2 mRNA的表达。本实验中,6周游泳训练明显提高衰老大鼠海马Bcl-2表达水平,同时降低Bax表达。我们认为其机制可能是6周的游泳训练增加了大鼠内源性NGF表达,增加的NGF与其相应受体结合后激活细胞存活通路PI3k/Akt,活化的Akt磷酸化Bad,进而增加Bcl-2表达,同时抑制Bax表达,起到抑制海马神经元凋亡的作用。
4 总结
注射D-半乳糖诱导的衰老模型大鼠进行6周游泳训练后,其逃避潜伏期明显缩短,跨越平台次数明显增加,同时海马神经元凋亡明显改善,可能是运动通过增加大鼠海马内源性NGF产生,激活PI3K/Akt通路,导致Bcl-2蛋白表达增加,降低Bax表达,从而促进神经元存活。
[1]Mattson MP. Pathways towards and away from Alzheimer,s disease. Nature,2004,430,631-639.
[2]Betarbet R,Sherer TB,MacKenzie G,et al. Chronic systemic pesticide exposure reproduces features of Parkinson's disease. Nat Neurosci,2000,3(12):1301-1306.
[3]Rodgers EE,Theibert AB. Functions of PI 3-kinase in development of the nervous system. Int J Dev Neurosci,2002,20(3-5):187-197.
[4]Cechetti F,Fochesatto C,Scopel D,et al. Effect of a neuroprotective exercise protocol on oxidative state and BDNF levels in the rat hippocampus. Brain Res,2008,1188:182-188.
[5]刘晓莉,李红,乔德才. 适量运动对大鼠海马神经元脑源性神经营养因子表达的影响. 沈阳体育学院学报,2008,27(3):5-6,21.
[6]党胜利,白石. 中等负荷跑台训练对D-半乳糖致衰老大鼠基底前脑-皮质自由基代谢的影响. 西安体育学院学报,2009,26(3):347-350.
[7]徐智,吴国明,钱桂生. 大鼠衰老模型的初步建立.第三军医大学学报,2003,25(4):312-315.
[8]田苏平,陈海鹰,陈启盛. 游泳应激对衰老小鼠学习记忆及脑内脂褐素含量的影响. 南京医科大学学报,1998,18(3):37-39.
[9]Radak Z,Kaneko T,Tahara S,et al. Regular exercise improves cognitive function and decreases oxidative damage in rat brain. Neurochem Int,2001,38(1):17-23.
[10]Perez CA,Cancela CJM. Benefits of physical exercise for older adults with Alzheimer’s disease. Geriatr Nurs,2008,29(6):384-391.
[11]Chae CH,Kim HT. Forced,moderate-intensity treadmill exercise suppresses apoptosis by increasing the level of NGF and stimulating phosphatidylinositol 3-kinase signaling in the hippocampus of induced aging rats. Neurochem Int,2009,55(4):208-213.
[12]满君,田野,高颀. 过度运动对海马神经元形态及脑源性神经营养因子表达的影响. 中国运动医学杂志,2004,23(5):510-512.
[13]Jakubowska-Dogru E,Gumusbas U. Chronic intracerebroventricular NGF administration improves working memory in young adult memory de fi cient rats. Neurosci Lett,2005,382(1-2):45-50.
[14]Pizzo DP,Thal LJ. Intraparenchymal nerve growth factor improves behavioral deficits while minimizing the adverse effects of intracerebroventricular delivery. Neuroscience,2004,124(4):743-755.
[15]Chae CH,Jung SL,An SH,et al. Treadmill exercise improves cognitive function and facilitates nerve growth factor signaling by activating mitogen-activated protein kinase/extracellular signal-regulated kinase1/2 in the streptozotocin-induced diabetic rat hippocampus. Neuroscience,2009,164(4):1665-1673.
[16]Neeper SA,Gomez-Pinilla F,Choi J,et al. Physical activity increases mRNA for brain-derived neurotrophic factor and nerve growth factor in rat brain. Brain Res,1996,726(1-2):49-56.
[17]Manning BD,Cantley LC. AKT/PKB signaling: navigating downstream. Cell,2007,129(7):1261-1274.
[18]Vaillant AR,Mazzoni I,Tudan C,et al. Depolarization and neurotrophins converge on the phosphatidylinositol 3-kinase-Akt pathway to synergistically regulate neuronal survival. J Cell Biol,1999,146(5):955-966.
[19]Burke RE. Inhibition of mitogen-activated protein kinase and stimulation of Akt kinase signaling pathways:Two approaches with therapeutic potential in the treatment of neurodegenerative disease. Pharmacol Ther,2007,114(3):261-277.
[20]李欣,丁树哲,卢健. 耐力训练对衰老小鼠心肌Akt/mTOR信号通路的影响. 中国运动医学杂志,2010,29(1):38-41.
[21]Chen MJ,Russo-Neustadt AA. Exercise activates the phosphatidylinositol 3-kinase pathway. Brain Res Mol Brain Res,2005,135(1-2):181-193.
[22]Um HS,Kang EB,Leem YH,et al. Exercise training acts as a therapeutic strategy for reduction of the pathogenic phenotypes for Alzheimer's disease in an NSE/APPsw-transgenic model. Int J Mol Med,2008,22(4):529-539.
[23]张钧,陈晓莺,许豪文. 运动对心肌细胞中凋亡调控基因表达的影响. 体育科学,2005,25(8):79-82.

