马蔺不同生长阶段嫩叶POD和EST同工酶分析
李强栋,孟 林,毛培春,张德罡,韩润英
(1.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070;2.北京市农林科学院 北京草业与环境研究发展中心,北京 100097;3.内蒙古通辽市畜牧兽医科学研究所,内蒙古 通辽 028000)
马蔺(Iris lactea)系鸢尾科鸢尾属多年生草本植物,广泛分布我国华北、西北、东北、华东和青藏高原等地。生长在较低湿的盐碱滩地以及高山河谷地区,可称为优势单纯的群落,尤以过度放牧的盐碱化草地上较多,而在重盐渍化和地下水位较深的干燥环境较少。马蔺具有耐盐碱、耐粗放管理、抗旱抗寒性强等特点,花色淡雅、叶色泽青绿柔软厚实、病虫害少、修剪频率少,是优良的生态观赏地被植物,在绿化、水土保持、植被恢复等方面具有开发潜力[1,2]。近年来,科学工作者对马蔺的研究集中在形态结构特征与地理分布关系、破除种子休眠、提高发芽率、抗旱抗寒性、耐盐碱能力及其他抗逆性鉴定、引种及驯化和栽培、组织培养和繁殖推广等方面[3],而关于马蔺种质材料遗传多样性方面的工作报道较少[4,5]。
酶是基因表达的产物,酶蛋白多肽链结构中的氨基酸顺序是由DNA上结构基因所携带的遗传信息决定的,而同工酶分析是通过电泳技术把酶蛋白分子分离,然后通过组织化学特异性染色将其位置和活性直接在染色区带以酶谱形式标记出来。因此,通过对酶谱分析就能识别控制这些谱带所表达的基因,从而在生化水平上研究植物体遗传变异[6,7]。1980年Brewbaker等对玉米(Zea mays)同工酶电泳发现,玉米中过氧化物酶同工酶存在不同组织及不同生长阶段的多型现象[8],之后关于植物不同组织器官、不同生长阶段同工酶差异性已有较多报道,而且不同种类同工酶具有生长阶段和组织特异性[9,10]。
以采自我国北方5省区11份野生马蔺为实验种子,繁殖后分别于营养阶段和生殖生长阶段随机选取其健康功能叶用于同工酶分析,通过分析营养生长阶段及生殖生长阶段的POD和EST(POD,E.C.1.11.1.7;EST,E.C.3.2.1.1)酶谱特征的变化,探讨2种同工酶的多种分子形式在不同居群间的表型特征与遗传结构之间的连续性、稳定性及变异性,酶蛋白的多种分子形式所具有生长阶段特异性及不同组织器官特异性。以期在生化水平上,为利用同工酶技术分析马蔺种质材料遗传多样性提供理论数据。
1 材料和方法
1.1 实验材料来源
以采集的我国北方5省区不同生境分布的11份野生马蔺种子为实验材料(表1)。

表1 实验马蔺种质材料及其来源Table 1 Source of tested germplasms
1.2 实验方法
1.2.1 日光温室 将收集到的不同生境马蔺种子,于2009年在北京市农林科学院草业中心日光温室种子繁殖,幼苗培育之后移栽大田管理。育苗时在内径21 cm,高18cm的花盆装入3kg培养基质(过筛土∶草炭=2∶1),每份材料3次重复,每重复50粒种子[3]。大田生长及时除杂、浇水。
1.2.2 酶液提取 分别剪取不同生长阶段马蔺幼嫩叶片1g,洗净并剪碎放入预冷的研钵。先加入2mL预冷的缓冲液(POD 0.065mol/L Tris-柠檬酸 pH 8.2;EST 1mol/L Tris-HCl pH 8.3),在冰浴中研磨,冲洗于5mL离心管中,在10 000r/min 4℃冷冻离心机中离心5min,取上清液加入等体积10%甘油,分装于0.3mL离心管中,保存于-20℃冰箱以备点样[7]。
1.2.3 电泳及染色 参照文献[11]电泳体系及凝胶染色方法,并做适当调整。POD用改良联苯胺法染色,EST采用萘酯-偶氮色素法染色。染色后的胶版用7%冰醋酸漂洗固定脱色。重复多次,选取清晰、整齐的凝胶拍照并作进一步分析。
1.2.4 凝胶分析 凝胶谱带的不同染色深度表示酶活性强弱,将酶活性划分为4个等级,从4至1依次为强、较强、弱、最弱。根据各个谱带的迁移距离计算其相对电泳迁移率(Rf=凝胶中谱带迁移距离/前沿指示剂迁移距离),同时绘制凝胶酶谱模式图[12]。
2 结果与分析
2.1 同工酶酶谱特征分析
通过酶电泳实验,研究了11份马蔺种质材料在营养和生殖生长阶段的POD和EST同工酶(图1~4)。结果表明,供试材料POD和EST共显示出了22个不同酶带,即POD-A~POD-M 和EST-A~EST-I。依照经验[13],将酶带划分为快、慢两区,其中 POD-A~POD-H 和 EST-A~EST-H 为慢区(SS),POD-H~POD-M 和 EST-I为快区(FF),其 Rf介于0.041~0.875(表2、3)。其中,POD-A、D、F、J和 EST-A、D、E、I为马蔺的基本谱带,而POD-E、G和EST-B、G等4条谱带仅出现在2、3和10号马蔺种质材料,其Rf分别为0.196、0.227、0.583,0.713,为材料所具有的特征谱带。基本谱带是不同居群间种质材料具有相同起源基因的证明,而4条特征酶带表明了植物在不同的生态地理环境中发生了不同的趋异分化,这些谱带可作为植物在不同生长阶段,组织与器官系统发育的特异性指标,以及鉴定品种和物种分类的指标[14-16]。
2.2 不同生长阶段EST同工酶分析
随着植株从营养到生殖生长阶段,EST总酶带数由65条减少到61条,酶带数变化不大(图1b,2b)。其中,1号材料 EST-F,2号 EST-H,4号 EST-F,5号EST-F、-H酶带在生长过程中发生缺失现象;5号材料出现EST-C酶带。相比较营养生长阶段,生殖生长阶段的EST基本谱带没有发生缺失或增加现象,仅在酶活性方面有变化。如1,2和3号马蔺种质材料的EST-A酶带由2级降为1级,4~9号材料的EST-A酶带由3级降为2级,1~4号的EST-C酶带较营养生长阶段降了1级;2号的EST-C与6、7号的EST-D酶带由2级变为3级。其中,特征谱带3号EST-B和10号EST-G酶带的酶活性降低。表明马蔺在不同生长阶段EST存在变化,营养生长阶段EST酶谱的酶活性较生殖生长阶段更强,酶谱表现也更清晰(图1a、2a)。
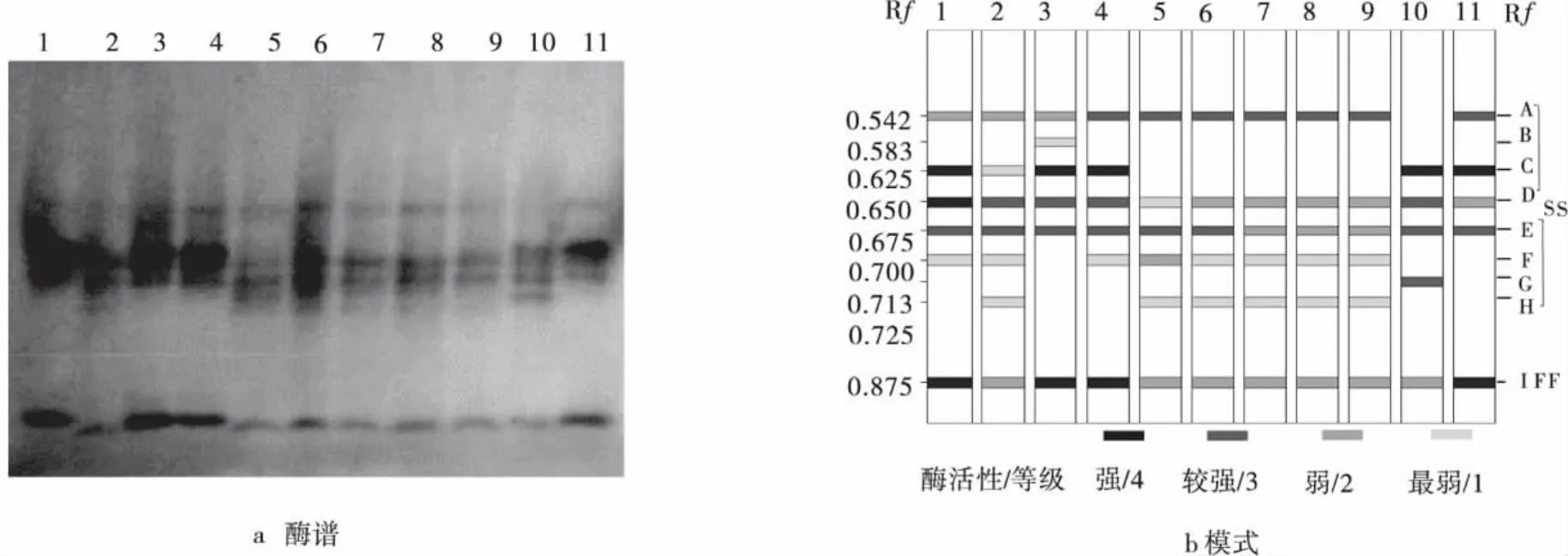
图1 马蔺种质材料营养生长阶段EST酶谱及模式图Fig.1 The EST photograph and ideogram of Chinese Irisin vegetative growth stage
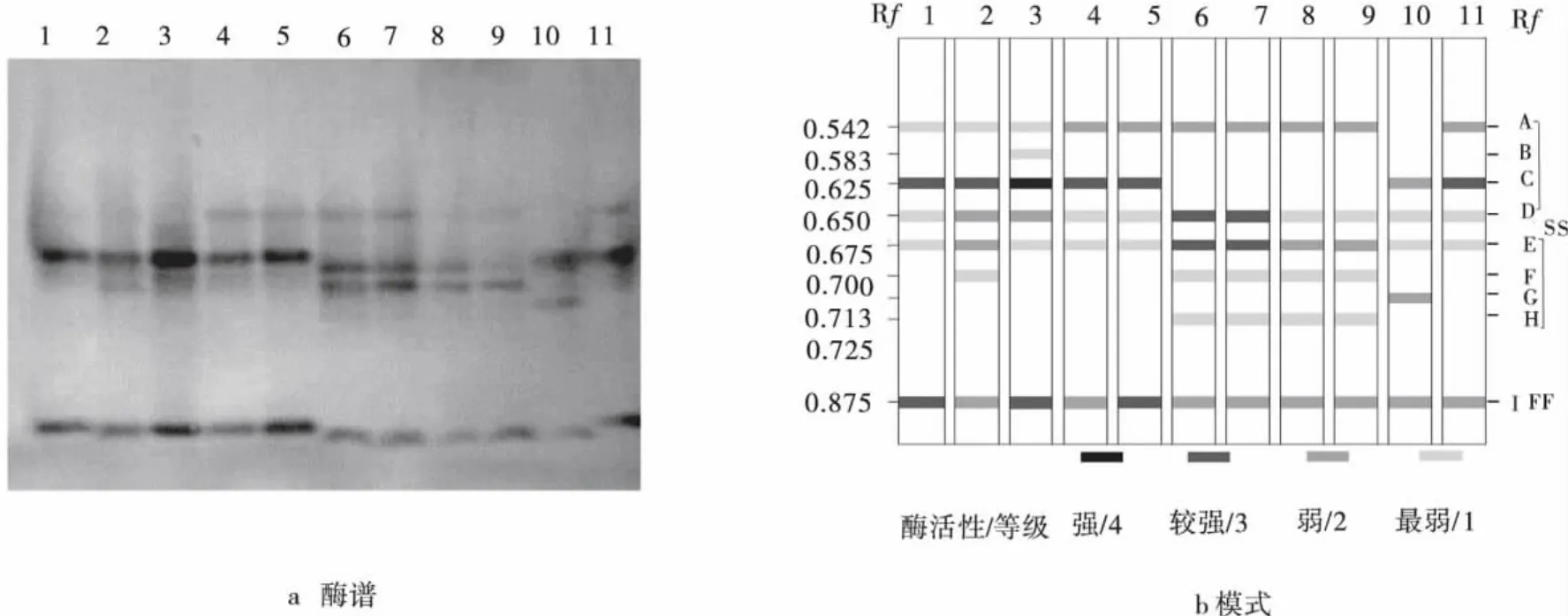
图2 马蔺种质材料生殖生长阶段EST酶谱及模式图Fig.2 The EST photograph(a)and ideogram(b)of Chinese Irisin reproductive growth stage
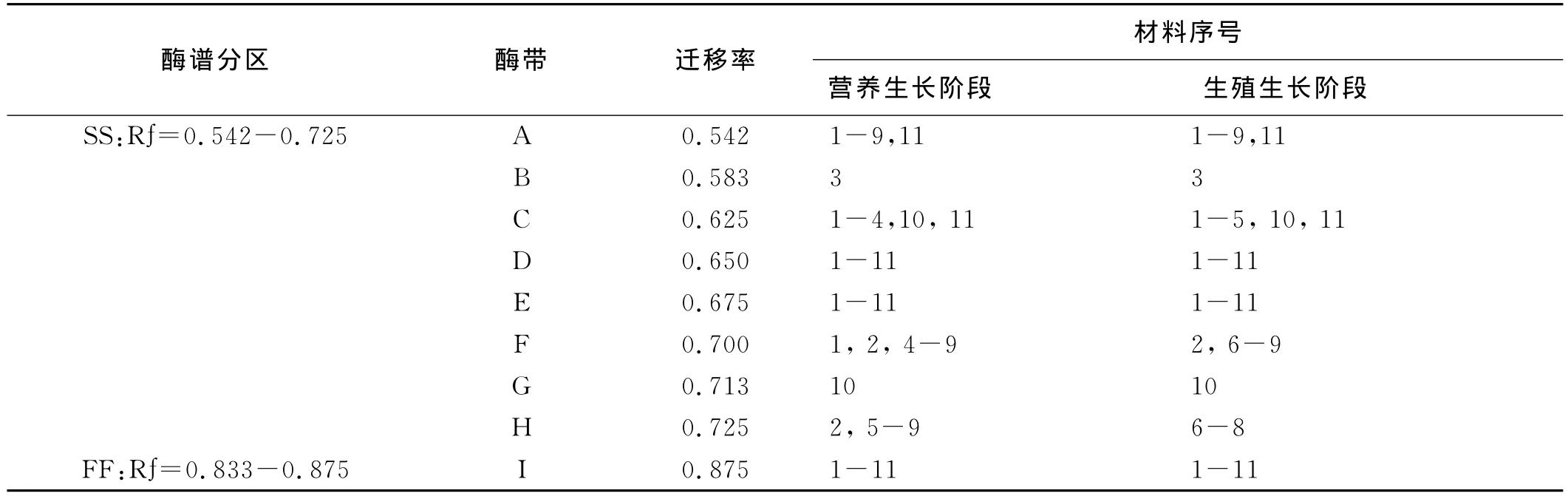
表2 马蔺种质材料不同生长阶段EST酶带数及迁移率Table 2 Total EST bands and Rf value of Chinese Irisin vegetative and reproductive growth stages
2.3 不同生长阶段POD同工酶分析
随着植株从营养阶段到生殖生长阶段,POD总酶带数仍为79条,酶带数没有发生变化,但在不同迁移率带的缺失及酶活性方面发生变化(图3b、4b)。其中,材 料2号 POD-B、-E、-G、-J、-K 酶 带,5 号 POD-J酶带,10号POD-A、-J酶带在生长推进过程中发生缺失现象,而部分材料较营养生长阶段有新酶带出现,如2号的POD-B、-F酶带,3号的POD-C酶带,6号POD-B酶带,8号 POD-A 酶带,9号的 POD-J、-K 酶带,10号POD-D、-L酶带。酶活性变化也相当丰富,如1号材料 POD-F、-J、-K 酶 带,2 号 POD-A、-L 酶 带,4 号POD-F酶带,5号 POD-B酶带,8号 POD-B、-C、-D 等酶带的酶活性随着生长阶段推进而降低;材料3号的POD-J、-K,4 号 POD-J,6 号 POD-H、-K,9 号 PODH、-I等酶带的酶活性增强。说明POD酶活性同样随着植物生长阶段的不同发生变化,在生殖生长阶段POD酶谱的酶活性较营养生长阶段更强,酶谱表现也较清晰(图3a、4a)。

图3 马蔺种质材料营养生长阶段POD酶谱及模式图Fig.3 The POD photograph(a)and ideogram (b)of Chinese Irisin vegetative growth stage
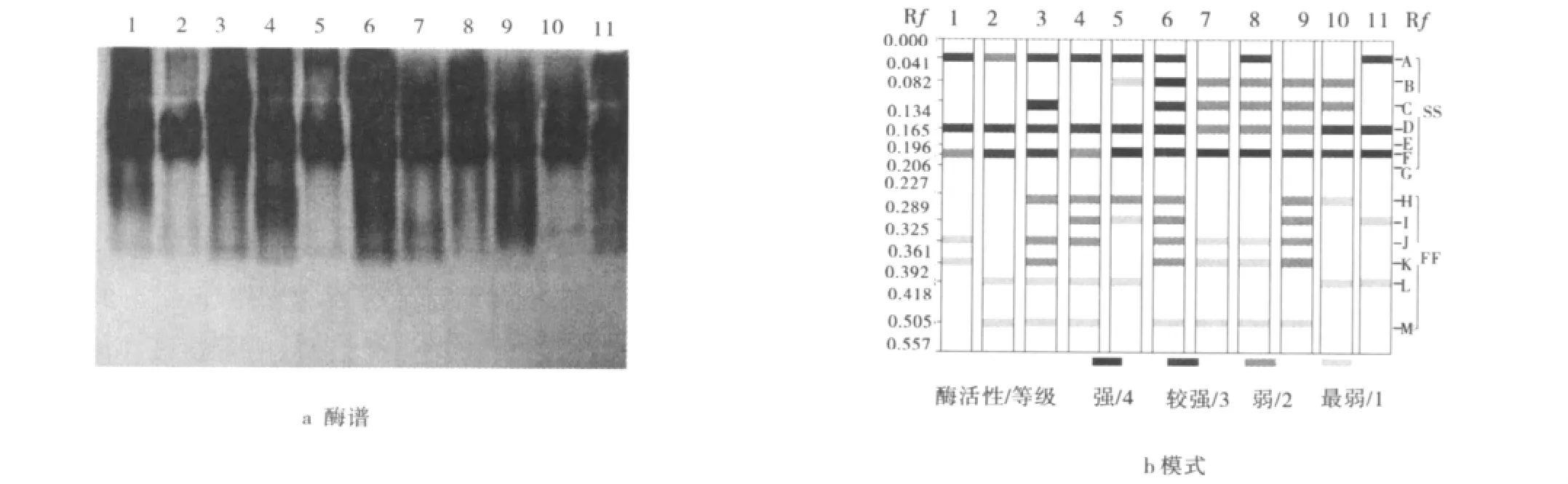
图4 马蔺种质材料生殖生长阶段POD酶谱及模式图Fig.4 The POD photograph(a)and ideogram(b)of Chinese Irisin reproductive growth stage
3 讨论与结论
3.1 马蔺同工酶技术应用
同工酶技术作为检测物种遗传多样性的一种生化标记方法,随着酶谱技术研究的迅速发展及读谱技术的成熟,酶电泳信息数据的处理与分析对系统分子进化、发生和遗传的研究越来越重要。丁毅等[17]采用聚丙烯酰胺凝胶电泳分析了产于我国不同地区的近缘野生大麦及栽培大麦,指出近缘野生大麦同栽培大麦之间具有相同的酶谱类型,在育种过程中选取不同类型酶谱或者酶谱相同而地理距离较远的材料进行杂交配组。韩天文等[18]用同工酶技术对5个苏丹草(Sorghum sudanense)品种酯酶同工酶进行分析,指出苏丹草幼苗叶片相比较根部酯酶谱带较少,同时利用Rf为0.84位点能够快速有效地区分5个苏丹草品种。张雪婷等[19]通过对陇东野生紫花苜蓿过氧化物酶同工酶谱的研究,发现其与多数苜蓿种质材料存在较大的遗传差异,单独聚为一类。
由此看出,同工酶技术应用于物种遗传变异、植物细胞分化和个体发育、亲缘关系鉴定和植物育种方面研究具有实际意义,可以作为重要的遗传标志。此次实验通过对马蔺2个生长发育阶段同工酶谱变化分析,发现嫩叶同工酶在营养生长和生殖生长阶段有相对稳定性,适合用于马蔺同工酶分析样品提取。通过进一步酶谱统计,供试材料POD和EST共显示出了22个不同酶带,其中,有8条基本谱带和4条特征谱带,基本谱带说明11份材料具有遗传上的同源性,一方面可以作为马蔺不同发育阶段酶谱的识别标志;另一方面,说明不同生态地理位置生长的马蔺具有亲缘关系;而特征谱带及不同位点的酶谱、酶活性等说明种间存在明显的差异,表明它们的异染色质之间存在多态性。植物受到不同生境影响,遗传分子水平发生变异,从而导致同工酶水平发生相应的变异,而通过酶谱能识别控制这些谱带所表达的基因,客观上说明了不同地理位置马蔺种质材料的遗传关系,利用过氧化物酶和酯酶酶谱分析作为一项鉴定指标具有重要的应用价值,为马蔺遗传多样性鉴定和育种等工作提供依据[20]。
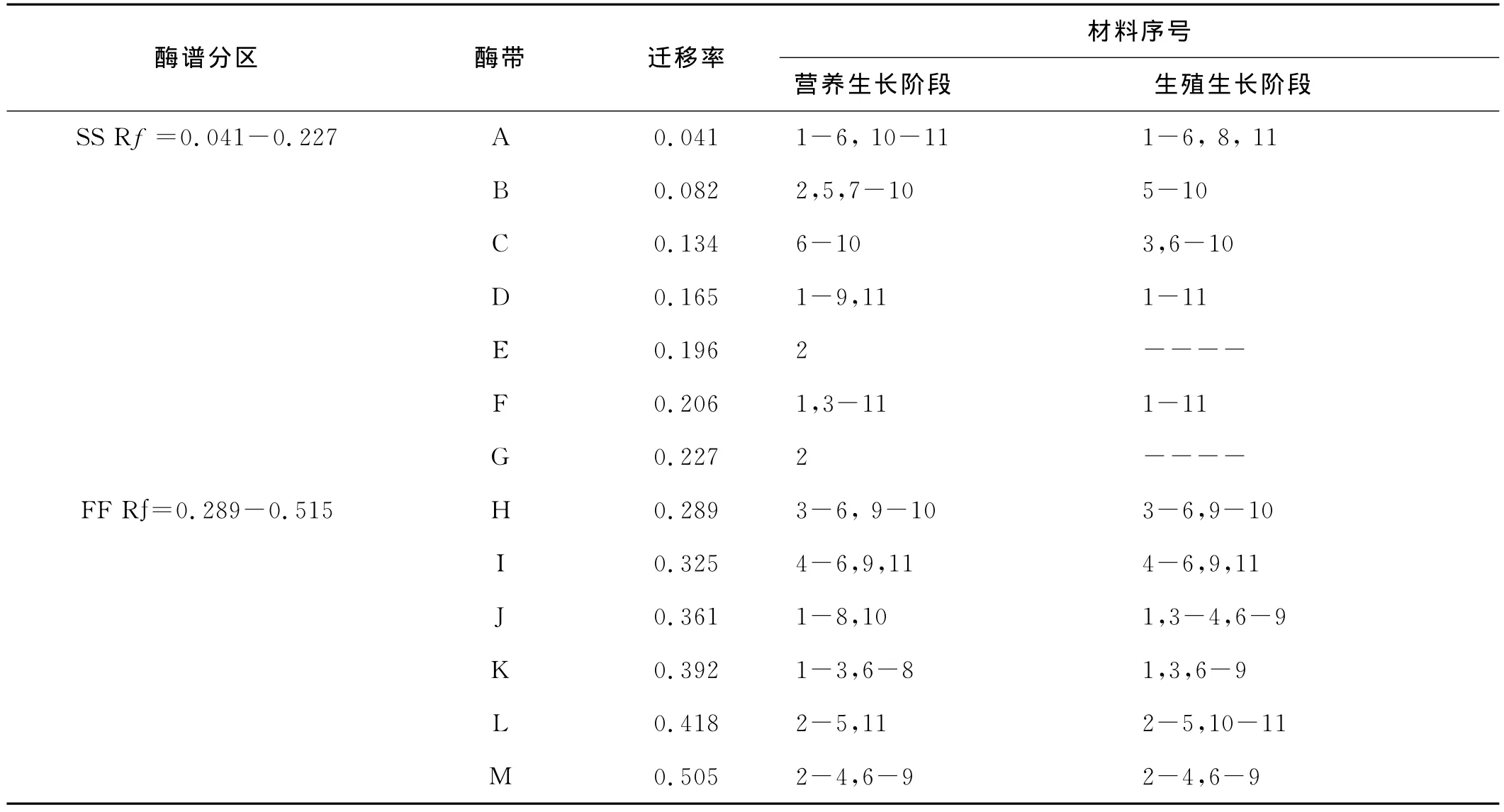
表3 马蔺种质材料营养生长阶段POD酶带数及迁移率Table 3 Total POD bands and Rf value of Chinese Irisin vegetative and reproductive growth stages
3.2 马蔺不同生长阶段同工酶变化
在生物进化中,同工酶为了适应细胞代谢的多方面需求而产生,其在生理上表现为对代谢的调节作用[21]。当一个酶受多个基因控制时,更容易适应环境的变化,广泛存在于植物体内的过氧化物酶同工酶是植物体适应环境变化并对变化做出灵敏反应的一类酶,常被认为是植物对环境抗逆性强弱的标志。梁慧敏等[22]通过测定变温处理情况下苜蓿不同器官过氧化物酶同工酶变化,指出温度降低,苜蓿过氧化物酶同工酶酶活性增加,而与温度上升呈明显的负相关。酯酶是催化酯类化合物水解的酶系,它催化羧酸酯类的酯键的水解或合成,在植物不同的生长发育时期表现出器官特异性和阶段的特异性[6]。刘波等[23]通过酶电泳实验指出,不同居群半夏(Pinellia temate)不同酶系统中均有半夏物种的共同特征谱带,同时又蕴含着丰富的多态性。马彦军等[24]利用酶电泳技术研究不同浓度PEG处理尖叶胡枝子(Lespedeza hedysaroides)幼苗叶片同工酶及酶活性变化,说明同工酶与作物抗旱性有一定关系,在水分胁迫后,叶片酶谱迁移率大小不同,说明在不同逆境下出现了不同酶的基因表达。在植物的不同发育阶段和不同器官组织中同工酶都具有特异性表现,其合成受到一系列基因的调控,常作为遗传信息的指标来研究植物的生长发育和器官分化[25,26]。在对11份马蔺POD和EST分析时发现,不同生长阶段的酶带数和酶活性强弱差异较大,如营养生长阶段EST酶谱的酶活性较生殖生长阶段更强,酶谱表现也更清晰,而生殖生长阶段POD酶谱的酶活性较营养生长阶段更强,酶谱表现也较清晰。同丁玲等[10]采用过氧化物酶和酯酶分析了菊花营养生长和生殖生长阶段不同器官的同工酶变化相似,指出菊花的2个酶系统POD和EST分别在营养生长阶段和生殖生长阶段清晰、分离好,具有多态性,随着植物生长发育过程,植物组织或器官的生理特性和代谢过程发生深刻变化,同工酶也随之变化。说明不同种类植物体同工酶表现出组织特异性和发育阶段特异性,可以利用同工酶电泳酶谱信息数据为马蔺遗传多样性提供生化水平分析的理论依据。
[1]孟林,张国芳,赵茂林.水土保护坡观赏优良地被植物-马蔺[J].农业新技术,2003(3):38-39.
[2]张德魁.马蔺的特性研究进展与开发利用[J].草原与草坪,2006(3):7-10.
[3]孟林,毛培春,张国芳.不同居群马蔺抗旱性评价及生理指标变化分析[J].草业学报,2009,18(5):18-24.
[4]牟少华,彭镇华,郄光发,等.马蔺种质资源AFLP标记遗传多样性分析[J].安徽农业大学学报,2008,35(1):95-98.
[5]王康,董宽虎,孙彦,等.马蔺ISSR-PCR反应体系的建立与优化[J].草地学报,2008,16(6):581-589.
[6]邹春静,盛晓峰,韩文卿.同工酶分析技术及其在植物研究中的作用[J].生态学杂志,2003,22(6):63-69.
[7]陈立强,师尚礼,满元荣.陇东野生紫花苜蓿的同工酶分析[J].草原与草坪,2010,30(1):24-32.
[8]Brewbaker J L,Hasegawsa Y.玉米中主要过氧化物酶的多型现象[C]//植物生理生化译丛(第三集).北京:科学出版社,1980:152-160.
[9]张淑改,薛俊杰,张芸香.松科四种植物的酯酶同工酶分析[J].山西农业大学学学报,1998,18(2):108-109.
[10]丁玲,陈发棣,滕年军,等.菊花不同生长阶段不同器官POD和EST同工酶比较[J].西北植物学报,2007,27(10):2 029-2 034.
[11]何忠效,张树政.电泳[M].北京:科学出版社,1999:280-287.
[12]胡能书,万贤国.同工酶技术及其应用[M].长沙:湖南科学技术出版社,1985:70-184.
[13]熊全沫.同功酶电泳数据的分析及其在种群遗传上的应用[J].遗传,1986,7(1):1-5.
[14]张成合,刘世雄,贾力.大白菜不同生育期和不同部位的过氧化物酶同工酶分析[J].中国蔬菜,1994(1):12-14.
[15]张德罡,曹文侠,蒲小鹏,等.东祁连山杜鹃属植物形态特征及其生态适应性[J].草原与草坪,2003,100(1):27-37.
[16]李霞,牟萌,李书华,等.雌雄芦笋过氧化物酶及酯酶同工酶的比较研究[J].江西农业学报,2009,21(11):30-32.
[17]丁毅,宋运淳.大麦酯酶同工酶酶谱的聚类分析与遗传研究[J].武汉大学学报(自然科学版),1995,41(6):729-734.
[18]韩天文,张建全.5个苏丹草品种酯酶同工酶比较研究[J].草业科学,2009,26(10):97-102.
[19]张雪婷,师尚礼.陇东野生紫花苜蓿的遗传特异性分析[J].草地学报,2009,17(3):343-348.
[20]陈家宽,杨继主.植物进化生物学[M].武汉:武汉大学出版社,1994.
[21]陈少裕.膜脂过氧化与植物逆境胁迫[J].植物学通报,1989(4):211-217.
[22]梁慧敏,夏阳.苜蓿抗寒性及根蘖性状的表现与过氧化物酶同工酶关系的研究[J].草业学报,1998,7(4):55-60.
[23]刘波,王荔,陈疏影,等.36份不同居群半夏同工酶研究[J].云南农业大学学报,2008,23(1):11-18.
[24]马彦军,曹致中,李毅.PEG胁迫对尖叶胡枝子幼苗SOD和POD同工酶的影响[J].草原与草坪,2010,30(1):64-67.
[25]帅素容,张新全,毛凯,等.德国白三叶品种与中国西部白三叶地方品种同工酶比较研究[J].草业科学,1998(2):9-13.
[26]Mowrey B D,Werner D J,Byrne D H.Isozyme survey of various species of Prunus in the subgenus Amygdalus[J].Sci Hort,1990,44:251-260.

