PCR-RFLP法快速测定种猪氟烷基因型及其使用优点
祁永旺,王昕陟*,侯 华,张 翠,王金旭
(1.沈阳农业大学畜牧兽医学院,沈阳 110161;2.沈阳市畜牧兽医研究所,沈阳 110034)
近年来,我国各大种猪场在对现有种猪选育的基础上,相继从国外引进大批长白、大约克和杜洛克等优良种猪。为了检验评定种猪的性能水平,促进各场加强种猪选育工作,开展了大量的种猪性能测定工作。测定性状主要为胴体品质和饲料效率,尚未见将猪的氟烷应激敏感基因的检测纳入种猪性能测定的常规指标中。猪的氟烷基因是一种应激基因,携带该基因的猪易发生应激综合征。猪应激综合征是指猪在应激因子(如驱赶、运输、防疫注射、配种、受惊吓等)的应激下,发生恶性、高热综合征,表现为呼吸急促、心跳加快、肌肉僵直、后肢呈现痉挛性收缩等,甚至突然死亡,产生PSE,其是由氟烷基因变异引起的。研究发现正常猪与应激猪骨骼肌的兰尼定受体(RYR1)经胰蛋白酶消化后的带型不同,表明正常猪与应激敏感猪之间的氨基酸发生了置换[1-4]。当应激因子作用时,Ca2+大量非正式释放,电解质代谢紊乱引起肌肉持续收缩,使猪产生恶性高热,大量析出的Ca2+激活过量的糖元酵解,引起肌肉pH的异常变化,导致劣质猪肉(PSE肉)产生,氟烷基因是由常染色体上的单隐形基因控制的一种遗传疾病,存在于外来种猪和外来种猪与地方猪杂交而育成的品种品系中[5-10]。其中高瘦肉率的种猪,皮特兰的氟烷基因阳性纯合子频率较高,易造成皮质下降,产生PSE肉,给世界各地的养猪生产、猪肉加工和销售造成巨大的经济损失,是制约现代养猪业经济发展的一个重要因素。及早准确地对猪群进行氟烷基因检测具有重要作用,因此,本试验从猪主中提取DNA,用特异引物进行PCRRFLP扩增法对种猪进行氟烷基因检测。
1 试验材料
1.1 试验动物及毛样的采集
长白、大约克及杜洛克种猪购自沈阳市畜牧兽医研究所种猪场。自猪只背部逆毛向采集带毛囊猪毛10~15根,置于装有灭菌生理盐水的离心管中,-20℃保存备用。
1.2 试验仪器及试剂
低温冰箱为中科美菱生产,高速冷冻离心机为KOKUSAN生产,微量移液器、电泳槽、电泳仪均购自北京市六一仪器厂,PCR仪为北京东迅天地医疗仪器有限公司生产,紫外透射仪为上海精科生产,WFH-202紫外透射仪、成像仪均由上海精科生产。PCR扩增试剂盒、Taq聚合酶、限制性内切酶HhaⅠ、蛋白酶K均购自大连宝生物公司,引物由大连宝生物公司合成,琼脂糖凝胶购自美国生命技术公司,TE溶液、10%SDS(十二烷基硫酸钠)、饱和酚、氯仿、异戊醇、三蒸水为国产试剂等。
2 试验方法
2.1 DNA提取
2.1.1 样品处理
将样品用三蒸水将表面洗净,选择5根毛囊完整的猪毛从根部剪取0.3~0.5 cm置于1.5mL EP管内,向EP管内加三蒸水500μL。12 000 rpm离心10min,弃上层水,将残余的水吸净后开始消化。
2.1.2 消化
加入裂解液400μL将离心后的组织悬浮,再加入10%SDS 200μL和蛋白酶K 10μL,56℃水浴消化过夜(12~14 h)。取出水浴混合液,12 000 rpm离心4min,取上层至1.5mLEP管内。
2.1.3 提取
分别加入等体积的饱和酚、氯仿和异戊醇(25∶24∶1),混匀 10min。4 ℃ 12 000 rpm 离心 10min。取上层移至另一EP管,重复2次。
2.1.4 弃上清
DNA沉淀用75%的乙醇(-20℃预冷)漂洗,12 000 rpm 4℃离心10min,重复2次。弃上清,自然干燥(或者超净台内风干)后用50~100μL超纯水(或TE缓冲液)溶解,-20℃保存备用。
2.1.5 DNA模板的检测
取DNA溶液5μL,加1μL的DL 2000 Marker,用1%琼脂糖凝胶电泳(130 V)约40min,染色10min,在凝胶成像系统中扫描成像。
2.2 PCR扩增
2.2.1 引物设计
引物A、B序列:引物A 5′ TCCAGTTTGCCACAGGTCCTACCA 3′;引物B 5′ ATTCACCGGAGTGGAGTCTCTGAG 3′[5]。
2.2.2 PCR反应体系
PCR反应体系见表1。
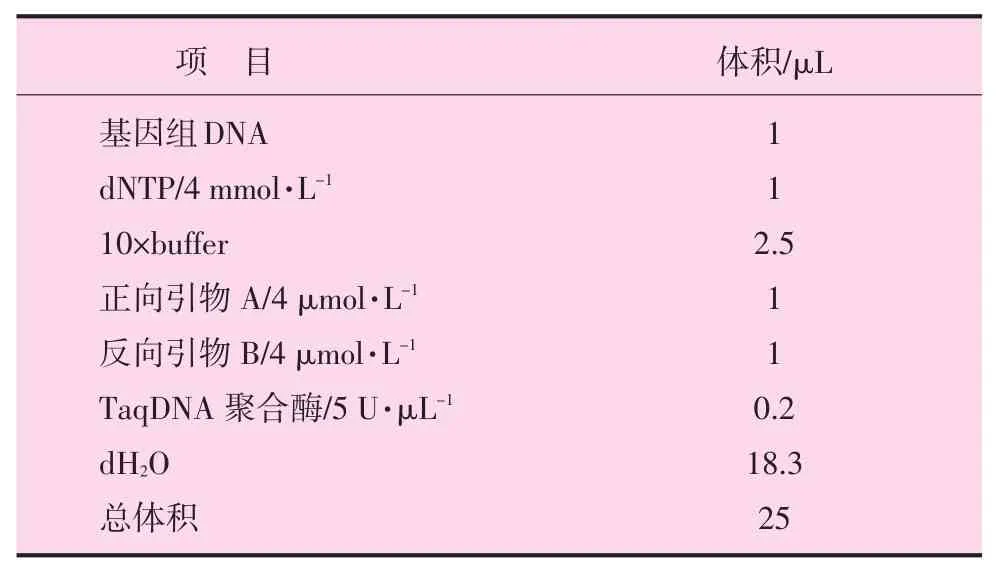
表1 猪氟烷基因PCR扩增反应体系
PCR反应条件为35个循环,预变性94℃5min,进入循环94℃45 s,56℃50 s,72℃50 s,72℃延伸10min。
2.2.3 PCR产物检测及酶切
取PCR产物5μL加DL 2 000Marker 1μL进行点样。1%琼脂糖凝胶电泳(130 v)40min后,将凝胶取出,EB染色后,在紫外灯下观察结果,并在凝胶成像系统上照相,保存电泳图谱。
取PCR产物10μL,加入Hha I内切酶(10 U·μL-1)0.4 μL 和 10×Buffer 2 μL,加超纯水至 20 μL,37℃恒温4 h,全部产物用1.5%琼脂糖凝胶电泳(130 v)40min,EB染色10min,在凝胶成像系统仪上观察结果。
3 试验结果
3.1 氟烷基因型检测结果
沈阳畜牧兽医研究所种猪场种猪的氟烷基因型检测结果见表2。
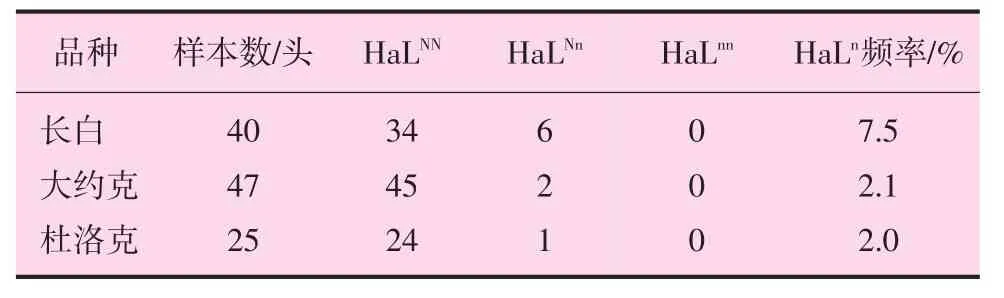
表2 不同种猪的氟烷基因型检测结果
由表2可见,在各品种中均没有发现氟烷基因阳性纯合子(HaLnn);而杂合子(HaLNn)在长白猪中有6头,HaLn基因频率为7.5%,在大约克夏猪中有2头,HaLn基因频率为2.1%,杜洛克猪中有1头,HaLn基因频率为2.0%,3个品种中杜洛克猪HaLn基因频率最低。
3.2 氟烷基因PCR产物HhaI酶切结果
氟烷基因PCR产物HhaI酶切结果见附图。
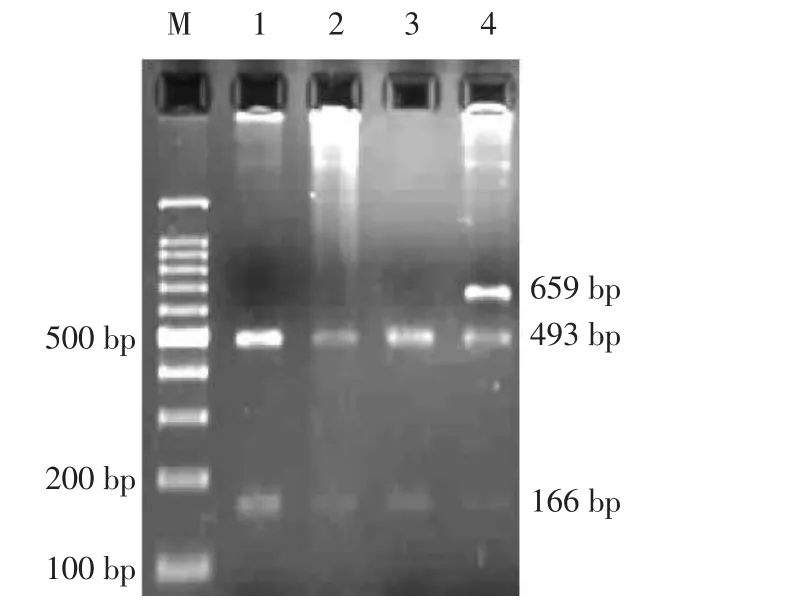
附图 氟烷基因PCR产物HhaI酶切结果
4 讨论
M—2000 bp的DNAmarker;1、2、3—NN型;4—Nn型
4.1 猪毛中DNA样品的制备
以纯化的DNA作为模板,在一定范围内增加模板的量可以提高扩增产物的量。本试验中随着猪毛根数的增加,PCR产物也随着增加。以4~6根时效果最好,7根以后扩增产物的量开始下降。有研究表明,当细胞数增加到600时,PCR产物量并不增加到4 800,PCR产物量则开始下降,这是由于DNA链附近大量细胞碎片使PCR反应受到了一定的抑制。其次,设计反应体系的关键是既能使DNA得到抽提,而又不破坏Taq酶的活性。在DNA抽提过程中通常用蛋白酶溶解细胞成分和蛋白,蛋白酶的活性受热易失活,不会影响DNA的抽提,而与DNA结合紧密的粗蛋白,Taq酶却不受低热和无毒性试剂的影响,确保了Taq酶的活性。
4.2 PCR-RFLP分析
PCR产物经内切酶HhaI酶切后,基因未发生突变时,内切酶HhaI可将PCR扩增的特异片段酶切成493 bp和166 bp两条带,则可判定基因型为NN。当氟烷基因两个位点都发生突变(C1843→T1843)时,HhaI限制内切酶识别位点消失,659 bp扩增的片段不能被酶切消化,电泳后只有一条带,基因型为nn。当一个氟烷等位基因发生突变(C1843→T1843),而另一个正常,用HhaI酶切可以观察到659 bp、493 bp和166 bp 3条带,其基因型为Nn。
5 结论
猪应激综合征检测的传统方法是用氟烷麻醉法,但该方法不能识别杂合子和阴性猪,且操作误差较大。而通过提取DNA利用PCR-RLFP进行检测,可以100%地检测出纯合子和杂合子,这样就克服了用氟烷检测费时、费力而且不能测出杂合子的弊端。用血样和毛囊均能提取DNA,血样中DNA纯度更高,便于扩增但血样的采集要保定猪只,通常体重在30 kg以内的仔猪采用该法,对成年猪由于体重原因往往仅采用毛囊提取DNA。通过对种猪场的长白、大约克和杜洛克的检测发现,由于高瘦肉率种猪的大量引进使种猪群中氟烷基因频率明显增高,长白、大约克和杜洛克猪群都含有一定比例的氟烷应激基因。
种猪的遗传改良是猪群生产性能改良的基础,而种猪性能测定制度是猪遗传改良的重要技术措施和保证条件,因此,在种猪性能测定中,除使用现有的生长发育性能测定和外貌选择外,还要从种猪分子遗传结构方面进行性能测定,特别是对氟烷基因型的检测。张金玲等通过PCR-RFLP技术对嘉兴地区部分猪场新嘉兴黑猪血样进行氟烷基因检测,结果表明,37头新嘉兴黑猪基因型均为NN,未出现Nn和nn基因型[11]。及早进行检测具有可以及时淘汰隐性纯合子个体、在父母代选配上避开杂合子公猪和杂合子母猪的选配、在后备猪群中控制氟烷基因的存在。
[1]Knudson CM,MickeLson JR,Louis C F.Diction immunopeptide maps of the sarcoplasmic reticulum Ca2+reLease channel in malignant hyperpyrexia[J].Euro JPharmacology,1990,61:187-189.
[2]Fujii J.Detection of the HAL gene in swine:a pointmutation in the skeletalmuscle ryanodine receptor gene(RYR1)[J].JAnimal Genet,1993,21:56-61.
[3]袁子国,耿忠诚,靳锐,等.应用聚合酶链式反应(PCR)技术检测野猪的氟烷基因[J].黑龙江畜牧兽医,2005(5):14-16.
[4]蒋思文,吴桢方,熊远著.用聚合酶链反应技术鉴别猪的的氟烷基因型[J].华中农业大学学报,1995,14(5):472-476.
[5]NaKajima E,Matsumoto T,Yamada R,etal.Note:Use of a PCR-single strand conformation polymorphism(PCR-SSCP)for detection of a pointmutation in the ryanodine receptor(RYR1)gene[J].JAnim Sci,1996,74(12):2 904-2 906.
[6]刘锐,郁辉.嘉兴黑猪氟烷基因频率检测初报[J].安徽农业科学,2007,35(18):5 442.
[7]杜立新,王爱华,姜运良,等.猪RYRl基因的检测及其对生产性能的遗传效应[J].畜牧兽医学报,2001,32(6):481-486.
[8]姚国良,胡有根,黄元良,等.嘉兴黑猪新品系选育研究[J].养猪,2003(6):22-25.
[9]Fujii J,Qtsu K,Zorat F,et al.Identifaction ofmuation in porcine ryandine receptor associated with malignant hyperthermia[J].Science,1991,253:448-451.
[10]Otsu K,PhillipsM,Khanna V,et al.Refinement of diagnostic assays for a probable causalmutation for porcine and humanma-lignanthyperthermia[J].Genomics,1992,13:835-837.
[11]张金玲,吴海洪,钱永华,等.PCR-RFLP技术检测新嘉兴黑猪氟烷基因[J].中国畜牧兽医,2008,35(9):133-134.

