牛血液中及蜱吸血后血液中牛瑟氏泰勒虫基因组DNA含量及同源性比较
吕 舟
(吉林农业科技学院动物医学学院,吉林 吉林 132000)
牛瑟氏泰勒虫病是由泰勒科、泰勒属的瑟氏泰勒虫(Theileria.sergenti)寄生于牛体内引起的以高热、贫血、出血、消瘦和体表淋巴结肿大为主要临床症状的一种血液原虫病[1-2]。该病呈世界性分布,我国东北、西北、华北、华南等地区牛瑟氏泰勒虫感染情况较严重[3-7]。近年来,随着养牛业的发展,牛瑟氏泰勒虫病的发生呈上升趋势势尤其是引进牛和改良牛的发病率和致死率均较高,已成为严重威胁养牛业健康发展的重要疾病之一。
硬蜱(Ixoaldae)是家畜多种传染病和寄生虫病的传播者,特别对家畜血孢子虫病病原的传播起着重要作用[8]。该虫体寄生于牛、羊体表,吸食血液,引起家畜消瘦,更为严重的是,蜱是焦虫病、立克次氏体病等的传播者[9]。其中硬蜱隶属硬蜱科血蜱属的长角血蜱为牛瑟氏泰勒虫的传播媒介[10]。通过叮咬,将病牛的感染红细胞吸入,经蜱体内发育,再叮咬时,将正在分裂的焦虫注人另一宿主(病牛)体内,并继续吸入感染的红细胞[11]。针对蜱这一传播媒介,本试验对其DNA含量进行了分析,比较其与牛瑟氏泰勒虫基因组DNA含量及P33表面蛋白基因同源性,进一步证明其传播途径及确定含量关系,为焦虫病、立克次氏体病等病基因组DNA的提取提供理论基础。
1 材料和方法
1.1 病料及主要试剂
在牛瑟氏泰勒虫病的高峰期6~7月,于吉林省延边州珲春市某牧场采集样本。牛抗凝液及吸血后蜱对应在同一头牛身上被采集,每头做标记。DNA提取试剂盒、exTaq酶等均购自TaKaRa公司,其他试剂为分析纯。
1.2 涂片的制备
取血液样本涂片、自然干燥,滴加甲醇2~3滴,固定2~3min。将固定片浸于盛有姬姆萨染色液的染缸中染30min,然后水洗、干燥、显微镜观察。
1.3 引物的设计与合成
据GenBank(AF521557.1)上发表的牛瑟氏泰勒虫P33表面蛋白基因序列,应用Primer 5.0和Oligo 6.0软件设计特异性引物,引物由上海生工生物工程有限公司合成。引物序列为:P1:5-atgttgtccaagaaatcgtt-3′ ,P2:5-cagtattctactatctctag-3 ′,PCR扩增产物长度为852 bp。
1.4 牛瑟氏泰勒虫基因组DNA的提取及目的片段扩增
用DNA提取试剂盒提取基因组DNA。以其为模板,采用25μL PCR反应体系:10×PCR buffer 2.5μL, dNTP 2μL,P1、P2引物各1μL,模板DNA 2 μL,exTaq酶 0.25 μL,dH2O 16.25 μL。PCR反应条件为35个循环,94℃预变性5min,94℃ 45 s,55℃ 1min,72℃ 1min,72℃ 延伸10min。PCR产物用1%琼脂糖凝胶电泳检测。
1.5 紫外分光光度计法测DNA含量
将样品进行50倍稀释后,应用紫外分光光度计,在波长为260及280 nm下调零,并测定其OD值,依据测定结果计算其DNA浓度含量。
计算公式见式(1)

注:浓度单位为μg·mL-1。
1.6 同源性比较
将鉴定正确的PCR产物送上海生工生物工程有限公司测序,通过软件DNAMAN,对GenBank上登录的基因序列与牛瑟氏泰勒虫延边州分离株的两个样本的核苷酸序列进行同源性分析。
2 结 果
2.1 涂片镜检的结果
涂片镜检结果见图1。

图1 姬姆萨染色涂片镜检结果
由图1可见,镜检发现两种血液样本中红细胞形状大小不一,红细胞内有小型虫体,呈梨籽形和逗点形等形状,A图中虫体的染虫率约为15%,B图虫体的染虫率约为4%。可见蜱吸血后血液中牛瑟斯泰勒虫明显高于牛血液中染虫率。
2.2 PCR扩增结果
以两种牛瑟氏泰勒虫基因组DNA为模板,P1、P2为引物,经PCR扩增,琼脂糖凝胶电泳分析。PCR扩增结果见图2。
由图2可见,在852 bp扩增出特异性条带,并可明显看出蜱吸血后血液扩增条带比牛血液扩增条带清楚得多。与预期结果相一致。
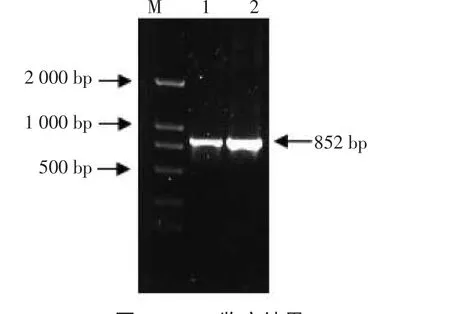
图2 PCR鉴定结果
2.3 紫外分光光度计法测DNA含量
透过紫外分光光度计测量后,经公式计算,结果在蜱吸血后血液DNA浓度为127 ug·mL-1,而牛血液中DNA浓度仅为52 ug·mL-1。结果显示蜱吸血后血液DNA浓度明显高于血液中DNA浓度。
2.4 同源性比较
测序结果表明,牛血液中和蜱吸血后血液中该基因序列同源性为100%。两者与GenBank上已发表的序列同源性为99%,由此可见该基因在蜱吸血后血液中和牛血液中具有相同的序列,进一步证明蜱是牛瑟氏泰勒虫病的传播媒介。


3 讨论
近年来,随着我国养牛业的发展和牛只的频繁运输,瑟氏泰勒虫病的发生呈上升趋势,且疫区发病率和致死率均较高,给畜牧业带来了较大的经济损失,引起了国内外兽医界的广泛关注。因此对瑟氏泰勒虫病的研究已迫在眉睫。蜱是瑟氏泰勒虫是传播媒介,已知能传播瑟氏泰勒虫蜱有长角血蜱(Haemaphysalis longicornis)、嗜群血蜱(H.concinna)和日本血蜱(H.japonica)3种,我国主要是长角血蜱。
DNA是主要的遗传物质,而遗传物质的基本功能是遗传信息的传递和表达,所以对DNA的来源及含量的测定有着极其重要的意义。本试验通过DNA试剂盒在牛血液中和蜱吸血后血液中分别提取出基因组DNA,通过DNA试剂盒法替代传统的乙醇沉淀法提取基因组DNA,可得到高质量的不含苯酚、氯仿、乙醇等化学试剂的基因组DNA,并尽可能避免在传统乙醇沉淀过程中因DNA沉淀不完全而导致的DNA损耗,获取最大量的基因组DNA。
通过姬姆萨染色法、PCR鉴定、紫外分光光度计法可初步判定蜱吸血后血液中基因组DNA要明显高于牛血液。测序结果表明,牛血液中和蜱吸血后血液中该基因序列同源性为100%。两者所得序列经BLAST对GenBank数据库中已发表的牛瑟氏泰勒虫P33主要表面蛋白基因序列进行同源性分析,结果为99.0%,这表明所扩增产物是P33蛋白基因序列,与预期结果相符。进一步证明蜱是牛瑟氏泰勒虫病的传播媒介。为今后牛瑟氏泰勒虫病的研究及对蜱这一传播媒介的深入探讨提供理论依据。
[1]许应天,张守发,李顺玉,等.牛瑟氏泰勒虫的诊断及预防研究进展[J].延边大学农学学报,1997,19(4):271-275.
[2]Minami T,Fujinaga T,Furuya K,etal.Clinico-hematol ogic and serological comparison of Japanese and Russian strains of Theileria sergenti[J].Natl Inst Anim Health Q.(Tokyo),1980,20(2):44-52.
[3]Kubota S,Sugimoto C,Onuma M.Population dynamics of Theileria sergenti in persistently infected cattle and vector ticksanalysed by a polymerase chain reaction[J].Parasitology,1996,112:437-442.
[4]Wang CT,Kubota S,Kakuda T,eta1.Survey of Theileripar-asite infection in catle in Taiwan[J].JVetMed Sci,1998,60(2):253-255.
[5]杨平等,刘洪恩,朱云德,等.乳牛瑟氏泰勒虫病调查研究报告[J].甘肃农业大学学报,1964(l):40-48.
[6]丁熙成,姜悦平,孙延鸣,等.自然条件下牛瑟氏泰勒虫的病理变化[J].中国兽医寄生虫病,1997,5(2):17-18.
[7]张守发,许应天,宋建臣,等.珲春市牛瑟氏泰勒虫病的调查研究[J].延边大学农学学报,1997,19(1):52-54.
[8]李春花.牛瑟氏泰勒虫P33表面蛋白基因的原核原表达[D].延吉:延边大学,2005.
[9]陈莉萍.牛羊的寄生虫病及防治措施[J].农技服务,2003(12):34-35.
[10]张守发,许应天,金河燮,等.图们江下游部分牧场硬蜱区系及生态特点调查[J].中国兽医科技,1998,28(11):18-19.
[11]张肖正.青岛市奶牛瑟氏泰勒焦虫病传播媒介—长角血蜱的调查分析[J].山东畜牧兽医,1996(3):12.

