MS-275联合低剂量顺铂对小鼠肝癌移植瘤生长抑制作用的研究
张海元,许光华,张 静 (长江大学医学院,湖北荆州434023)
顺铂 (cisplatin,DDP))是临床应用最为广泛的一种抗癌药物,通过顺铂对肿瘤细胞作用的分子生物学研究显示,铂类药物的主要作用机制是通过损伤DNA,使细胞进入G1期生长抑制,并诱导损伤严重的细胞进入凋亡状态[1]。但顺铂副作用较大,顺铂用量增大容易引起骨髓抑制及肾功能严重损害,另外顺铂使用剂量趋近于亚致死剂量时易引起耐药性,故临床上如何减小顺铂的细胞毒性和耐药性是目前面临的重要课题。MS-275属于苯甲酰胺类去乙酰酶 (HDAC)抑制剂,可上调p21基因的表达,对多个小鼠的人肿瘤模型都表现出强烈的抑瘤作用[2]。本课题拟采用低剂量的顺铂和MS-275联合应用,以探讨二者是否具有协同作用,是否能减少肝癌患者顺铂的使用剂量,降低顺铂对患者的毒副作用及耐药性。通过本项目的实施,有望获得全新的联合抗肿瘤药物治疗方案。
1 材料与方法
1.1 材料
H22肝癌细胞株由新加坡国立大学肿瘤研究所馈赠,小鼠腹水传代。6~8周龄健康小鼠40只,雌雄各半,体质量18~22g。DDP购于锦州九泰药业公司,MS-275购于德国Merck公司。
1.2 方法
1.2.1 荷瘤小鼠模型的建立 无菌操作,取H22小鼠腹水,台盼蓝染色,光镜下瘤细胞计数,活瘤细胞>90%,调整细胞浓度为5×106个/ml,分别取0.2ml于右腋皮下注射,制成实体型荷瘤鼠模型,2周后于小鼠右腋皮下形成H22肝癌细胞系移植瘤。
1.2.2 动物分组与治疗 40只荷瘤小鼠随机分成4组,即对照组 (生理盐水0.2ml)、MS-275组(2mg/kg)、DDP组 (10mg/kg)、联合治疗组 (MS-275+DDP组),每组10只。每组荷瘤小鼠分别进行腹腔内注射,每周2次,共2周。在最后一次注射治疗结束后第2周,用颈椎脱臼法处死荷瘤小鼠,观察各项指标。
1.2.3 瘤重称取及肿瘤抑制率的计算 小鼠处死后,分别取出肿瘤瘤体,剥离干净后,用滤纸擦拭干净,电子天平称取瘤重,并按公式计算抑瘤率:抑瘤率(%)=(1-实验组瘤重/对照组瘤重)×100%。
1.2.4 肿瘤组织细胞超微结构的电镜观察 切取上述各组小鼠肿瘤组织,分别经40g/L戊二醛及10g/L四氧化锇预固定和固定后,用乙醇及丙酮逐级脱水,环氧树脂包埋,制作0.5μ m厚薄切片,醋酸双氧铀及枸橼酸铅染色,利用透射电镜观察。
1.2.5 免疫组化检测 免疫组化染色采用SP法,参照SP免疫组化试剂盒说明书进行操作。切取小鼠肿瘤组织,用10%福尔马林固定,石蜡包埋并切片,检测移植瘤组织中半胱氨酸蛋白酶3(caspase-3)、血管内皮生长因子(VEGF)的表达及微血管密度 (MVD)的测定。在MVD的测定中,用CD31抗体标记微血管。
免疫组化结果判断:胞浆内棕黄色颗粒为caspase-3、VEGF、CD31阳性表达 (CD31抗体标记血管内皮细胞);微血管密度计算方法:棕黄色血管内皮细胞或细胞族代表一条单独微血管。
1.3 统计学分析
应用SPSS13.0软件进行数据处理,采用χ2分析检验。P<0.05为差异有统计学意义。
2 结 果
2.1 顺铂联合MS-275对肝癌移植瘤的抑制作用
联合治疗组 (MS-275+DDP)小鼠肿瘤生长明显受到抑制,移植瘤质量为(0.96±0.12)g,抑瘤率为66.8%;DDP组移植瘤质量为(1.52±0.19)g;MS-275组移植瘤质量为(1.65±0.25)g,而对照组移植瘤质量为(2.78±0.28)g。治疗组与对照组比较具有统计学差异 (P<0.05),联合治疗组 (MS-275+DDP)与MS-275组或DDP组比较差异具有统计学意义 (P<0.05)。
2.2 H22移植瘤超微结构的变化
透射电镜观察结果显示,对照组细胞坏死,但部分细胞结构完整,常染色质丰富;MS-275治疗组可见部分早期凋亡细胞;顺铂组可见细胞大量坏死,未见明显细胞凋亡指征;MS-275+顺铂联合治疗组可见凋亡小体,细胞质密度增高,染色质高度凝集固缩。
2.3 免疫组化检测结果
用免疫组化SP法检测各实验组肿瘤组织Caspase-3及VEGF蛋白表达水平,其中细胞浆着色成棕黄色为阳性表现。实验结果显示,各治疗组与对照组比较及联合治疗组与单独应用顺铂或MS-275治疗组比较,Caspase-3蛋白表达均具有统计学差异 (P<0.05);另外,各治疗组与对照组比较,VEGF蛋白表达明显下调,且均具有统计学差异 (P<0.05)。用CD31标记微血管密度 (MVD)的表达显示,治疗组与对照组比较及联合治疗组与单独应用顺铂或MS-275治疗组比较,均具有统计学差异 (P<0.05)。
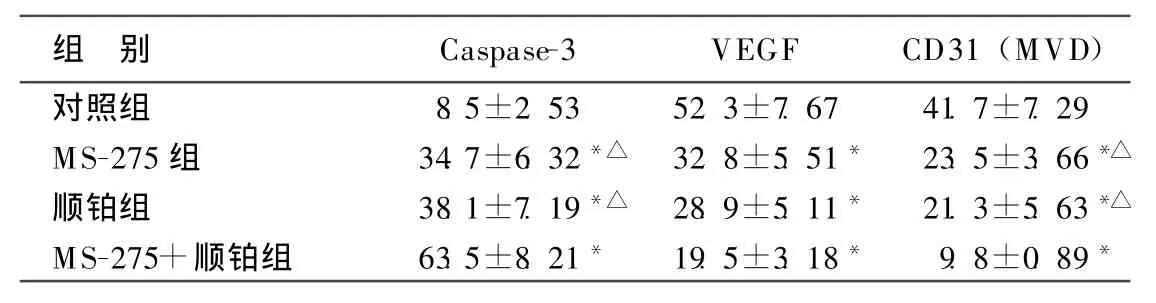
表1 各组Caspase、VEG F、CD31(MVD)蛋白表达水平 %
3 讨 论
肝细胞癌是常见的消化道恶性肿瘤,其发生是一个多因素、多阶段、多基因变异的积累过程。肝细胞癌的发生、发展不仅存在细胞增殖与分化的异常,也与细胞凋亡异常密切相关[3]。MS-275是一种较新的苯酰胺类组蛋白去乙酰酶抑制剂 (HDACIs),有诱导肿瘤细胞增殖阻滞、分化凋亡以及选择性地作用肿瘤细胞等抗癌活性。据报道[4-5],MS-275已被证实对白血病和实体瘤进行治疗,表现出良好的疗效,不良反应的发生率及发生程度均极低,这说明与传统的化疗药物相比HDACIs具有较大的优势。本课题组在前期的实验中证明MS-275在肝癌细胞系Hep3B中能诱导p21WAF1/CIP1表达,加速肿瘤细胞凋亡[6],并对多个小鼠的人肿瘤模型上都表现出强烈的抑瘤作用。Sato等[7]应用MS-275联合顺铂治疗口腔鳞状细胞癌,证实两类药物可通过不同途径作用于肿瘤细胞,具有协同作用,对化疗药物起到减毒增效的功效。研究表明[8],肝细胞癌的发生发展及细胞凋亡与肿瘤的新生血管生成程度密切相关,血管生成在肿瘤生长和转移中具有重要意义。肿瘤内血管生成受多种相关基因/蛋白的调控,它们共同调节肝细胞癌的生物学行为,其中血管内皮细胞生成因子在肿瘤血管生成中发挥主要作用。VEGF是由肿瘤细胞分泌,通过与血管内皮上的相应受体结合促进内皮细胞增殖,同时可增加血管通透性使内皮细胞迁移,诱导肿瘤血管生成,维持肿瘤的继续生长,是目前发现的最强烈的血管生成因子,与诸多生理及病理过程有关。而微血管密度被认为是能反映肿瘤血管生成的一个指标,能反映干细胞癌的侵润和转移能力,且与VEGF的表达呈正相关,被认为是一种新的肿瘤生物学特征[9]。故针对癌细胞凋亡或抑制癌内新生血管形成的治疗将成为抑制肝细胞癌生长的热点。
肝细胞癌发生发展过程中微环境的改变可以影响肿瘤细胞的凋亡状态,是通过激活一系列基因、启动各种机制而诱导肝癌细胞凋亡,其中Caspase蛋白起着极其重要的作用[10]。本研究通过在小鼠体内移植肝细胞癌,并分别采用化疗药物顺铂、组蛋白去乙酰化酶抑制剂MS-275及联合用药 (DDP+MS-275)等方法进行治疗,结果显示,联合治疗组小鼠肿瘤生长明显受到抑制,移植瘤质量为(0.96±0.12)g,抑瘤率达到66.8%,与顺铂治疗组和MS-275治疗组比较差异具有统计学意义,本实验结果说明化疗药物顺铂和MS-275联合应用在抑制干细胞癌瘤体生长和增加抑瘤率中都发挥明显疗效,明显抑制干细胞癌的增殖生长,起到明显的协同效应。在使用透射电镜观察移植瘤超微结构来看,联合治疗组可见凋亡小体,细胞质密度增高,染色质高度凝集固缩,相比于单独使用顺铂组或MS-275组而言,凋亡特征非常明显。用免疫组化SP法检测各实验组肿瘤组织Caspase-3蛋白表达水平,发现联合治疗组中Caspase-3表达明显上调,推测联合应用顺铂和MS-275治疗肝细胞癌移植瘤过程中,通过不同途径诱导肿瘤细胞凋亡并发挥协同作用可能是实现其对肝癌细胞抑制作用的机制之一。
肝细胞癌是恶性肿瘤,侵润和转移是其主要生物学特征,也是影响肝细胞癌患者治疗效果和预后的重要因素,而肝细胞癌内新生血管生成在肿瘤生长和转移中具有重要意义。本研究用免疫组化SP法检测各实验组肿瘤组织VEGF蛋白表达水平,实验结果显示,各治疗组与对照组比较,VEGF蛋白表达明显下调,且均具有统计学差异。另外,用CD31标记微血管密度 (MVD)的表达显示,治疗组与对照组比较及联合治疗组与单独应用顺铂或MS-275治疗组比较,均具有统计学差异 (P<0.05)。本研究结果说明,联合治疗组可通过明显下调VEGF蛋白表达,减少肿瘤细胞MVD,对小鼠移植肝细胞癌的发生发展有显著抑制作用。
通过本实验的研究,联合应用MS-275及化疗药物顺铂治疗小鼠肝细胞癌移植瘤,可能通过不同途径及机制作用于肝癌细胞,加速肿瘤细胞凋亡,并抑制肿瘤内新生血管形成,控制肝细胞癌的生长、侵润和转移,为肝细胞癌的治疗提供新的靶点和全新的联合用药方案。
[1]Siddik Z H.Cisplatin:mode of cy totoxic action and molecular basis of resistance[J].Lung Cancer,2002,38:217.
[2]Kasman L,Lu P,Voelkel-Johnson C.The histone deacetylase inhibitors depsipeptide and MS-275,enhance T RAIL gene therapy of LNCaP prostate cancer cells without adverse effects in normal prostate epithelial cells[J].Cancer Gene Ther,2007,14(3):327-334.
[3]Haurie V,Mé nard L,Nicou A,et al.Adenosine triphosphatase pontin is overexpressed in hepatocellular carcinoma and co regulated with reptin through a new posttranslational mechanism[J].Hepatology,2009,50(6):1871-1883.
[4]Sakajiri S,Kumagai T,Kawamata N,et al.Histone deacetylase inhibitors profoundly decrease proliferation of human ly mphoid cancer cell lines[J].Exp Hematol,2005,33(1):53-61.
[5]Garcia-Manero G,Issa J P.Histone deacetylase inhibitors:a review of their clinical status as antineoplastic agents[J].Cancer Invest,2005,23(7):635.
[6]Zhang H Y,Chen P,Bai S,et al.The Histone Deacetylase Inhibitor MS-275 Induces p21WAF1/CIP1 expression in Human Hep3B Hepatoma cells[J].Drug Development Research,2007,68(2):61-70.
[7]Sato T,Suzuki M,Sato Y,et al.Sequence-dependent interaction between cisplatin and histone deacetylase inhibito rs in human oral squamous cell carcinoma cells[J].Int J Oncol,2006,28(5):1233-1241.
[8]Huynh H Y,Ngo V C,Choo S P,et al.Sunitinib(SU TENT,SU11248)suppresses tumor growth and induces apoptosis in xenograft models of human hepatocellular carcinoma[J].Curr Cancer Drug T argets,2009,9(6):738-747.
[9]Aebersold D M,Burri P,Beer K T,et al.Expression of hypoxia-inducible factor-1alpha:a novel predictive and prognostic parameter in the radiotherapy of oropharyngeal cancer[J].Cancer Res,2001,61(7):2911-2916.
[10]Lee J,Lim K T.Apoptotic activity of ethanol ex tract from Styrax Japonica Siebold Zuccarini in HepG2 cells[J].J Ethnopharmacol,2010,131(1):210-215.

