垂穗披碱草ISSR反应体系的正交优化
刘新亮,德 英,赵来喜
(1.中国农业科学院草原研究所,内蒙古 呼和浩特 010010; 2.中国农业科学院研究生院,北京 100081)
垂穗披碱草(Elymusnutans)为禾本科(Gramineae)小麦族(Triticeae)披碱草属(Elymus)多年生疏丛型草本植物,又名钩头草、弯穗草[1],染色体组构成为StStYYHH(2n=42)[2]。国外主要分布于俄罗斯、土耳其、印度、蒙古等地,我国主要分布于西北、西南、华北地区[1]。垂穗披碱草根茎分蘖能力强,具有极强的抗寒性和抗旱性,能适应各种不同类型的土壤,滩地、沟谷、阴坡山麓地带到灌丛草甸和高山草甸均能生长。开花期前垂穗披碱草质地柔软,无刺毛、刚毛,无异味,为马、牛、羊喜食牧草,整个生长季节粗蛋白含量变化幅度较小,属中上等品质牧草[1-6],同时也是最具经济意义的草种[7-8]。简单序列重复区间(inter-simple sequence repeat,ISSR)是Zietkiewicz等[9]于1994年创建的以重复序列的单一引物为主要引物序列的PCR标记,它结合了SSR和RAPD的优点,主要特点是操作简单,遗传多态性高,重复性好,耗资少,模板DNA用量少。基于这些优点,ISSR分子标记已广泛应用于牧草种质资源鉴定、牧草遗传多样性与分类进化、DNA指纹图库的建立、亲缘关系分析、遗传图谱构建、分子标记辅助育种等方面的研究[10]。ISSR分子标记在披碱草属植物研究中的应用多见报道[11-12],而其在垂穗披碱草研究中应用相对较少。ISSR分子标记反应条件易受模板DNA、dNTPs、Mg2+、TaqDNA聚合酶、引物等因素的影响,ISSR扩增结果,若以单因素试验,难免忽视其互作效应,而正交试验能够分析各因素之间的内在规律,具有均衡分散、整齐可比和效应明确的优点,能较快地找到最优组合,找出影响扩增的主要因素和次要因素[13]。本研究利用正交试验设计,从模板DNA、dNTPs、Mg2+、TaqDNA聚合酶、引物5个因素4个水平,对垂穗披碱草ISSR-PCR反应体系进行优化,以期获得垂穗披碱草的最佳反应体系。
1 材料与方法
1.1材料 供试的17份试验材料由中国农业科学院草原研究所提供(表1),于2010年5月在温室育苗,待幼苗长到一定高度,采集嫩叶,置于-80℃保存备用。参考马啸[11]和祁娟[3]所用引物序列,由上海生工生物工程有限公司合成(表2)。PCR所用的dNTPs、Mg2+、TaqDNA聚合酶、10×buffer(不含Mg2+)均购自大连宝生物工程有限公司(TaKaRa)。
1.2方法
1.2.1DNA提取 采用改良过的CTAB法[14]提取基因组DNA,利用0.8%的琼脂糖凝胶电泳检测DNA质量,利用UNICO公司生产的UN 4802型紫外分光光度计检测DNA的浓度和DNA纯度,并将质量浓度稀释到30 ng/μL。
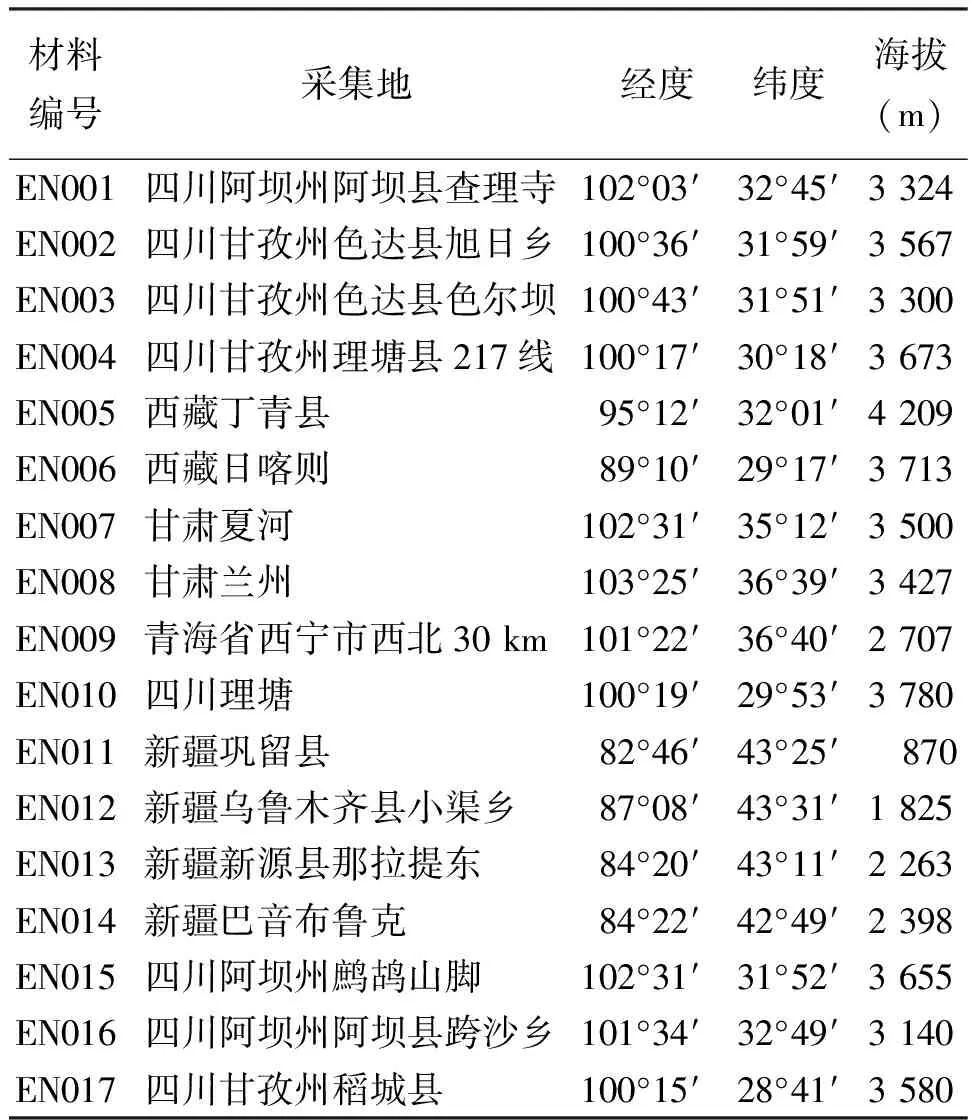
表1 试验所用垂穗披碱草材料
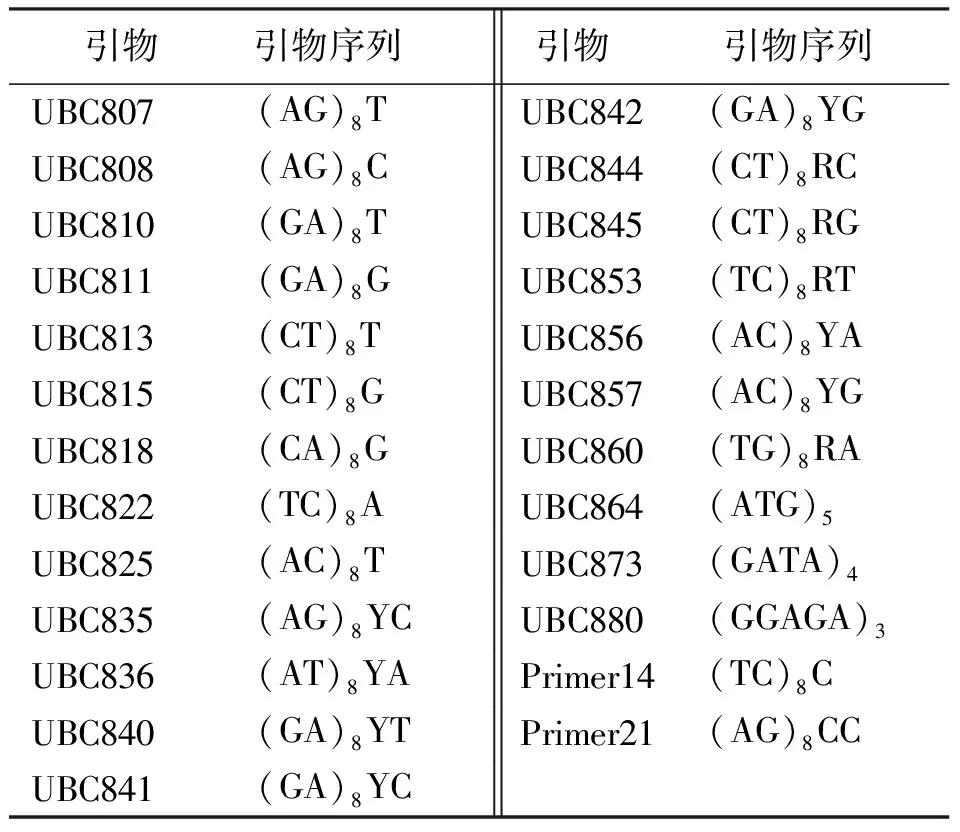
表2 试验所采用的引物序列
1.2.2ISSR-PCR反应体系的正交优化 以UBC822为试验引物,引物序列为(TC)8A,用EN001样品DNA作为模板,选用L16(45)正交表对Mg2+、Taq DNA聚合酶、模板DNA、dNTPs、引物5个因素各4个水平设计PCR扩增体系的因素-水平试验(表3)。
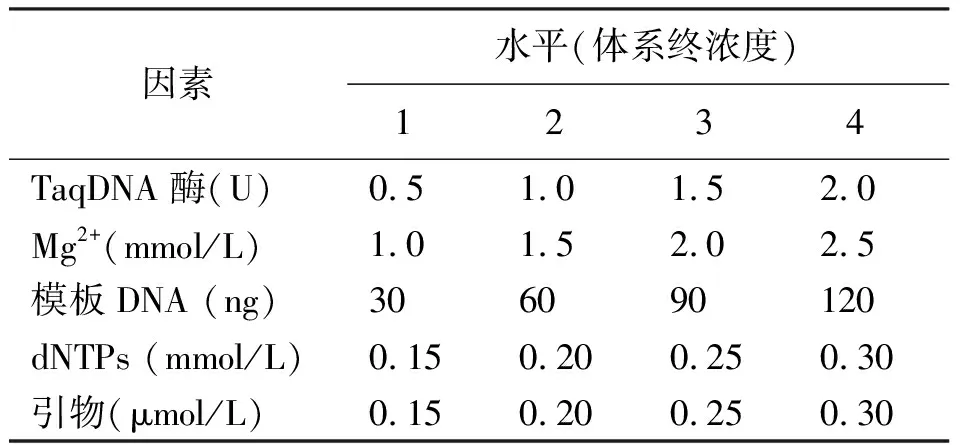
表3 ISSR-PCR体系的因素水平
将表4的处理重复2次,PCR反应体系总体积为25 μL,除表4所列变化因素外,每个组合中还含有10×buffer(不含Mg2+)2.5 μL,用ddH2O补充总体积至25 μL。
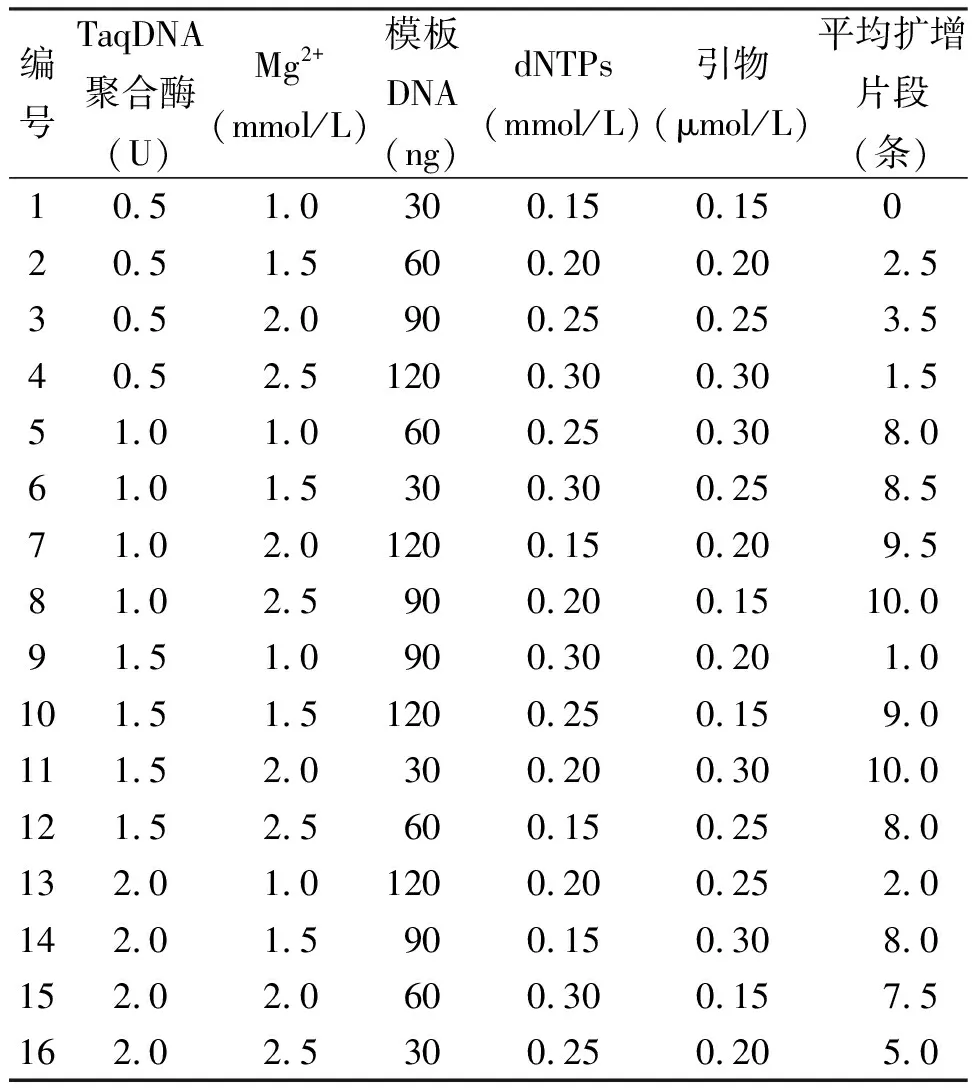
表4 ISSR-PCR正交试验数据表
1.2.3PCR扩增 PCR扩增反应是在DNAEngine(PTC-200)PCR仪上进行。PCR反应程序为:94℃预变性2 min,94℃变性1 min,51℃退火1 min,72℃延伸2 min,共40个循环,72℃延伸10 min,扩增完后4℃保存[11],用1.5%琼脂糖凝胶电泳检测,DL2000为Marker,在Bio-RAP凝胶成像系统成像。
1.2.4引物退火温度的确定 在试验最佳反应体系确定的基础上,在DNAEngine(PTC-200)PCR仪上进行最佳退火温度的筛选,从25条引物中筛选出多态性丰富的引物,根据理论退火温度对每个引物进行退火温度的梯度试验,设置8个梯度:47.7、49.2、51.5、54.4、57.8、60.6、62.8和64.4℃。
1.2.5循环次数、延伸时间的确定 利用最佳反应体系和最适退火温度对循环次数进行梯度试验,设定梯度为:35、37、39、41、43和45次,每个梯度2个重复;利用最佳反应体系、最适退火温度、最佳循环次数对体系延伸时间进行梯度试验,设60、90、120 s 3个梯度,每个梯度2个重复。
1.2.6最佳体系的验证 利用优化出的结果即最佳反应体系,引物的最适退火温度、最适循环数、最适延伸时间对试验材料进行验证,以提高优化体系的稳定性。
2 结果与分析
2.1DNA提取结果 通过紫外分光光度计检测,所提取的DNA OD260/OD280的比值为1.70~1.90,说明DNA纯度比较高,进一步通过0.8%的琼脂糖电泳检测(图1),得到清晰、无降解的条带,说明DNA完整性较好,可用于ISSR-PCR扩增反应。
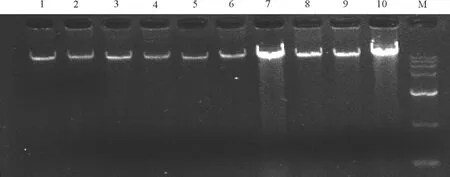
图1 CTAB法提取的垂穗披碱草基因组DNA
2.2正交试验的直观分析 垂穗披碱草正交试验的PCR产物电泳结果如图2,正交试验的结果不尽相同,原因可能是其组合与最佳组合组分相差较大。1~16组合扩增出的条带分别为:0、0;4、1;6、1;1、2;8、8;8、9;9、10;10、10;2、0;9、9;10、10;7、9;4、0;8、8;8、7;6、4。可以看出处理5、6、7、8、10、11、14、15扩增条带较多,而6、7、11、15主带更为清晰明显,因此这4个处理在垂穗披碱草中扩增效果最好。
从表5均值分析和表6的极差分析可知,各因素对垂穗披碱草ISSR-PCR反应的影响程度从大到小依次为:TaqDNA聚合酶、Mg2+、引物、dNTPs、模板DNA。
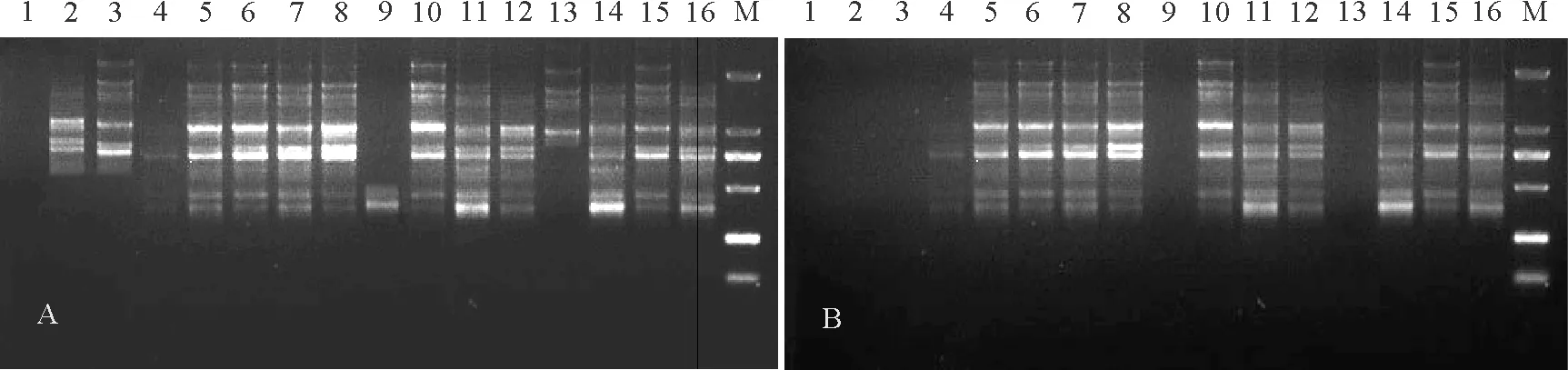
图2 正交试验PCR电泳产物(引物UBC822)
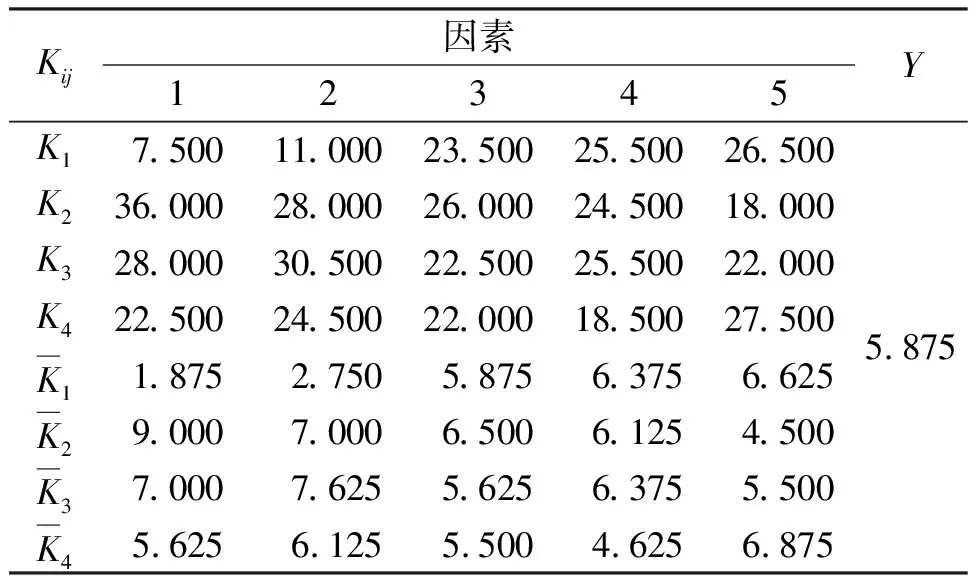
表5 因素水平均值分析
2.3方差分析 直观分析法比较简单易懂,只需对结果作少量计算,就可以得到最佳配合比和因素影响程度,但直观分析法不能正确估计试验过程中误差的大小,不能说明某因素水平所对应的差异究竟是因素水平引起的还是试验误差引起的,但是方差分析能弥补这个不足,本试验用SAS 8.0对试验结果进行方差分析。
各因素对垂穗披碱草ISSR-PCR反应的影响程度从大到小依次为:TaqDNA聚合酶、Mg2+、引物、dNTPs、模板DNA,结果与极差分析相同(表7)。
方差分析的结果表明,模板DNA浓度、dNTPs对结果的影响未达到显著水平;引物浓度对结果的影响达到了显著水平,而TaqDNA聚合酶、Mg2+对结果的影响都达到了极显著水平,所以有必要对TaqDNA聚合酶用量、Mg2+、引物浓度进行水平间的多重比较。
2.4各因素对ISSR-PCR扩增的影响
2.4.1TaqDNA聚合酶浓度对ISSR-PCR扩增的影响 TaqDNA聚合酶浓度在PCR中的用量受到反应体积、酶活性、酶耐热性等因素的制约,TaqDNA聚合酶用量过多会引起非特异性反应,在凝胶上出现较深的背景,影响检测结果,而且还会增加成本;TaqDNA聚合酶浓度过低,合成产物的量会减少,也会影响试验结果。极差分析和方差分析发现,本试验条件下TaqDNA聚合酶用量对试验结果影响最大,与谢运海等[16]的研究结果相似。当TaqDNA聚合酶用量为1.0 U时,垂穗披碱草扩增效果最好,高于或者低于此用量,扩增条带数变少(图3)。从图2可知,TaqDNA聚合酶为1.0 U时,条带最清晰,主带最明显,带数更多。经多重比较分析(图3),TaqDNA聚合酶酶量为1.0 U时,与0.5、1.5、2.0 U 3个水平间差异均达到显著水平。故本试验条件下,TaqDNA聚合酶的最适用量为1.0 U。
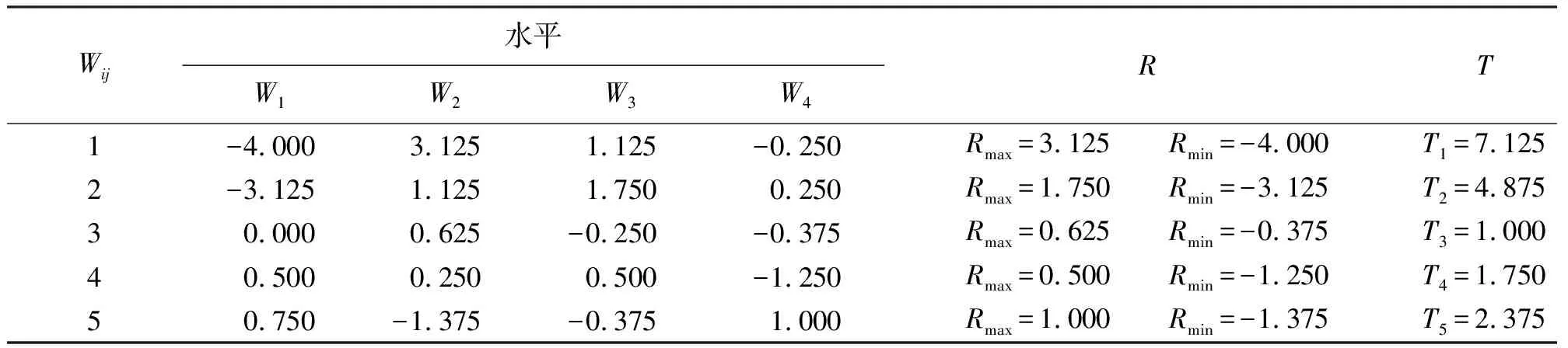
表6 因素水平极差分析
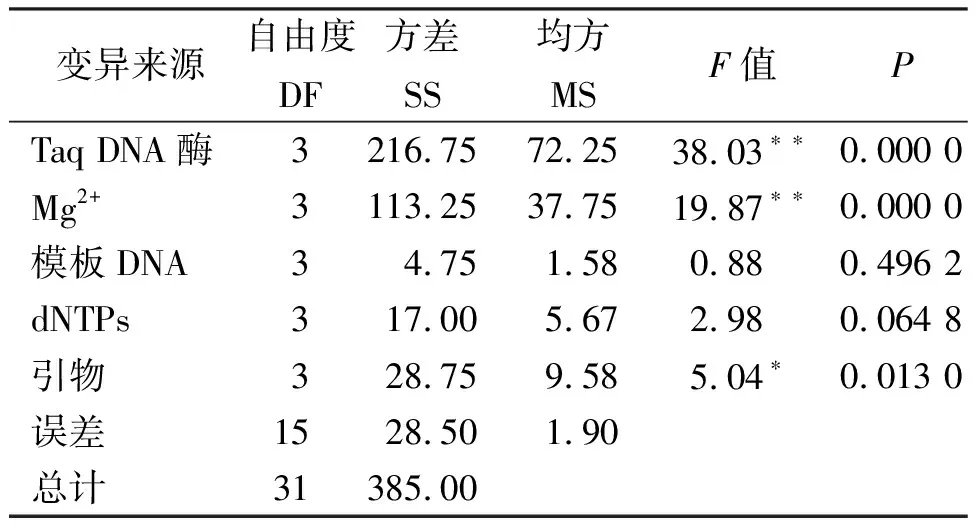
表7 正交试验方差分析
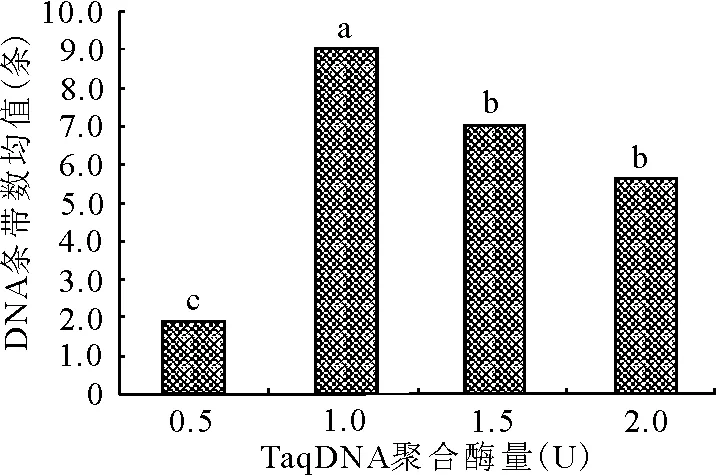
图3 不同TaqDNA聚合酶量下DNA条带数的均值
2.4.2Mg2+浓度对ISSR-PCR扩增的影响 TaqDNA聚合酶是Mg2+依赖性酶,对Mg2+浓度较为敏感,Mg2+浓度除影响酶活性外,还影响引物退火、模板与PCR产物的解链温度、引物二聚体的形成等[10],所以Mg2+的浓度对PCR产物的特异性和产量影响明显。过量的Mg2+会导致酶催化非特异性产物的扩增,而Mg2+浓度过低,又使酶的催化活性降低[17]。Mg2+浓度为1.0 mmol/L时扩增条带数最少,高于此浓度时,条带数明显增多,浓度为2.0 mmol/L时条带数最多(图4)。由图2可知,当Mg2+浓度为1.0 mmol/L时(1、5、9、13号泳道),只有1/4的泳道条带数较明显、清晰。多重比较表明(图4),Mg2+浓度为1.0 mmol/L时,DNA条带数显著低于其他3个水平,而其他3个水平间差异不显著。所以确定的Mg2+最适浓度为2.0 mmol/L。
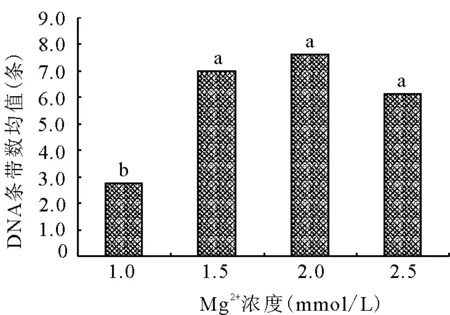
图4 Mg2+与条带均值关系
2.4.3引物浓度对ISSR-PCR扩增的影响 ISSR扩增条带数与引物浓度密切相关,引物浓度过低时,PCR产物量降低,引物浓度过高又会促进引物的错误引导,导致非特异性扩增,还会增加引物二聚体的形成[18],非特异性产物和引物二聚体又可作为PCR反应的底物,与靶序列竞争DNA聚合酶和dNTPs底物,从而使靶序列的扩增量减少[17]。当引物浓度为0.20 μmol/L时,扩增条带数最少,低于或高于此浓度,扩增条带数逐渐增加(图5)。多重分析表明,引物浓度为0.25 μmol/L时,与其他3个水平均有显著差异,且相对于其他水平,条带也更为清晰(图2),故确定引物浓度为0.25 μmol/L。
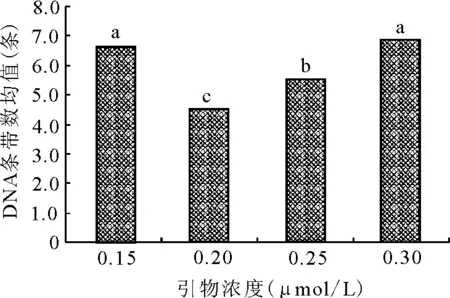
图5 引物浓度与条带均值关系
2.4.4dNTPs浓度对ISSR-PCR扩增的影响 dNTPs浓度直接影响PCR扩增,当dNTPs浓度较低时,产生的条带较少且弱,当dNTPs浓度过低时,其与TaqDNA聚合酶竞争Mg2+,从而降低TaqDNA聚合酶活性,影响PCR结果。dNTPs在0.15、0.20和0.25 mmol/L水平上差异不显著,三者显著高于0.30 mmol/L(图6),dNTPs 浓度为0.25 mmol/L时扩增条带最清晰(图2),主带最明显,当dNTPs 浓度为0.25 mmol/L时扩增条带最多。故该试验采用的最适dNTPs 浓度为0.25 mmol/L。
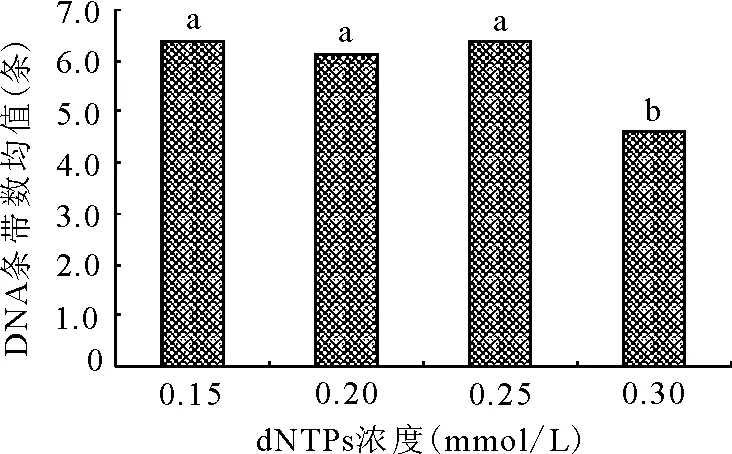
图6 dNTPs浓度与条带均值关系
2.4.5模板DNA浓度对ISSR-PCR扩增的影响 模板DNA是ISSR扩增的基础,主要从纯度和反应量产生影响,模板量过低,引物不能有效配对,产物量小,模板量过高则过早消耗掉引物,使退火发生在模板DNA间或PCR间,反应终止[19]。试验所选的4个水平的模板DNA浓度对PCR扩增结果影响差异不显著(图7),与白锦军等[19]结果不同,但与桂腾琴等[20]的研究结果相似,这可能是与模板DNA的纯度有关。本试验选取30~120 ng作为最佳模板质量。
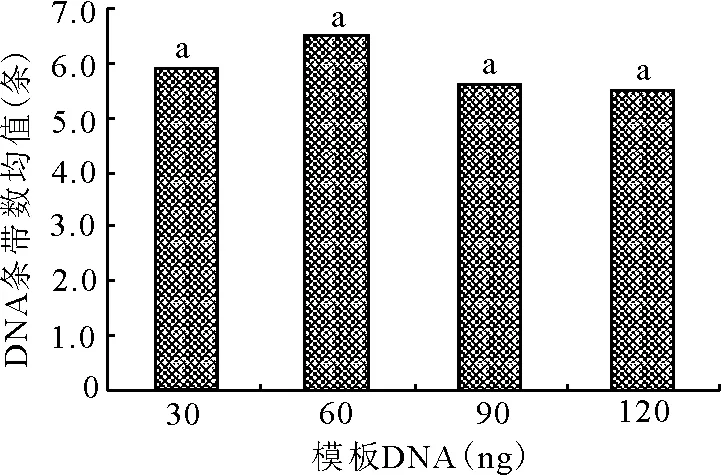
图7 模板DNA与条带均值关系
2.5退火温度的确定 退火温度决定着PCR的特异性。引物复性所需的温度和时间取决于引物碱基组成、长度,降低退火温度能保证模板与引物稳定结合,但也可能导致产生错误扩增,一定范围内提高退火温度可减少引物和模板之间的非特异性结合,提高PCR反应的特异性。根据正交试验结果所得的最佳反应体系,即TaqDNA聚合酶1.0 U,Mg2+2.0 mmol/L,模板DNA 30~120 ng,dNTPs 0.25 mmol/L,引物0.25 μmol/L在DNAEngine(PTC-200)PCR仪上进行退火温度梯度试验。由图8可知,退火温度较低时(47.7、49.2℃),扩增条带较弱,较弥散,条带不清晰,扩增条带特异性差,54.4℃时条带最清晰,条带数最多,主带最明显,随着退火温度的升高扩增的条带数减少,到60.6℃几乎没有条带,由此确定引物UBC822的最适退火温度为54.4℃。通过对筛选出的11条扩增稳定、多态性较好的引物进行了退火温度梯度试验,并确定了各引物的最佳退火温度(表8)。
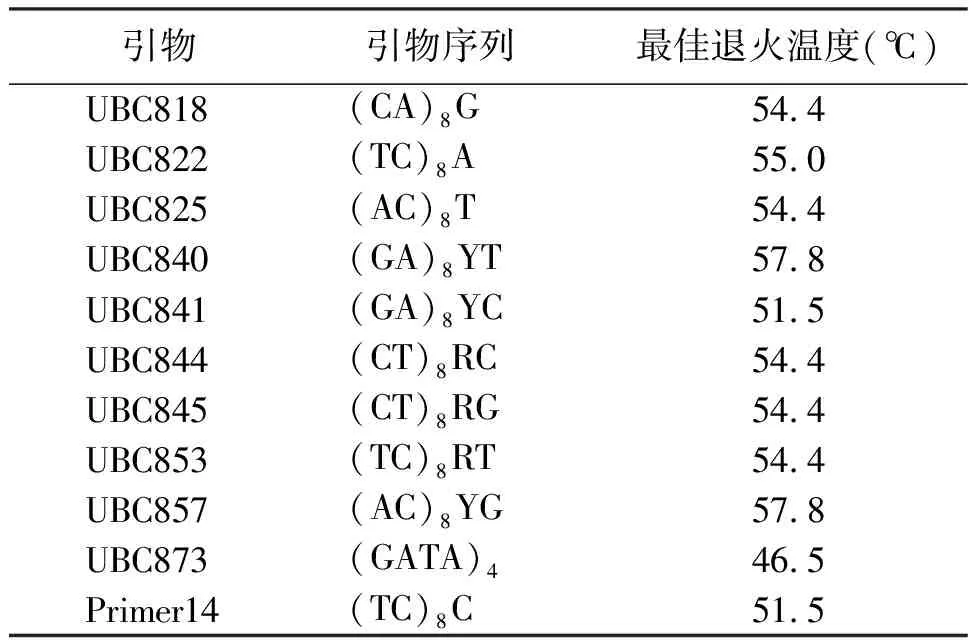
表8 试验所选引物序列和退火温度
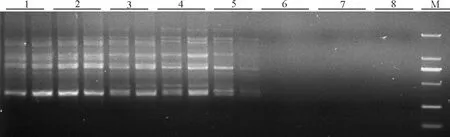
图8 温度梯度PCR电泳图
2.6最佳循环数和最适延伸时间的确定 根据正交试验结果所得的最佳反应体系,在最适退火温度下,对PCR循环数进行梯度试验,设置6个梯度。循环数较少时(35次)条带不清晰,扩增不稳定,37次时扩增条带逐渐变清晰,但其主带不明显,循环数为41次时扩增效果最好,循环数大于41次时,扩增结果也不理想(图9)。因此,41次作为引物UBC822的最佳循环次数。
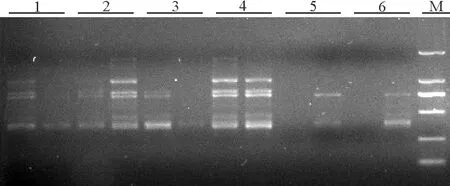
图9 最佳循环数的选择
延伸时间的长短取决于待扩增模板序列的长度和浓度,以及延伸温度的高低,在条件一定的情况下,延伸时间过短无法完成扩增导致扩增产量低,延伸时间太长会引起非特异性条带的产生[17]。利用最佳反应体系、最适退火温度和最佳循环数,对PCR延伸时间进行梯度试验,设置3个梯度。延伸时间为60 s时扩增条带弥散,延伸时间为120 s时主带不明显也带有一定的弥散现象,延伸时间为90 s时扩增效果最好(图10),故确定最适延伸时间为90 s。
2.7最佳反应体系的验证 运用正交设计所获得的最佳反应体系和程序随机选用引物UBC825对17份不同的野生垂穗披碱草进行ISSR扩增,结果显示,扩增条带清晰,稳定性好、多态性丰富(图11),表明该反应体系和反应程序稳定性、重复性较好,适合于垂穗披碱草进行ISSR-PCR反应。
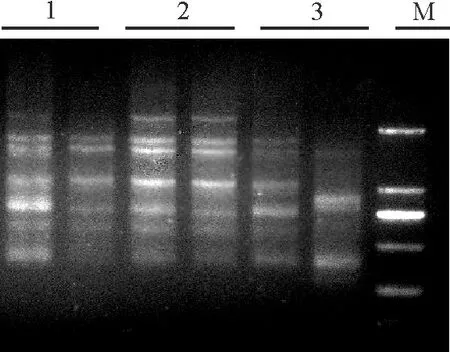
图10 最适延伸时间的选择
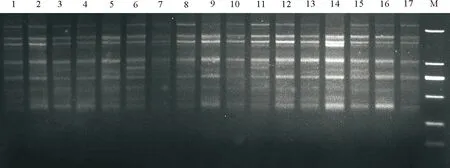
图11 最佳反应体系的验证
3 结论
本研究利用正交优化设计建立了垂穗披碱草的ISSR-PCR反应体系,试验过程中对影响PCR扩增的TaqDNA聚合酶、Mg2+、模板DNA、dNTPs、引物等因素进行了正交优化,对PCR程序进行了梯度试验,通过对扩增结果的量化分析得到了稳定性好的反应体系和扩增程序,即:TaqDNA聚合酶1.0 U,Mg2+2.0 mmol/L,模板DNA 30~120 ng,dNTPs 0.25 mmol/L,引物0.25 μmol/L;PCR扩增程序为:94℃预变性2 min,94℃变性1 min,51℃退火1 min(视不同引物而定),72℃延伸1.5 min,共41个循环,72℃后延伸10 min,扩增完后4℃保存。
正交设计相对于其他设计方法节省了人力和财力,对结果的分析更均衡更完善,但对扩增效果的评价方面带有一定的主观性,不能很好地评估各因素之间的交互作用,还需更客观的评价标准。此外,在正交优化中所设置的浓度梯度较大,可采用与单因素试验或细调性正交试验[21]相结合的方法进一步确定最优体系。尽管如此,本研究所建立的较为稳定的ISSR-PCR反应体系,可以为垂穗披碱草的研究提供科学的理论基础,同时为披碱草属内其他种在品种鉴定、遗传多样性研究、亲缘关系分析等领域提供一定的依据。
[1] 陈默君,贾慎修.中国饲用植物[M].北京:中国农业出版社,2002:119-120.
[2] 周永红,郑有良,杨俊良,等.10种披碱草属植物的RAPD分析及其系统学意义[J].植物分类学报,1999,37(5):425-432.
[3] 祁娟.披碱草属植物野生种质资源生态适应性研究[D].兰州:甘肃农业大学,2009.
[4] 陈智华,苗佳敏,钟金城,等.野生垂穗披碱草种质遗传多样性的SRAP研究[J].草业学报,2009,18(5):192-200.
[5] 马啸,周永红,于海清,等.野生垂穗披碱草种质的醇溶蛋白遗传多样性分析[J].遗传,2006,28(6):699-706.
[6] 严学兵.披碱草属植物遗传多样性研究[D].北京:中国农业大学, 2005.
[7] 刘蓉,张卫国,江小雷,等.垂穗披碱草群落退化演替的植被特性及其与土壤性状的相关性研究[J].草业科学,2010,27(10):96-103.
[8] 李治强.紫花苜蓿与垂穗披碱草混播防治褐斑病试验[J].草业科学,2009,26(10):177-180.
[9] Zietkiewicz E,Rafalske A,Labuda D.Genome fingerprinting by simple sequence repeat(SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20:176-183.
[10] 周延清.DNA分子标记技术在植物研究中的应用[M].北京:化学工业出版社,2005.
[11] 马啸.老芒麦野生种质资源的遗传多样性及群体遗传结构研究[D].雅安:四川农业大学,2006.
[12] 李永祥,袁庆华.披碱草属12个物种遗传多样性的ISSR和SSR比较分析[J].中国农业科学,2005,38(8):1522-1527.
[13] 盖钧益.试验统计方法[M].北京:中国农业出版社,2000:28-288.
[14] 李荣华,夏岩石,刘顺枝,等.改进的CTAB提取植物DNA方法[J].实验室研究与探索,2009,28(9):14-16.
[15] 董如何,肖必华,方永水.正交设计的理论分析方法及应用[J].安徽建筑工业学院学报(自然科学版),2004,12(6):103-106.
[16] 谢运海,夏德安,姜静,等.利用正交设计优化水曲柳ISSR-PCR反应体系[J].分子植物育种,2005,3(3):445-450.
[17] 屈伸,刘志国.分子生物学实验技术[M].北京:化学工业出版社,2007:80-86.
[18] Jackson J A,Hemken R W.Calcium and cation-anion balance effects on feed intake,body weight gain,and hunoral response of dairy calves[J].Journal of Dairy Science,1994,77:1430-1436.
[19] 白锦军,魏安智,王佳,等.仁用杏ISSR分析体系的正交优化[J].分子植物育种,2009 (6):1237-1244.
[20] 桂腾琴,孙敏,乔爱民,等.正交优化果梅ISSR反应体系[J].果树学报,2009,26(1):108-112.
[21] 陈志宏,黄琳凯,张新全,等.正交优化法建立沙打旺ISSR-PCR最佳反应体系[J].安徽农业科学,2006,34(13):2980-2982.

