瘤胃灌注大豆小肽对肉牛瘤胃发酵的影响
王文娟 万发春 杨维仁 宋恩亮 刘晓牧 谭秀文 刘桂芬
(1.山东农业大学动物科技学院,泰安 271018;2.山东省农业科学院畜牧兽医研究所,济南 250100;3.山东省畜禽疫病防治与繁育重点实验室,济南 250100)
瘤胃灌注大豆小肽对肉牛瘤胃发酵的影响
王文娟1,3万发春2,3杨维仁1*宋恩亮2,3刘晓牧2,3谭秀文2,3刘桂芬2,3
(1.山东农业大学动物科技学院,泰安 271018;2.山东省农业科学院畜牧兽医研究所,济南 250100;3.山东省畜禽疫病防治与繁育重点实验室,济南 250100)
本试验旨在探讨瘤胃灌注不同水平大豆小肽对肉牛瘤胃发酵指标和瘤胃微生物的影响。选用4头安装永久性瘤胃瘘管的鲁西黄牛阉牛,采用4×4拉丁方试验设计,分别瘤胃灌注0、100、200和300 g/d的大豆小肽。采集瘤胃液,测定瘤胃发酵指标,实时定量PCR法测定瘤胃微生物相对含量。结果表明,灌注大豆小肽对瘤胃液pH平均值无显著影响(P>0.05),显著提高了瘤胃液氨态氮(NH3-N)与微生物蛋白(MCP)平均浓度(P<0.05);灌注大豆小肽显著提高了瘤胃液总挥发性脂肪酸(TVFA)的浓度(P<0.05),与0 g/d组相比,200 g/d组和300 g/d组丙酸百分含量显著增加(P<0.05),100 g/d组和200 g/d组乙酸百分含量显著降低(P<0.05),300 g/d组丁酸含量显著降低(P<0.05);灌注大豆小肽显著降低了乙酸/丙酸(P<0.05);灌注小肽显著提高了瘤胃液中溶纤维丁酸弧菌含量(P<0.05)。可见,瘤胃灌注大豆小肽可促进MCP的合成、提高溶纤维丁酸弧菌的含量、改善瘤胃代谢。
大豆小肽;肉牛;瘤胃发酵;瘤胃微生物
小肽可被完整吸收[1]的观点提出后,肽营养已成为蛋白质代谢研究较为活跃的领域之一。近年来,小肽在畜禽特别是单胃动物生产中已得到广泛应用。提供非蛋白氮(NPN)对反刍动物的营养有着重要意义,其中铵盐和尿素由于成本较低被广泛应用,但需要注意添加量、能氮平衡与氮硫平衡等问题。与铵盐和尿素相比,小肽更有优势,研究表明,小肽能促进氨基酸的吸收,加快蛋白质的合成[2],提高畜禽生产性能[3-6],促进矿物质元素的吸收利用[5-6],提高动物免疫力。小肽是瘤胃微生物蛋白(MCP)合成的重要底物,对微生物区系的稳定发挥着重要的作用[8]。国内外,小肽对动物代谢影响的体内[6-8]和体外试验[8-11]研究已较多,但未见小肽对肉牛营养代谢研究的报道。本试验利用瘘管牛研究灌注不同数量的大豆小肽对肉牛瘤胃代谢的影响,旨在丰富肉牛特别是地方良种黄牛肽的营养理论。
1 材料和方法
1.1 试验材料
大豆小肽购自山东中食都庆生物技术有限公司,其总氨基酸和肽结合氨基酸组成见表1。
1.2 试验动物
选用4头体重(400±10)kg、30月龄安装有永久性瘤胃瘘管体况良好的鲁西黄牛为试验动物。
1.3 试验设计
采用4×4拉丁方设计,试验4个处理分别为灌注0、100、200、300 g/d大豆小肽。将小肽预先溶于1 000 m L 0.9%的生理盐水中,用4 mol/L盐酸调节pH至6.5。试验预试期10 d,正试期10 d,正试期开始每天07:00通过瘤胃瘘管匀速灌注小肽。

表1 大豆小肽总氨基酸和肽结合氨基酸组成Table 1 Composition of total am ino acids and peptide-bound am ino acids in soybean small peptides mg/g
1.4 基础饲粮与饲养管理
试验牛单槽饲养,试验采用定量饲喂,每日07:00和19:00饲喂2次,先精后粗,精粗比为4∶6,精饲料 1.6 kg/d,粗饲料为羊草 2.4 kg/d,喂后饮水。基础饲粮配制参照肉牛饲养标准(NY/T 815—2004),其组成及营养水平见表2。
1.5 样品采集
采样时间:正试期第8天(07:00、13:00、19:00、01:00)、第 9 天(09:00、15:00、21:00、03:00)、第 10 天(11:00、17:00、23:00、05:00),每时间点采集200 m L瘤胃液,待测瘤胃发酵指标。第10天07:00采集采集瘤胃液,-80℃保存,待测瘤胃微生物。
1.6 样品分析和检测方法
1.6.1 瘤胃液 pH、氨态氮(NH3-N)、MCP 和挥发性脂肪酸(VFA)的测定
瘤胃液经4层纱布过滤,立即采用便携式PHB-10型酸度计测定 pH,而后将样品分为3分:1分测NH3-N浓度,采用靛酚比色法[12];1分10 000×g离心10 m in,取上清按4∶1(上清液∶酸)加入25%偏磷酸静置30 min,然后20 000×g离心10 m in,取上清测定 VFA浓度,采用气相色谱法[13];1分 -20 ℃保存,备测 MCP浓度,采用嘌呤法[14]。

表2 基础饲粮组成及营养水平(风干基础)Table 2 Com position and nutrient levels of the basal diet(air-dry basis) %
1.6.2 瘤胃微生物的测定
1.6.2.1 瘤胃微生物总DNA的提取
采用反复冻融法提取瘤胃微生物DNA[15]。
1.6.2.2 实 时 定 量 PCR(real-time PCR,RTPCR)引物
引物设计参照 Khanfipour等[16]和 Denman等[17]的报道,由上海生物工程技术有限公司合成,序列及参数见表3。

表3 实时定量PCR引物序列及参数Table 3 Primer sequences and parameters for real-time PCR assay
1.6.2.3 反应体系和条件
以SYBR Prem ix ExTaqTM试剂建立20μL反应体系:预混合试剂(试剂盒中几种试剂按说明混合)10μL、上游和下游引物各0.15μL、DNA 模板1μL和双蒸去离子水8.7μL。采用 Roche 4500 real-time PCR systems(瑞士罗氏公司)进行PCR,反应条件为:1)95℃预变性30 s;2)95℃变性5 s,60℃退火和延伸20 s并采集荧光信号,40个循环;3)熔解曲线分析,65℃升至95℃,65℃保温20 s、95℃保温2 m in,自动采集荧光。
1.7 数据统计与分析
根据以下公式将目标菌的量表示为相对于总细菌量的百分比:
目标菌的量 =2-(Ct目标菌-Ct总菌)×100。
式中:Ct为阈值循环。
数据采用SAS 9.2软件包Mixed模型进行分析,均值采用Duncan氏法多重比较,结果以平均值表示,显著水平为P<0.05。
2 结果
2.1 灌注小肽对瘤胃液pH的影响
由表4可知,灌注大豆小肽对瘤胃液pH平均值无显著影响(P>0.05)。由图1可见,灌注不同水平小肽,各组瘤胃液pH变化趋势基本一致,均为晨饲前达到最大值,而后逐渐降低,6 h(13:00)后到最小值,之后又逐渐上升,晚饲后再逐渐降低。

表4 大豆小肽水平对瘤胃发酵指标的影响Table 4 Effects of soybean small peptides level on fermentation indices in the rumen

图1 大豆小肽水平对瘤胃液pH的影响Fig.1 Effects of soybean small peptides level on rum inal pH
2.2 灌注小肽对瘤胃液NH 3-N浓度的影响
由表4可知,灌注小肽显著增加瘤胃液NH3-N浓度(P<0.05),100 g/d组、200 g/d组和300 g/d组NH3-N浓度分别比0 g/d组增加了26.16%、35.43%和75.78%。由图2可见,各组 NH3-N浓度变化趋势相近,在晨饲后2 h(09:00)上升,之后开始下降,饲喂后6 h(13:00)达到最低,300 g/d组的峰值高于其他各组。
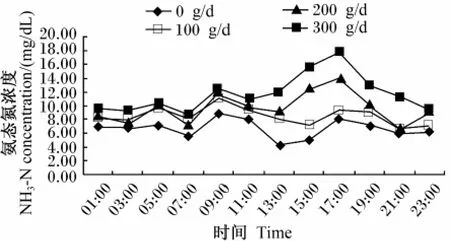
图2 大豆小肽水平对瘤胃液氨态氮浓度的影响Fig.2 Effects of soybean small peptides level on rum inal NH3-N concentration
2.3 灌注小肽对瘤胃液MCP浓度的影响
由表4可知,灌注大豆小肽能够显著增加瘤胃液 MCP的含量(P<0.05),100 g/d组、200 g/d组和300 g/d组MCP浓度分别比未灌注组提高了27.10%、31.30% 和 42.38%。由图 3 可见,瘤胃液MCP浓度在饲喂后0~4 h升高,在饲喂后6 h有转折点,不同组变化趋势不一致。
2.4 灌注小肽对瘤胃液VFA浓度及其组分的影响
由表5可知,灌注大豆小肽增加瘤胃液总挥发性脂肪酸(TVFA)浓度,且200 g/d组与300 g/d组显著高于0 g/d组(P<0.05);降低乙酸百分含量,100 g/d组与200 g/d组与0 g/d组差异显著(P<0.05);300 g/d组显著降低了丁酸百分含量(P<0.05),100 g/d组显著高于 0 g/d组(P<0.05);随着小肽灌注量的增加,乙酸/丙酸显著降低(P<0.05)。2.5 灌注小肽对瘤胃微生物的影响
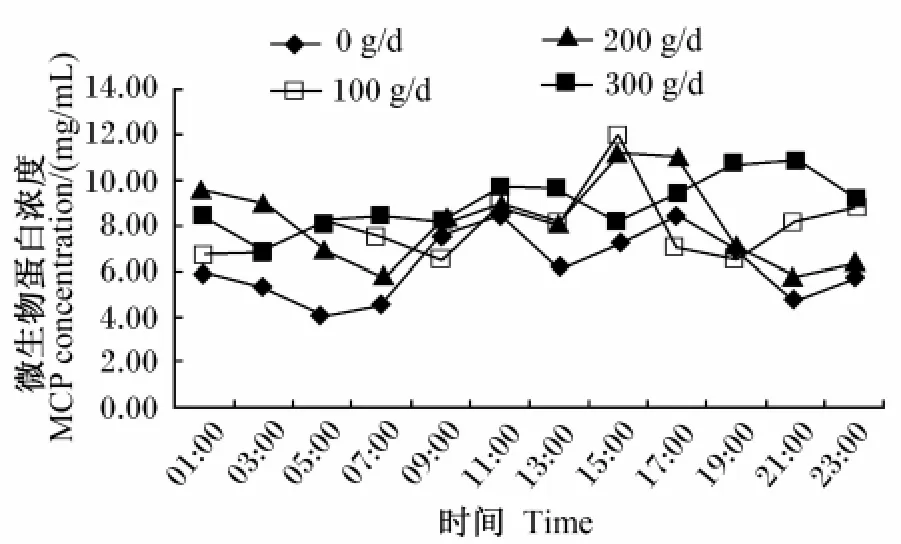
图3 大豆小肽水平对瘤胃液微生物蛋白浓度的影响Fig.3 Effects of soybean small peptides level on rum inal MCP concentration

表5 不同水平的大豆小肽对瘤胃液挥发性脂肪酸的影响Table 5 Effects of soybean small peptides level on VFA concentrations in rum inal liquid
由表6可知,灌注小肽增加了瘤胃液中溶纤维丁酸弧菌的相对含量,300 g/d组显著高于0 g/d组(P<0.05);对瘤胃普雷沃氏菌、瘤胃球菌、纤毛虫与牛链球菌的含量无显著影响(P>0.05)。

表6 大豆小肽水平对瘤胃微生物相对含量的影响Table 6 Effects of soybean small peptides level on relative contents of rumen m icrobes
3 讨论
3.1 大豆小肽对瘤胃液pH的影响
pH是衡量瘤胃发酵的重要指标,可综合反映瘤胃微生物、代谢产物、有机酸产生、吸收等状况。pH过低会导致能量损耗增加、微生物合成效率和氮沉积效率降低,研究发现当pH低于6.2,将会抑制瘤胃纤维素的消化[18]。本试验中各组试验牛瘤胃液pH在饲喂大豆小肽后8 h达到最低,之后逐渐上升,这与马宁等[10]试验结果相一致。本试验各组牛瘤胃液pH在6.17~6.89,均在正常的范围内变动,表明灌注小肽未影响瘤胃正常发酵。前人研究灌注试验较多采用连续饲喂方法[19-20],以维持瘤胃稳定性,但连续饲喂与正常饲养条件差异较大,且操作困难。本试验采用早晚饲喂,pH仅在灌注2 h后出现显著变化。动物采食饲料后,碳水化合物在瘤胃中发酵产生VFA的速度较快,数量较多,瘤胃中VFA浓度升高,导致pH下降,之后碳水化合物的发酵相对减慢,瘤胃上皮对VFA的吸收及流出的速度相对加快,因此虽然VFA增加,但pH不会出现显著变化。试验结果表明在正常饲养条件下进行,连续灌注试验是可行的。
3.2 大豆小肽对瘤胃液NH3-N浓度的影响
关于瘤胃微生物生长需要的NH3-N浓度的临界量,不同研究结果差异较大。适宜的NH3-N浓度是MCP合成效率的首要条件,有研究提出为6 ~30 mg/dL[21],也有研究认为是14 ~16 mg/dL,适宜浓度内微生物的效率最佳[22],A llen 等[23]则认为5 mg/dL就能足够维持微生物的最高生长率。本试验NH3-N浓度为6~20 mg/dL,且随灌注量的增加而增加。瘤胃内NH3-N的来源主要有3条途径:氨基酸的脱氨基作用;瘤胃内NPN转化而来;循环血液中的氨通过瘤胃壁渗入瘤胃液。马宁等[10]研究表明,瘤胃液在添加不同浓度肽体外培养的初期,NH3-N产生率最高,6~10 h后减弱。本试验在初期变化趋势与之相符,后期在减弱之后又有升高的趋势,可能是由于饲喂初期瘤胃发酵产生的氨较多,到后期采食的饲粮降解基本结束,而主要由灌注的小肽水解成的氨基酸脱氨基生成氨,使得NH3-N的浓度升高。Ipharraguerre等[24]发现提高饲粮的蛋白质含量会增加瘤胃液NH3-N的浓度,且与动物源蛋白质相比,大豆蛋白质能显著提高瘤胃液NH3-N浓度。李莉[18]体外试验也表明以大豆肽为氮源的培养液中NH3-N浓度高于其他试验组。本试验通过灌注大豆小肽取得类似的结果,提示灌注大豆小肽可提高肉牛瘤胃液的NH3-N浓度。
3.3 大豆小肽对瘤胃液MCP浓度的影响
反刍动物蛋白质需要量的60%~70%来自瘤胃MCP,而微生物的生长和合成效率受诸多因素的影响,如碳水化合物降解与瘤胃可降解蛋白质发酵的同步性、瘤胃可利用氮源和能量、微生物菌群、pH 和瘤胃外流速度等[25]。李琍等[26]指出对以粗饲料为主要饲粮的反刍动物,肽可能是瘤胃微生物生长的限制因子。Griswold等[27]利用体外试验发现,肽提供氨基氮能明显提高MCP的产量。王梦芝等[9]利用体外试验研究表明低聚肽对MCP的合成量显著高于培养液为氯化铵时MCP合成量。本试验MCP浓度显著提高,与上述研究结果相符合。大豆小肽在瘤胃中可被微生物直接利用合成MCP,使得瘤胃液MCP浓度增加,部分小肽水解为氨基酸,氨基酸经过脱氨基作用生成酮酸和氨。MCP浓度的增加,减少了氮再循环过程中的损失,提高微生物对氮源的利用率。瘤胃微生物对肽的利用也有浓度的限制,Fu等[25]研究提出,在体内试验中,瘤胃微生物达到最佳的生长和合成效率所需的肽浓度等于或是少于6.4 mmol/L,在体外试验中肽的浓度为 1.8~7.1 mmol/L。Jones等[11]发现在体外持续培养中,当肽替代尿素添加量为总氮的10%时,MCP的产量最高,但当超过10%时,MCP产量降低。本试验中,随着小肽灌注量的增加,MCP浓度增加,提示300 g/d的添加量没有超出临界范围。
3.4 大豆小肽对瘤胃液VFA浓度与组分的影响
VFA是反刍动物碳水化合物吸收的主要方式之一。试验中灌注小肽提高瘤胃碳水化合物的降解程度使得瘤胃液TVFA浓度增加,另外小肽水解产生的氨基酸脱氨基生成的碳架,经过转化形成的VFA,也可使VFA浓度增加,这也与瘤胃内VFA浓度和NH3-N浓度增加是相一致的。Griswold等[27]体外试验得到氮源为肽时VFA的产量显著高于氮源为尿素时。Jones等[11]体外试验表明,添加肽对TVFA的产量无显著影响,且试验组与0 g/d组相比,乙酸、丙酸、丁酸的百分含量均有不同程度的降低。Cruz等[8]研究表明绵羊瘤胃内灌注肽、氨基酸和尿素溶液,对瘤胃液VFA浓度无显著影响。本试验结果与之相反,可能是体内和体外试验差别所致。乙酸一般约占TVFA的70% ~75%,本试验结果在71% ~76%,与之相近。乙酸/丙酸与动物饲粮的组成以及精粗比有关,精饲料在瘤胃中的发酵率较高,产生的TVFA也较多,乙酸/丙酸较低,本试验中乙酸/丙酸与夏楠等[28]试验结果(豆粕型饲粮乙酸/丙酸为4.58,棉粕型饲粮为5.26)相近。乙酸/丙酸与能量转化效率相关,本试验乙酸/丙酸下降,表明丙酸的比例提高,能量的利用效率提高。
3.5 大豆小肽对瘤胃微生物的影响
瘤胃微生物的生长取决于以肽、氨基酸与氨形式存在的氮的可利用程度[29]。瘤胃球菌与溶纤维丁酸弧菌是瘤胃内主要的纤维分解菌。溶纤维丁酸弧菌、栖瘤胃普雷沃氏菌具有蛋白分解活性。纤毛虫是瘤胃内个体最大、数量最多、最重要的原虫。牛链球菌能降解淀粉,但不能降解纤维素,在瘤胃中的数量很少。
随着溶纤维丁酸弧菌的数量降低,纤维降解率降低[30]。试验采用RT-PCR测得的纤维素分解菌相对含量与前人研究的结果相近[31]。灌注大豆小肽提高溶纤维丁酸弧菌的含量,这与体外培养中添加肽提高纤维素分解菌的活力,显著提高纤维素的降解相一致[26-27]。肽的添加量会影响微生物的生长,适宜的肽添加量有利于纤维素的降解[11]。刘占英[32]研究不同氮源对瘤胃微生物的影响,结果表明肽能提高溶纤维丁酸弧菌的活性。Cruz等[8]研究表明绵羊瘤胃灌注肽有提高活菌数量的趋势,对原虫总数和纤维分解菌无明显影响,但在体外培养中,以纤维二糖为培养基时,肽和氨基酸促进了纤维分解菌的生长率,本试验中灌注肽对原虫的数量无影响,与上述结果相一致。肽对纤维素分解菌的影响在不同的研究中还存在分歧,这可能与体内试验与体外培养、培养的手段、培养时间、定量方法等有关,仍需进一步探讨。
4 结论
①瘤胃灌注300 g/d以内的大豆小肽,对瘤胃液pH不会造成显著性影响。
②瘤胃灌注大豆小肽提高了瘤胃液NH3-N浓度,增加MCP产量。
③瘤胃灌注大豆小肽增加了VFA产量,提高了能量利用效率。
④瘤胃灌注大豆小肽提高了瘤胃溶纤维丁酸弧菌的含量。
[1]NEWEY H,SMYTH D H.Intracellular hydrolysis of dipeptides during intestinal absorption[J].Journal of Physiology,1960,152:367-374.
[2]王玲,刘辉,李胜利,等.十二指肠灌注大豆小肽对奶山羊小肠肽吸收的影响[J].动物营养学报,2010,22(2):318 -326.
[3]PUCHALA R,PIERZYNOWSKI S G,WULIJI T,et al.Effects of small peptides or am ino acids infused to a perfused area of the skin of Angora goats on mohair growth[J].Journal of Animal Science,2002,80:1097-1104.
[4]曹志军,李胜利,丁志明.日粮中添加小肽对奶牛产奶性能影响的研究[J].饲料工业,2004(4):35-37.
[5]施用晖,乐国伟,左绍群,等.产蛋鸡日粮中添加酪蛋白肽对产蛋鸡性能及血浆肽和铁、锌含量的影响[J].四川农业大学学报,1996,14:46 -50.
[6]李丽立,陈宇光,谭支良,等.小肽对山羊氮平衡和营养物质消化率的影响[J].草业学报,2004,13(2):73-78.
[7]郭春燕.羊血水解小肽的制备及其对绵羊瘤胃氮代谢的影响[D].硕士学位论文.乌鲁木齐:新疆农业大学,2006.
[8]CRUZ S R,SAM IRAH M A,NEWBOLD C J,et al.Influence of peptides,am ino acids and urea on m icrobial activity in the rumen of sheep receiving grass hay and on the growth of rumen bacteriain vitro[J].Animal Feed Science and Technology,1994,49:151-161.
[9]王梦芝,喻礼怀,王洪荣,等.不同分子形式氮源对瘤胃微生物发酵及蛋白合成的影响[J].中国畜牧杂志,2010,46(5):20 -24.
[10]马宁,单安山,马清泉,等.不同浓度肽对瘤胃发酵及微生物蛋白产量的影响[J].中国畜牧杂志,2009,45(15):29 -32.
[11]JONES D F,HOOVER W H,M ILLER W T K.Effects of concentrations of peptides onm icrobialmetabolism in continuous culture[J].Journal of Animal Science,1998,76:611-616.
[12]ALBERT L C,EDWARD P M.Modified reagents for determ ination of urea and ammonia[J].Clinical Chem istry,1962,8(2):130-132.
[13]秦为琳.应用气相色谱法测定挥发性脂肪酸的研究改进[J].南京农业大学学报,1982(5):110-116.
[14]ZINN R A,OWENS F N.A rapid procedure for purinemeasurement and its use for estimating net rum inal protein synthesis[J].Canadian Journal of Animal Science,1986,66:157-166.
[15]ZHOU JZ,BRUNSM A,JAMESM.DNA Recovery from soils of diverse composition[J].Applied and environmental m icrobiology,1996(2):316-322.
[16]KHAFIPOUR E,LISC,PLAIZIER JC,et al.Rumen m icrobiome composition determ ined using two nutritionalmodels of subacute rum inal acidosis[J].Applied and Environmental Microbiology,2009,75(22):7115-7124.
[17]DENMAN S E,MCSWEENEY C S.Development of a real-time PCR assay for monitoring anaerobic fungal and cellulolytic bacterial populations within the rumen[J].Federation of European Microbiological Societies Microbiology Ecology,2006,58:572 -582.
[18]李莉.体外法研究肽对瘤胃液pH、氨氮浓度、菌体蛋白氮浓度、中性洗涤纤维降解率及其产气量的影响[D].博士学位论文.呼和浩特:内蒙古农业大学,2001.
[19]李海燕,徐凤霞,王中华.酪蛋白灌注水平对瘤胃蛋白质代谢的影响的研究[J].山东农业大学学报(自然科学版),2008,39(3):345 -349.
[20]PETERS JP,SHEN R Y,ROBINSON J A,et al.Disappearance and passage of propionic acid from the rumen of the beef steer[J].Journal of Animal Science,1990,68:3373-3349.
[21]BOWMAN J G,ASPLUND JM.Nitrogen utilization,rum inal fermentation and abomasalnitrogen flow in sheep fed Caucasian Bluestem hay supplemented with lucerne or urea[J].Animal Feed Science and Technology,1988,20(1):33-44.
[22]王加启,冯仰廉.日粮精粗比对瘤胃微生物合成效率的影响[J].畜牧兽医学报,1995,26(4):301-307.
[23]ALLEN S A,M ILLER E L.Determ ination of N requirement form icrobial growth from the effect of urea supplementation of a low N diet on abomasal N flow and N recycling in wethers and lambs[J].British Journal of Nutrition,1976,36:353.
[24]IPHARRAGUERRE R,CLARK JH,FREEMAN D E.Varying protein and starch in the diet of dairy cow s.I.Effects on rum inal fermentation and intestinal supply of nutrients[J].Journal of Dairy Science,2005,88:2537-2555.
[25]FU C J,FELTON E E,LEHMKUHLER JW,et al.Rum inal peptide concentration required to optim ize m icrobial growth and efficiency[J].Journal of Animal Science,2001,79:1305-1312.
[26]李琍,丁角力.肽对体外混合培养瘤胃微生物发酵和生长影响的研究[J].畜牧兽医学报,2000(2):113-119.
[27]GRISWOLD K E,M ILLER T K,HOOVER W H,et al.Effect of form of nitrogen on growth of rum inal m icrobes in continuous culture[J].Journal of Animal Science,1996,74:483-491.
[28]夏楠,赵国琦.不同蛋白质组成的日粮对瘤胃发酵及微生物蛋白质合成的影响[J].中国畜牧兽医,2009,36(7):11 -14.
[29]RUSSELL JB,O'CONNOR JD,FOX D G,et al.Net carbohydrate and protein system for evaluating cattle diets:I.Rum inal fermentation[J].Journal of Animal Science,1992,70(11):3551-3561.
[30]邓茂昌,胡代泽,朗家文,等.生态条件和瘤胃丛密度与纤维分解的关系[J].资源开发与市场,1997,13(2):55-57.
[31]王海荣.不同日粮精粗比及氮源对绵羊瘤胃纤维素降解菌群和纤维物质降解的影响[D].博士学位论文.呼和浩特:内蒙古农业大学,2007.
[32]刘占英.绵羊瘤胃主要纤维素降解细菌的分离鉴定及不同氮源对其纤维降解能力的影响[D].博士学位论文.呼和浩特:内蒙古农业大学,2008.
*Corresponding author,professor,E-mail:w ryang211@163.com
(编辑 王智航)
Infusion of Soybean Sm all Peptides into Rum en:Effects on Rum en Fermentation of Beef Cattle
WANG Wenjuan1,3WAN Fachun2,3YANGWeiren1*SONG Enliang2,3LIU Xiaomu2,3TAN Xiuwen2,3LIU Guifen2,3
(1.Department of Animal Science and Technology,Shandong Agricultral University,Taian271018,China;2.Insititute of Animal Science Veterinary Medicine,Shandong Academy of Agricultural Sciences,Jinan250100,China;3.Shandong Key Laboratory of Animal Disease Control and Breeding,Jinan250100,China)
The experiment was conducted to investigate the effects of infusion of different levels of soybean small peptides(SSP)on rumen fermentation and rumenm icrobes inLuxicattle.Four heads ofLuxicattle fixed with permanent rum inal cannula were used in a 4×4 Latin square design.Cattle were infused SSP by 0,100,200 and 300 g/d,respectively.Rum inal fluid was collected for the analysis of rumen fermentation indices,as well as the relative content of rumen m icrobes by real-time PCR.The results showed as follows:themean of rum inal pH was not significantly affected by SSP infusion(P>0.05),themeans of NH3-N and MCP concentrations were significantly increased(P<0.05);the concentration of total volatile fatty acid(TVFA)was significantly increased by SSP infusion(P>0.05),compared with those in 0 g/d group,the proportions of propionate in 200 g/d group and 300 g/d group were increased significantly(P<0.05),while the proportions of acetate in 100 g/d group and 200 g/d group,aswell as the proportions of butyrate in 300 g/d group were decreased significantly(P<0.05);the ratio of acetate to propionatewas significantly decreased by SSP infusion(P<0.05);the relative content ofButyrivibriofibrisolvenswas significantly increased by SSP infusion(P<0.05).In conclusion,infusion of SSP can promotem icrobial protein synthesis,increaseButyrivibriofibrisolvenscontent and improve rumen metabolism.[Chinese Journal of Animal Nutrition,2011,23(8):1324-1331]
soybean small peptides;beef cattle;rumen fermentation;rumen m icrobe
S 823;S816.4
A
1006-267X(2011)08-1324-08
10.3969/j.issn.1006-267x.2011.08.011
2011-03-07
项目来源:现代农业(肉牛)产业体系专项经费(MATS-Beef Cattle System)、公益性行业农业科研专项经费课题(nyhyzx07-036-01,nyhyzx07-036-05)
王文娟(1982—),女,山东东阿人,硕士研究生,从事动物营养研究。E-mail:wenjuan0705@163.com
*通讯作者:杨维仁,教授,硕士生导师,E-mail:w ryang@sdau.edu.cn

