白色链霉菌分批发酵ε-聚赖氨酸的动力学分析
钟 成,李文杰,贾士儒* ,范宝庆,王国良,郑竹琳
(1.教育部工业微生物重点实验室(天津科技大学),天津300457;2.天津科技大学生物工程学院,天津300457)
ε-聚-L-赖氨酸(ε-poly-L-lysine,简写 ε-PL)是由25~35个单体 L-赖氨酸通过 α-羧基和 ε-氨基通过酰胺键依次连接而成的阳离子型的天然氨基酸聚合物。最早由 Shima和 Sakai在筛选与Dragendorff试剂呈阳性反应的物质时偶然发现,是由白色链霉菌346分泌的一种胞外物质[1-2]。在酸性和微酸性环境中 ε-聚赖氨酸对革兰氏阳性菌、革兰氏阴性菌、酵母菌和霉菌均具有一定的抑制作用,而且其水溶性好、热稳定性高、可降解、可食用,对人体和环境无毒。因此它和它的衍生物由于其广泛的工业应用(如食品,医药,环境和电子技术),在过去几年里已引起了人们广泛的兴趣。ε-PL和它的衍生物有多种不同的应用,如作为食品防腐剂、乳化剂、食疗剂、可降解纤维、可高度吸水的凝胶、药物载体、抗癌剂增强因子和生物芯片。1989年日本批准其用于食品加工中,此后,韩国和美国也陆续批准其作用食品添加剂[3]。
自发现白色链霉菌Lysinopolymerus strain 346以来,人们针对ε-PL生产菌株的发酵过程与发酵条件进行了大量的优化,以提高ε-PL的最终产量。如Shima等[1,4]采用了 2 步培养的方法,先将菌体 S.albulus接种于20 g/L甘油,5 g/L酵母浸膏的种子培养基中,培养24 h,温度30℃;然后通过过滤收集菌体,将富集菌体移入含20 g/L葡萄糖、20 g/L柠檬酸和10 g/L(NH4)2SO4的发酵培养基中培养。通过2步培养的方法,8~9 d后ε-PL的发酵产量可达4~5 g/L。Kahar等[5]通过 pH值的调控来调节菌体的生长和 ε-聚赖氨酸的产量,采用菌株 S.albulus 410在5 L机械搅拌发酵罐发酵,培养基为M3G,通过半连续发酵培养,在消耗大量能量的前提下采用pH值来控制。试验过程分为2个阶段,在前期菌体生长阶段控制发酵液的pH值大于5.0,在后期ε-聚赖氨酸合成阶段发酵液 pH值控制在4.0左右。通过这一半连续培养后发现,ε-PL产量由原先5.2 g/L上升到48.3 g/L。
在微生物发酵过程的研究中,实现发酵过程优化与控制是发酵过程的重要目标和研究热点。通过菌株选育得到高产菌株,并通过发酵过程的优化控制,可以最大限度地发挥菌株的生产潜力。本研究考察了白色链霉菌分批发酵生产ε-聚赖氨酸过程的生长动力学,并建立了菌株生长动力学模型,对模型的动力学参数进行了求解,为发酵过程的优化与控制提供了理论基础。
1 材料与方法
1.1 菌种与培养方法
白色链霉菌UV80(Streptomyces UV80)由天津科技大学生化工程研究室保藏[6]。斜面培养:取4℃冰箱中保存的菌种,接种至斜面培养基中,30℃恒温培养5~7 d至长满灰色孢子。一级摇瓶种子培养:取一环斜面菌体接入装有100 mL种子培养基的500 mL三角瓶中,30℃,220 r/min,旋转式摇床培养一定的时间。二级摇瓶种子培养:以体积分数为10%的接种量将一级种子培养液接入装有90 mL种子培养基的500 mL三角瓶中,30℃,220 r/min,旋转式摇床培养一定的时间。发酵罐培养:贝朗5 L发酵罐。初始pH值为6.8,初始糖质量浓度50 g/L,温度30℃,通风量1~2 vvm(vvm即通气比,每分钟通气量与罐体实际料液体积的比值),控制DO 30%(搅拌转速为300~1 000 r/min)。
1.2 分析方法
菌体干重采用烘干法测量。滤纸预先于烘箱95℃烘至恒重,取10 mL发酵液,在4 000 r/min条件下离心8 min,沉淀用无菌水洗涤2~3次,滤纸过滤,将滤纸和菌体在烘箱中95℃干燥至恒重,计算菌体干重。残糖分析采用取10 mL发酵液,4 000 r/min,离心 8 min,取上清液,使用 SBA-40C生物传感分析仪(山东省科学院微生物研究所)测定发酵液中的葡萄糖浓度。
发酵液经初步预处理、离心分离、D392大孔径弱碱性阴离子交换树脂、D152大孔径弱酸性阳离子交换树脂以及乙醇沉淀和喷雾干燥,得到ε-聚赖氨酸。ε-聚赖氨酸的含量采用高效液相色谱法测量[7]。其色谱条件为:色谱柱为 TSKgel ODS-120T,φ4.6 mm×25 cm。采用紫外分光检测器,检测波长为215 nm。柱温40℃。将磷酸氢二钾1.70 g和硫酸钠1.42 g溶于800 mL水中,用磷酸调 pH值至3.4后用水定容至1 000 mL,之后取此溶液920 mL加入80 mL乙腈作为流动相。采用 L-苯丙氨酸作为内标,进样量为 20 μL。
2 结果与讨论
2.1 白色链霉菌分批发酵生产 ε-聚赖氨酸的生长动力学分析
图1~图3为5 L发酵罐分批发酵生产 ε-聚赖氨酸过程的底物消耗、菌体生长以及产物生成的变化曲线。图 1~图 3中,矩形为实测值,实线为Sigmoid模型拟合的曲线。

图1 底物浓度随时间的变化情况Fig.1 Changes of substrate concentration over time
由图1可以看出,菌体在8~32 h耗糖速度迅速加快,之后耗糖速度缓慢下降,发酵结束时,发酵液残留葡萄糖浓度为38 g/L。图2表明菌体在8~24 h内长较快,于32 h时到最大值,此时细胞干重(DCW)为5.75 g/L,随着发酵的继续进行,菌体量缓慢下降。由图3可见,当白色链霉菌生长到一定阶段,ε-聚赖氨酸才开始在发酵液中积累,可能是细胞生长与产物形成存在部分偶联关系,ε-聚赖氨酸在8~48 h大量合成并于48 h达到最大值,即0.9 g/L。

图2 菌体量随时间的变化情况Fig.2 Changes of biomass growth over time

图3 ε-聚赖氨酸随时间的变化的情况Fig.3 Changes of ε-pL production over time
2.2 ε-聚赖氨酸分批发酵生产 ε-聚赖氨酸的Sigmoid模型
由于微生物本身代谢生长的复杂性,要建立它们的结构生长模型非常的复杂。因此实际过程当中,经常用到经验和半经验但没有明确生物学意义的数学方程来描绘其生长规律,其中常用的方程如Monod以及 Logistic模型等[8]。Sigmoid模型在工程领域中常用来拟合“S”形曲线,其对应的函数(Boltzmann函数)如方程(1)所示。
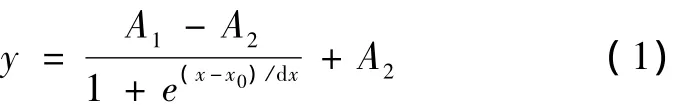
运用Sigmoid模型对ε-聚赖氨酸发酵过程的生物量、残糖、产物浓度进行拟合,如图1,图2和图3中实线所示。
由图1可知,模型预测值(实线)基本上能够较好地吻合试验所测值(矩形),表明 Sigmoid模型在白色链霉菌生长规律方面有较好的适应性。生物量、残糖、ε-聚赖氨酸经 Sigmoid模型拟合后的数学方程见式(2)~式(4)。
Sigmoid模型拟合菌体生长动力学方程为

Sigmoid模型拟合产物形成动力学方程为

Sigmoid模型拟合底物消耗动力学方程为

2.3 动力学参数求解
细胞比生长速率(μ)、葡萄糖比消耗速率(qs)和ε-聚赖氨酸比合成速率(qε-pl)定义式分别为:

当时间间隔很小时,可以近似用式(6)直接计算得到 μ,qs,qε-pl。
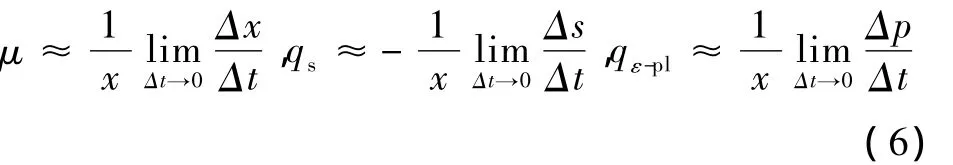
利用Origin绘图软件对试验数据进行插值计算(时间间隔0.1 h),再用Excel软件求解得到发酵不同时刻的 μ、qs和 qε-pl,经 Origin 软件绘图后平滑处理得到不同时刻白色链霉菌生产 ε-聚赖氨酸过程动力学参数变化曲线[9-10],见图 4。
图4表明细胞比生长速率在5.8 h达到最大值,为0.263 55 h-1;葡萄糖比消耗速率在12 h达到一个最大值,为0.004 326 h-1,之后到 30 h以后,它的值随着时间的延长,不断地增加;此时可以看出底物的消耗主要用于ε-聚赖氨酸的合成,ε-聚赖氨酸比合成速率在 36 h达到最大值,为0.008 88 h-1。另外,由图4可知,ε-聚赖氨酸的合成与细胞的生长呈现复杂的部分偶联关系,符合 Luedeking-Piret方程,通过回归分析可得ε-聚赖氨酸的合成与细胞生长的偶联系数关系式。

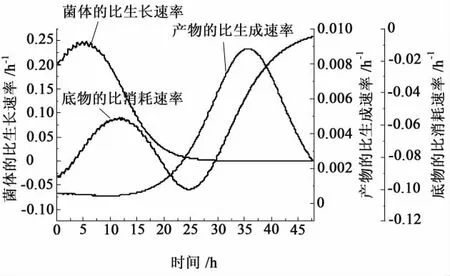
图4 ε-聚赖氨酸发酵过程细胞比生长速率(μ)、葡萄糖比消耗速率(qs)、ε-PL的比合成速率(qε-pL)随时间的变化曲线Fig.4 Changes of specific growth rate(μ),specific glucose consumption rate(qs),specific ε-pL production rate(qε|pL)over time during ε-pL fermentation process
2.4 ε-聚赖氨酸发酵过程中得率的变化
相应的,根据式(8)可计算得到发酵过程中细胞对葡萄糖的得率(Yx/s),ε-聚赖氨酸对葡萄糖的得率 Yε-pl/s随时间的变化曲线。
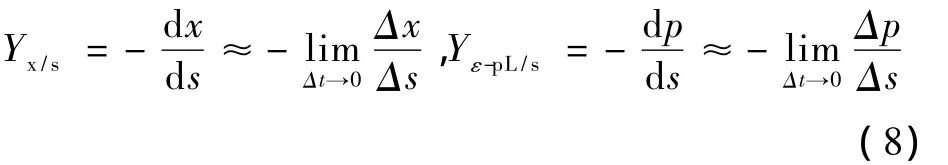

图5 ε-聚赖氨酸发酵过程中细胞对葡萄糖的得率(Yx/s)、ε-聚赖氨酸对葡萄糖的得率 Yε-pl/s随时间的变化曲线Fig.5 Changes of Yx/s,Yε-pL/sover time during ε-pL fermentation process
对底物的得率系数表征菌体摄取底物用于自身生长或代谢产物合成的能力[11]。图5中菌体对葡萄糖的得率系数随发酵时间的延长先升高后逐渐降低,表明前期细胞代谢底物主要用于菌体自身的生长,而ε-聚赖氨酸的得率系数随着时间的延长逐渐的升高,在发酵停止时仍有升高的趋向,即为0.5 g/g,表明在发酵后期菌体利用葡萄糖合成 ε-聚赖氨酸的能力在增强,并且逐渐增加。
3 结论
通过对ε-聚赖氨酸分批发酵过程进行分析,运用Sigmoid模型拟合得出底物消耗、菌体生长和产物形成的动力学方程,并对发酵过程当中的一些参数进行了动力学分析,模拟结果与试验数据具有很好的相关性,研究为ε-聚赖氨酸生产的分批发酵法和补料分批发酵法提供了重要的理论依据。
参考文献:
[1]SHIMA S,SAKAIH.Poly-L L-lysineproduced by Streptomyces,Part II Taxonomy and fermentation studies[J].Agric Biol Chem,1981,45:2 497 -2 502
[2]贾士儒.生物防腐剂[M].北京:中国轻工业出版社,2009
[3]SHIH I L,SHEN M H,VAN Y T.Microbial synthesis of poly(ε-lysine)and its various applications[J].Bioresource Technology,2006,97(9):1 148-1 159
[4]SHIMA S,OSHIMA S,SAKAI H.Biosynthesis of εpoly-L-lysine by washed mycelium ofStreptomyces albulus No-346[J].Nippon Nogeikagaku Kaishi,1983,57:221-226
[5]KAHAR P,IWATA T,HIRAKI J,et al.Enhancement ε-poly-lysine production by Streptomyces albulus strain 410 using pH control[J].Biosci Bioeng,2001,91:190-194
[6]JIA S, FAN B,DAIY,etal. Fractionationand characterization of ε-poly-L-lysine from Streptomyces albulusCGMCC 1986[J]. Food Science and Biotechnol,2010,19:361 -366
[7]日本健康劳动福利部.日本添加剂433002 ε-ポリリシン[S].日本,1992
[8]徐 鹏,钱 竹,董 亮,等.灵芝深层发酵生产胞外多糖和灵芝酸的动力学分析[J].应用与环境生物学报,2008,14(4):562-565
[9]吴 静,章克昌.基于动力学分析提高黑木耳多糖产量的pH控制策略[J].应用与环境生物学报,2006,12(6):783-787
[10]卫功元,李 寅,堵国成,等.温度对谷胱甘肽分批发酵的影响及动力学模型[J].生物工程学报,2003,3(19):358-363

