猪肉乳化香肠中大豆分离蛋白的检测
杨 勇,周小平,秦 丹,程 燕
(四川农业大学食品学院,四川 雅安 625014)
猪肉乳化香肠中大豆分离蛋白的检测
杨 勇,周小平,秦 丹,程 燕
(四川农业大学食品学院,四川 雅安 625014)
通过聚丙烯酰胺凝胶电泳法(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳检测猪肉乳化香肠中的大豆分离蛋白(soybean protein isolate,SPI)。结果显示,大豆蛋白主要有5条蛋白条带(β-大豆伴球蛋白中的d1、α'、β、d2亚基和大豆球蛋白的d3亚基) 能和猪肉的蛋白条带区分开;其中,获得了由α'亚基蛋白条带的光强度值与SPI质量分数计算得到的一个线性回归方程,该方程作为检测猪肉乳化香肠中SPI添加量(0.5%~10%)的标准曲线。应用得到的标准曲线预测已知SPI质量分数(7%、3%、1.5%、0.8%、0.5%)的猪肉乳化香肠,结果证明该方法具有很好的重复性(变异系数1.90%~7.01%)。同时将SPI质量分数的预测值和真实值进行线性回归分析,得到相关系数为0.98,证明了这种检测方法能应用于猪肉乳化香肠中大豆分离蛋白的定量检测。
猪肉乳化香肠;大豆分离蛋白;检测;聚丙烯酰胺凝胶电泳
猪肉乳化香肠是近年来国内市场上具有典型代表性的西式肉制品,如法兰克福香肠、维也纳香肠、斯特拉斯堡早餐肠等。国内生产的乳化香肠主要采用猪肉为原料,辅之以食盐、腌制剂、调味料、大豆分离蛋白等,并经过斩拌(乳化)、干燥、烟熏、蒸煮等工艺而制得,因其肉质鲜嫩、营养丰富、食用方便等特点,深受广大消费者的欢迎[1-2]。然而,到目前为止,国内外对肉制品中大豆蛋白的检测还没有确定的法定方法。而一些生产商为了获得更多的经济利益,在肉制品中加入过多价格较低的大豆蛋白来的减少肉的添加量,且不在成分表中说明其含量,这种行为不仅导致商家不公平竞争,同时,对于消费者来说也不能基于其成分做出购买选择[3-6]。因此,许多国家禁止添加大豆蛋白或者只允许有限度的添加大豆蛋白,如美国法律规定在香肠中大豆分离蛋白(soybean protein isolate,SPI)含量不能超过2%[7]。但目前国内在肉制品中大豆蛋白应用方面还没有颁布相关规范,也未制定相关标准,因此,开发快速、简便、稳定性强的大豆蛋白检测方法,对于规范大豆蛋白的使用,保障消费者利益具有重要意义[6]。
目前国外检测肉制品中大豆蛋白的检测方法主要有ELISA法、高效液相色谱法、电泳法等。ELISA法是目前实验室常用于大豆蛋白检测的方法,但美国化学分析协会只是将它作为一种半定量的方法[8]。高效液相色谱法是一种分离蛋白质的常用方法,然而,应用该方法在分离检测肉制品中大豆蛋白时,操作复杂且成本较高[7]。聚丙烯酰胺凝胶电泳法(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)是研究大豆蛋白最普遍的电泳方法,该方法的优点在于食品的处理过程(特别是热处理)对检测影响很小[9]。Molander[10]应用SDS-PAGE电泳法检测肉制品中大豆蛋白的含量,检出限达0.6%;Lee等[11]成功通过SDS-PAGE电泳法检测了肉和大豆蛋白混合物(未加热和加热处理)中大豆蛋白的含量。然而,这种方法目前还没有应用到检测乳化香肠中的大豆分离蛋白。因此,本研究利用SDS-PAGE电泳法对猪肉乳化香肠中的大豆分离蛋白进行分析检测,目的是将SDS-PAGE用于猪肉乳化香肠中大豆分离蛋白的定量检测,并确定其检出范围及检出限。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白 山东德州大王集团蛋白食品有限公司;猪后腿肉、猪脂肪、淀粉、食盐、白沙糖、葡萄糖、味精、白胡椒粉、十三香 雅安当地超市;异VC钠、红曲色素、磷酸盐、亚硝酸钠 食品添加剂市场;猪肠衣 自备。
1.2 仪器与设备
HWS24电热恒温水浴锅、DHG29345A电热恒温鼓风干燥箱 上海一恒公司;QT-2旋涡混合器 上海琪特分析仪器有限公司;Mini垂直电泳仪、ChemiDoc XRS凝胶成像仪 美国Bio-rad公司;Bellitouron 53200高速冷冻离心机 法国Thermo Electron公司;DSHZ-300多用途水浴恒温振荡器 江苏太仓市实验设备厂;BCD2186E1B海尔冰箱;PB210 pH计 德国赛多利斯公司。
1.3 方法
1.3.1 猪肉乳化香肠配方及加工工艺[12]
主料(质量分数):猪后腿瘦肉(50%)、按SPI(10%、5%、2%、1%、0.5%、0%)制备用于检测SPI的标准曲线的猪肉乳化香肠;同时按SPI(7%、3%、1.5%、0.8%、0.5%)制备用于验证该方法的猪肉乳化香肠。
配料(质量分数):猪脂肪(18%)、碎冰(19%)、淀粉(2%)、水(1%)、食盐(1.9%)、白沙糖(0.5%)、葡萄糖(0.5%)、味精(0.15%)、磷酸盐(0.3%)、亚硝酸钠(0.015%)、白胡椒粉(0.015%)、十三香(0.01%)、异VC钠(0.03%)、红曲色素(0.0007%)。
工艺流程:原料猪后腿肉→选修→加SPI、配料进行斩拌、乳化→灌肠→40℃干燥 5 min→55℃干燥10min→80℃蒸煮30min→喷淋冷却 →冷藏。
1.3.2 样品处理
参考 Guy等[13]和王振宇等[14]的方法稍作修改,称取猪后腿瘦肉、大豆分离蛋白、配料、不同SPI的自制猪肉乳化香肠各10.00g,研磨均匀,分别取1.00、0.20、0.80、2.00g,放入不同编号的50mL离心管中,再各添加30mL缓冲液(缓冲液由8mol尿素和10g硫基乙醇加蒸馏水至1L配制而成),用玻璃棒搅拌均匀,旋涡混合器混合3min,4℃,10000×g离心20min, 上清液用whatman 1#滤纸在4℃条件下过滤除去上浮脂肪,滤液为蛋白提取液。
1.3.3 SDS-PAGE凝胶电泳
参考LaemmLi等[15]和Molander[10]的方法,按分离胶11%,浓缩胶4%进行SDS-PAGE凝胶电泳。
1.3.4 定量检测
电泳完成后,用考马斯亮蓝染色液染色30min,取100mL脱色液对分离胶脱色,重复脱色3次,在600nm波长处进行扫描,用光强度的值来定量检测大豆蛋白条带[10,16]。
1.3.5 数据统计分析
以上实验均重复3次。采用Quantity one软件对凝胶结果进行分析,Origin 8.0制图,SPSS 18.0对结果进行统计分析。
2 结果与分析
2.1 定性分析猪肉乳化香肠中的大豆分离蛋白和猪肉蛋白
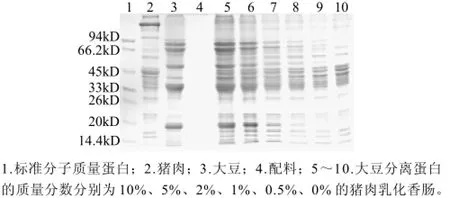
图1 无配料含不同SPI添加量的模拟猪肉乳化香肠SDS-PAGE图Fig.1 SDS-PAGE patterns of pork, soybean, auxiliary materials for emulsion-type pork sausages and mimic emulsion-type pork sausages containing different amounts of SPI and no auxiliary materials
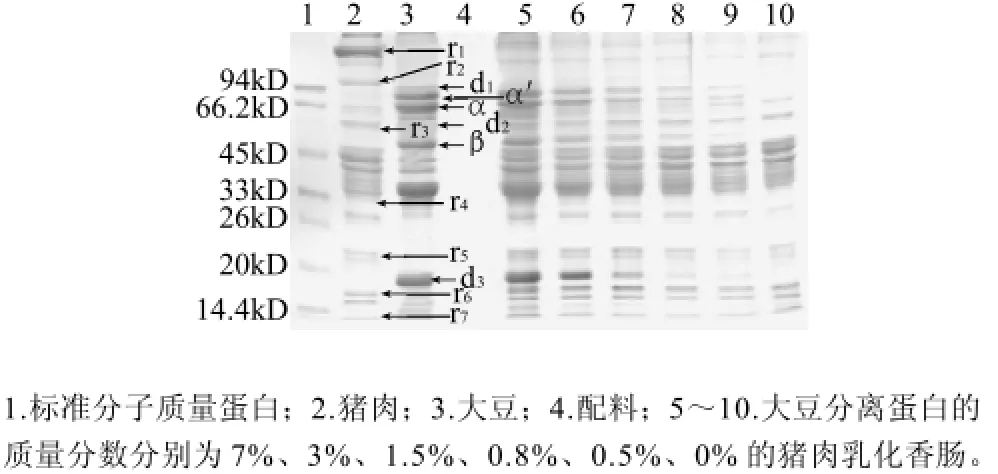
图2 含不同SPI添加量的猪肉乳化香肠的SDS-PAGE图Fig.2 SDS-PAGE patterns of pork, soybean, auxiliary materials for emulsion-type pork sausages and emulsion-type pork sausages containing different amounts of SPI and auxiliary materials
图1、2显示了猪肉、SPI、配料及SPI质量分数不同的猪肉乳化香肠的SDS-PAGE电泳图。从图1、2可以看出,大豆分离蛋白主要有5条(d1,α',β,d2,d3)蛋白条带能和猪肉的蛋白条带区分开,但d1和d2两条蛋白带由于含量较低,在大豆分离蛋白质量分数为1%时不能被检测到。5条大豆分离蛋白区分带中有3条(α'、β、d3)蛋白条带与Molander[10]发现的一致。大豆蛋白中的β-大豆伴球蛋白(7S)和大豆球蛋白(11S)是大豆贮藏蛋白中的两种主要蛋白质,其含量大约分别占大豆贮藏蛋白的40%和25%[17]。图1中α'、β为β-大豆伴球蛋白(7S)的两个亚基,分子质量分别为82kD和48kD,d3为大豆球蛋白(11S)的一种亚基,分子质量为19kD。Lee[18]等研究指出了19.5kD的大豆蛋白条带不会被其他多种非肉蛋白(牛奶蛋白、花生蛋白、鸡蛋蛋白等)干扰,和本研究中发现的d3(19kD)蛋白条带一致。同时从图1和图2还可以看到,猪肉蛋白条带中主要有7条(r1~r7)蛋白条带和大豆蛋白条带区分开,其中一条45kD的猪肉蛋白条带(G-肌动蛋白)与Hofmann[19]研究的结果一致,同时发现这条蛋白在加工前后仍大量存在,但有明显的降低,这与王振宇[14]研究的纯猪肉在80℃条件下加热几乎未降解存在差异,可能是由于本实验中蛋白含量比较低,降解较明显。从图1、2还发现了一条接近24kD的肌钙蛋白(r5),这与Chen等[20]发现的24kD热稳定蛋白一致,据研究这种蛋白在126℃加热120min几乎不分解,同时对其溶解度和免疫学功能均无影响。
2.2 定量分析猪肉乳化香肠中的大豆分离蛋白
由于蛋白的量与所吸附的考马斯亮蓝大致呈正比,遵循Beer-Lambert定律[21],同时,根据Molander[10]和Lee等[11]的研究,在一定浓度范围内,同一蛋白条带的光强度值和大豆蛋白添加量之间存在线性关系,通过比较其相关系数,可以得到检测大豆分离蛋白的标准曲线。由图1、2可以发现,在大豆分离蛋白区分带中,3条(α'、β、d3)蛋白条带在SPI质量分数为0.5%~10%之间都能被很好的检测到。比较由这三条(α'、β、d3)蛋白条带的光强度值随SPI质量分数增加的变化(图3),可以发现当SPI质量分数在0.5%~10%时,α'、β蛋白条带的光强度值随SPI质量分数的增加呈较好的线性(图3),而当SPI质量分数在5%~10%时,d3蛋白条带的光强度值随SPI质量分数的增加逐渐趋于水平(图3)。为了得到定量分析猪肉乳化香肠中SPI的标准曲线,分别计算3条蛋白条带(α'、β、d3)的光强度值与SPI质量分数之间的线性相关系数,得到的相关系数分别为0.9868、0.9789、0.8333。由于α'亚基蛋白条带(线性R2=0.9868)线性相关系数最好,因此作为检测猪肉乳化香肠中大豆分离蛋白的标准曲线(图4),应用SPSS 18.0分析得到标准曲线方程为Y峰面积=99.0291X+618.5902,Y峰面积为α'亚基蛋白条带的光强度值,χ为猪肉乳化香肠中SPI的质量分数。
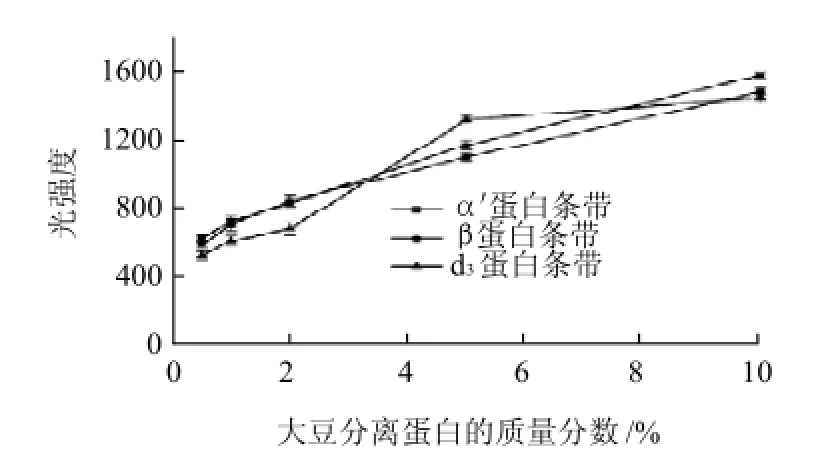
图3 不同SPI添加量的猪肉乳化香肠中蛋白条带的光强度图(n=3)Fig.3 SDS-PAGE band intensities of β-conglycinin α' andβ subunits and glycinin d3subunit versus SPI amount (n=3)
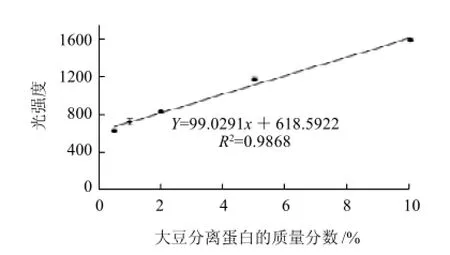
图4 由α'亚基计算得到的检测SPI质量分数的标准曲线图(n=3)Fig.4 Standard curve for the determination of SPI by regression analysis based on α' subunit
2.3 检测大豆分离蛋白的添加量
为了验证该标准曲线能否用于定量检测猪肉乳化香肠中的SPI,通过由α'亚基蛋白条带计算得到的(SPI质量分数在0.5%~10%之间)检测猪肉乳化香肠中SPI的标准曲线(图4)来预测未知样品中的SPI的质量分数(图2中5~9泳道,图4)。表1展示了样品中SPI质量分数的真实值和预测值,结果表明,预测的SPI质量分数接近真实SPI质量分数,低变异系数(1.90%~7.01%)证明该方法具有很好的重复性。
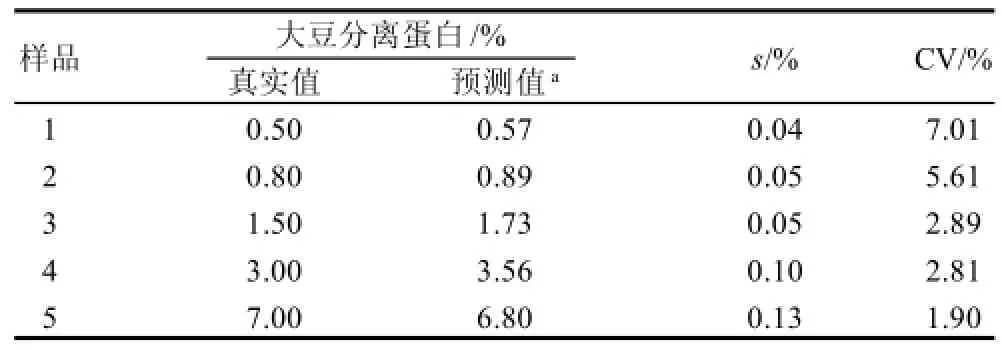
表1 猪肉乳化香肠中大豆分离蛋白的真实值和由标准曲线得到的预测值Table 1 Predicted and actual values of SPI in emulsion-type pork sausages

图5 大豆分离蛋白质量分数的预测值和真实值之间的回归分析Fig.5 Regression analysis between predicted values and actual values of SPI
设定置信区间为95.0%,对大豆分离蛋白质量分数的预测值和真实值进行线性回归分析[22]。图5显示了预测值和真实值之间的相关系数为0.98,非常接近1,这就说明了预测值和真实值之间非常的接近。通过这些结果,证明了这种检测方法能应用于猪肉乳化香肠中大豆分离蛋白的定量检测。
3 结 论
本研究应用SDS-PAGE电泳对猪肉乳化香肠中猪肉和大豆分离蛋白进行分析检测,获得了一条能定量检测猪肉乳化香肠中大豆分离蛋白(0.5%~10%)的标准曲线,其最低检出限为0.5%。通过该标准曲线成功用于猪肉乳化香肠中大豆分离蛋白的预测,证明该方法能被有效地应用于猪肉乳化香肠中大豆分离蛋白的检测。
[1]胡铁军, 闫革华, 邹尔新, 等. 全牛肉乳化香肠的研制[J]. 肉类工业, 2000(11)∶ 29-30.
[2]周伟伟, 刘毅, 陈霞. 斩拌终温对乳化型香肠品质影响的研究[J]. 食品工业科技, 2008, 29(3)∶ 76-78.
[3]ASENSIO L, GONZALEZ I, GARCA T, et al. Determination of food authenticity by enzyme-linked immunosorbent assay (ELISA)[J]. Food Control, 2008, 19(1)∶ 1-8.
[4]BALLIN N Z, VOGENSEN F K, KARLSSON A H. Species determination—Can we detect and quantify meat adulteration?[J]. Meat Science, 2009, 83(2)∶ 167-174.
[5]CASTRO F, RODRIGUEZ R, MARINA M L, et al. Determination of soybean proteins in commercial heat-processed- meat products prepared with chicken, beef or complexmixtures of meats from different species[J]. Food Chemistry, 2007, 100(2)∶ 468-476.
[6]张春江, 杨君娜, 张红芬, 等. 肉制品中大豆蛋白的应用与检测研究进展木[J]. 中国食物与营养, 2010(1)∶ 30-33.
[7]BELLOQUE J, GARCIA M C, TORRE M, et al. Analysis of soyabean proteins in meat products∶ a review[J]. Critical Reviews in Food Science and Nutrition, 2002, 42(5)∶ 507-532.
[8]AOAC Official Method, 998.10. Soy protein in raw and heat-processed meat products, Enzyme-Linked Immunosorbent Assay[S]//Official Methods of Analysis (16th ed., Rev. 1996, 1997, 1998), Gaithersburg MD∶AOAC International.
[9]LOPEZ-TAPIA J, GARCIA-RISCO M R, MANSO M A, et al. Detection of the presence of soya protein in milk powder by sodium dodecyl sulfate capillary electrophoresis[J]. Chromatography A, 1999, 836(1)∶153-160.
[10]MOLANDER E. Determination of soya protein in meat products by standard curves obtained from SDS gel Electrophoresis[J]. Z Lebensm Unters Forsch, 1982, 74(4)∶ 278-281.
[11]LEE Y B, GREASER M L, RICKANSRUD D A, et al. Quantitative determination of soybean protein in fresh and cooked meat-soy blends[J]. Journal of Food Science, 1975, 40(2)∶ 380-383.
[12]戴瑞彤, 吴国强. 乳化型香肠生产原理和常见问题分析[J]. 食品工业科技, 2000, 21(5)∶ 21-23.
[13]GUY R C E, JAYARAM R, WILLCOX C J. Analysis of commercial soya additives in meat products[J]. Sci Food Agric, 1973, 24(12)∶ 1551-1563.
[14]王振宇, 刘欢, 马长伟. 热处理下的猪肉蛋白质的特性[J]. 食品科学, 2008, 29(5)∶ 73-77.
[15]LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227∶ 680-685.
[16]TOMASZEWSKA-GRASA J, KIJOWSKIA J, FRANCISCUS J G, et al. Quantitative determination of titin and nebulin in poultry meat by SDS-PAGE with an internal standard[J]. Meat Science, 2002, 62(1)∶ 61-66.
[17]ZARKADAS C G, GAGNON C, POYSA V. Protein quality and identification of the storage protein subunits of tofu and null soybean genotypes, using amino acid analysis, one and two-dimensional gel electrophoresis, and tandem mass spectrometry[J]. Food Research International, 2007, 40(1)∶111-128.
[18]LEE Y B, RICKANSRUD D A, HAGBERG E C, et al. Detection of various nonmeat extenders in meat products[J]. Journal of Food Science, 1976, 41(3)∶ 589-593.
[19]HOFMANN K, PENNY I F. Identifizierung von sojaund fleischeiwei mittels dodecylsulfat-polyacrylamidgel-elektrophorese[J]. Die Fleischwirtsch, 1971, 51(4)∶ 577-578.
[20]CHEN F C, HSIEH Y H P. Separation and characterization of a porcinespecific thermostable muscle protein from cookedpork[J]. Journal of Food Science, 2001, 66(6)∶ 799-803.
[21]SIMPSON R J. 蛋白质与蛋白质组学实验指南[M]. 北京∶ 化学工业出版社, 2006∶ 43-44.
[22]SOARES S, AMARAL J S, MAFRA I. Quantitative detection of poultry meat adulteration with pork by a duplex PCR assay[J]. Meat Science, 2010, 85(3)∶ 531-536.
Determination of Soybean Protein Isolate in Emulsion-type Pork Sausages
YANG Yong,ZHOU Xiao-ping,QIN Dan,CHENG Yan
(College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE) was used for the qualitative and quantitative analysis of soybean protein isolate (SPI) in emulsion-type pork sausages. Results showed that SPI displayed five major bands including β-conglycinin d1, α', β and d2subunits and glycinin d3 subunit in SDS-PAGE, which could be distinguished from pork protein. A linear regression equation with band intensity as a function of SPI concentration of α' subunit in the range of 0.5%-10% was obtained for determining SPI in emulsion-type pork sausages. The prediction values of samples containing SPI at various amounts of 7%, 3%, 1.5%, 0.8% and 0.5% exhibited a high reproducibility with variation coefficients between 1.90% and 7.01%. The successful application of SDS-PAGE was also demonstrated by a high correlation coefficient of 0.98 obtained from regression analysis between the predicted and actual values of SPI in spiked emulsion-type pork sausages.
emulsion-type pork sausages;soybean protein isolate;determination;sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE)
TS251.7
A
1002-6630(2011)14-0281-04
2010-10-21
四川农业大学“双支计划”课题(06070105)
杨勇(1969—),男,副教授,博士,研究方向为肉品科学与技术。E-mail:yangyong676@163.com

