甜荞苯丙氨酸解氨酶基因PAL的克隆及序列分析
李成磊,蒙 华,张晓伟,陈 惠,邵继荣,吴 琦*
(四川农业大学生命科学与理学院,四川 雅安 625014)
甜荞苯丙氨酸解氨酶基因PAL的克隆及序列分析
李成磊,蒙 华,张晓伟,陈 惠,邵继荣,吴 琦*
(四川农业大学生命科学与理学院,四川 雅安 625014)
利用RT-PCR技术,首次从甜荞(Fagopyrum esculentum)中克隆得到苯丙氨酸解氨酶基因(PAL)的cDNA ORF序列,命名为FePAL。该序列长2169bp,编码722个氨基酸,与其他植物PAL基因同源性较高,为80%~97%,其推导的氨基酸序列含有PAL酶活性中心特征序列GTITASGDLVPLSYIA和多个脱氨基、催化活性位点。系统发育树表明,甜荞PAL基因与苦荞PAL基因聚类关系最近。
甜荞;苯丙氨酸解氨酶基因;克隆;序列分析
甜荞(Fagopyrum esculentum)又称普通荞麦,为蓼科荞麦属双子叶植物,是我国荞麦的主要栽培品种之一。它起源于我国西南部,现已在世界范围内作为一种小粮作物而被广泛种植。甜荞是药食同源作物,籽粒除含高生物价的蛋白质、VE、VPP和微量矿质元素硒外,还含有其他粮食作物中少有的黄酮类化合物(主要成分为芦丁)。这些化合物在清除自由基、抗氧化、降血脂和改善胰岛功能等方面具有独特的效果[1-3],因此作为一种既有营养价值又具保健作用的传统作物,甜荞具有很高的开发利用价值[4-5]。
黄酮类化合物是植物苯丙烷类代谢途径中的次生代谢产物,该途径反应众多,由多种酶共同催化完成,苯丙氨酸氨解酶(phenylalanine ammonia-lyase,PAL)则是连接初级代谢和次级代谢,催化该途径第一步反应的酶,也是该途径的关键酶和限速酶。它催化L-苯丙氨酸解氨生成反式肉桂酸,再由反式肉桂酸生成香豆酸、芥子酸等中间产物;此后,在不同酶的催化作用下,中间产物经不同分支进一步转化为类黄酮、木质素和酚类等次生代谢产物。这些次生代谢产物在植物的生长发育及抗病抗逆过程中均起着重要的作用[6-10]。
一直以来文献都报道甜荞黄酮类化合物含量低于另一栽培种苦荞(Fagopyrum tataricum)[11-12],但由于甜荞籽粒具有个大、易脱皮、出粉率高等特点仍被广泛种植,若能提高甜荞黄酮类含量更能提升其种植价值。现在,应用基因工程对植物次生代谢途径的遗传特性进行改造以提高特定产物含量、改良植物品质,已发展为具有广阔应用前景的热点研究领域,而要达到这个目的,次生代谢途径中关键酶基因的克隆显得尤为重要。本研究以阿坝甜荞为材料,采用RT-PCR技术克隆其PAL的cDNA开放阅读框(open reading frame,ORF)序列并进行分析,为逐步揭示其次生代谢途径及利用关键酶基因调控甜荞黄酮类化合物的积累提供分子生物学依据。
1 材料与方法
1.1 材料与试剂
供试甜荞种子购于四川阿坝农户,种植于四川农业大学生物系实验基地。经邵继荣教授鉴定,符合甜荞种的特征。
质粒DNA小量提取试剂盒、胶回收试剂盒 Omega公司;rTaqDNA聚合酶、克隆载体pMD19-T Takara公司;RNA提取试剂植物RNAout试剂盒 天泽基因工程有限公司;逆转录试剂盒RevertAidTMFirst Strand cDNA Synthesis Kit Fermentas公司。
1.2 仪器与设备
高速冷冻离心机 Thermo Electron Corporation;MyCyclerTM PCR、仪凝胶成像系统 美国Bio-Rad公司;DYY-Ⅲ-68型稳压稳流电泳仪 北京市六一仪器厂;DNP-9272型电热恒温培养箱 上海精宏试验设备有限公司。
1.3 方法
1.3.1 甜荞花总RNA提取及甜荞PAL基因cDNA ORF序列的克隆
采用植物RNAout试剂盒提取甜荞新鲜花总RNA,以Oligo-dT为引物进行RT-PCR获得cDNA。以反转录得到的cDNA为模板,参照Genbank中已登录的苦荞PAL基因(GQ285125)序列设计一对特异引物TPALf:5′-GC AATGGGGGTCTCAAACG-3′;TPALr:5′-TTTTT CCTAGCAGATAGGCA-3′扩增甜荞PAL基因cDNA ORF序列。在200μL EP管中依次加入:ddH2O 34μL、10× Buffer 5μL、25mmol/LMgCl23μL、dNTP mixture 3μL、20μmol/L上下游引物各1.5μL、模板cDNA 1μL、Taq DNA聚合酶1μL(5U/μL),总体积50μL。反应条件为:94℃、5min;94℃、1min,55℃、1min,72℃、1min,共30个循环;72℃、8min。扩增产物经琼脂糖凝胶电泳回收后连接至pMD 19-T进行克隆,筛选出阳性克隆后送北京诺赛基因组研究中心有限公司进行测序。
1.3.2 生物信息学分析
借助NCBI在线工具Blast进行甜荞PAL核苷酸序列和蛋白质序列的同源性分析,利用Clustal X1.81对甜荞PAL进行多序列比对后采用邻接法构建系统发育树。
2 结果与分析
2.1 甜荞花总RNA的提取
提取的总RNA经2%琼脂糖电泳结果见图1。28S rRNA和18S rRNA条带清晰可见,亮度比在1:1至2:1之间,表明RNA基本未降解,可用于RT-PCR。

图1 甜荞花总RNAFig.1 Total RNA extracted from the flower of F. esculentum
2.2 甜荞PAL基因cDNA ORF序列的克隆
以甜荞新鲜花总RNA反转录得到的cDNA为模板,用特异引物PCR扩增得到约2200bp的特异带(图2)。
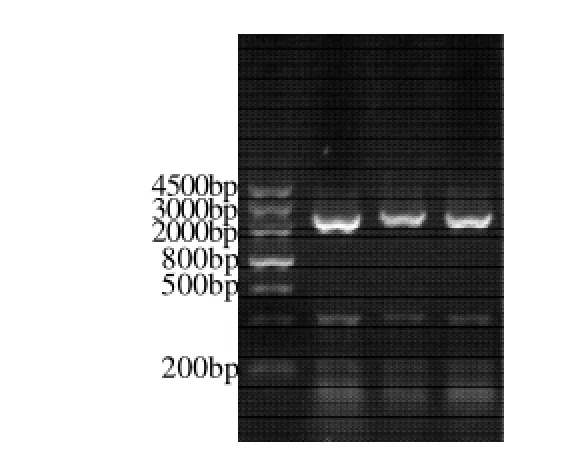
图2 PAL基因cDNA ORF的PCRFig.2 Agarose gel electrophoresis of PCR amplification products of cDNA ORF of PAL
2.3 甜荞PAL基因序列分析
甜荞PAL基因cDNA扩增产物测序结果经拼接后得到了长为2169bp的核苷酸序列。该cDNA序列包含一个完整的开放阅读框,编码722个氨基酸(图3),将该序列命名为FePAL,并提交GenBank,登录号为GU363529。
通过NCBI在线比对工具Blast将FePAL序列同其他物种PAL进行比对,结果表明其核苷酸序列与苦荞PAL基因(GQ285125)同源性达到97%,其次与藿香(Agastache rugosa,AF326116)同源性为74%,与芸苔(Brassica napus,AY795080)、葡萄(Vitis vinifer,EF192469)和山莴苣(Lactuca sativa,AF411134)等同源性均为73%。
将FePALcDNA推导的氨基酸序列进行同源性比对,结果表明:FePAL氨基酸序列与苦荞(ACT68010)同源性最高为97%,与毛果杨(Populus trichocarpa,ACC63889)、麻风树(Jatropha curcas,ABI33979)和欧芹(Petroselinum crispum,CAA57057)等具有80%左右的同源性。且经Blast P分析显示FePAL编码的蛋白质具有PAL-HAL功能域,第66~532的肽段与PAL同源性很高,除含有一个酶活性中心特征序列GTITASGDL VPLSYIA外,还存在多个酶活性位点(图3)。这些活性位点与玉米和拟南芥的活性位点比较相似[13-14],说明FePAL是PAL蛋白质家族中的一员。

图3 FePAL基因cDNA ORF序列和推导的氨基酸序列Fig.3 cDNA ORF and deduced amino acid sequences of FePAL
2.4 分子进化分析

图4 甜荞PAL与其他植物PAL氨基酸序列的系统发育树Fig.4 Phylogenetic tree of FePAL and PAL from other plants based on amino acid sequences
经Clustal X1.81进行多序列比对后,采用邻接法构建基于甜荞PAL氨基酸序列的系统发育树(图4)。由图看出,相同科的植物多处于同一分支,如豆科的大豆(Glycine max)、紫苜蓿(Medicago sativa)和黄芪(Astragalus mongholicus)等。同为蓼科的甜荞与苦荞亲缘关系最近,也单独构成一个分支,与毛果杨、葡萄等其他植物关系较远。
3 讨 论
苯丙烷类代谢途径是植物重要的次生代谢途径之一,PAL作为该途径的第一个关键酶和限速酶,其活性的高低与该途径终产物如类黄酮、木质素和植保素等的积累有着密切的关系。刘金富等[15]研究了苦荞发芽过程黄酮含量的变化规律,认为PAL活性升高,黄酮合成也会增加。程水源等[16]研究银杏叶黄酮含量与PAL活性变化得出:PAL活性变化与银杏叶黄酮含量变化几乎同步,呈显著正相关,并确定PAL是银杏叶黄酮合成过程中关键酶之一。苹果PAL的活性与黄酮类化合物花青苷生物合成的研究表明,在苹果幼果中,花青苷合成与PAL活性呈一定的相关性[17]。原永兵等[18]认为,PAL活性的变化与简单酚含量变化一致。由此可见,通过增强PAL的活力,可以在一定程度上提高植物中类黄酮物质的含量。
类黄酮物质作为一种重要的次生代谢产物,它在植株中的高水平积累不仅能够提升植物品质,对植株本身而言,也能提高其抗病抗胁迫的能力。近年来利用基因工程技术通过关键酶基因对植株进行遗传品质的改良是研究的热点。PAL作为类黄酮代谢途径中的关键酶和限速酶,本研究首次克隆了甜荞PAL基因cDNA ORF,为利用基因工程技术调控甜荞类黄酮的代谢,增加其类黄酮物质的积累提供参考。
[1] WATAMABE M, OHSHITA Y, TSUSHIDA T. Antioxidant compounds from buckwheat (Fagopryum esculentum Moench) hulls[J]. J Agric Food Chem, 1997, 45(4): 1039-1044.
[2] STANISLAW B, WIESLAW O. Antioxident and antiradical activities of flavonoids[J]. J Agric Food Chem, 2001, 49(6): 2774-2779.
[3] 韩淑英, 吕华, 朱丽莎, 等. 荞麦种子总黄酮降血脂、血糖及抗脂质过氧化作用的研究[J]. 中国药理通报, 2001, 17(6): 694-696.
[4] 王红育, 李颖. 荞麦的研究现状及应用前景[J]. 食品科学, 2004, 25 (10): 388-391.
[5] 陈春刚, 韩芬霞. 生物类黄酮的研究与应用综述[J]. 安徽农业科学, 2006, 34(13): 2949-2951.
[6] PICHERSKY E, GERSHENZON J. The formation and function of plant volatiles: perfumes for pollinator attraction and defense[J]. Curr Opin Plant Biol, 2002, 5(3): 237-243.
[7] 邹凤莲, 寿森炎, 叶纨芝, 等. 类黄酮化合物在植物胁迫反应中作用的研究进展[J]. 细胞生物学杂志, 2004, 26(1): 39-44.
[8] TREUTTER D. Significance of flavonoids in plant resistance and enhancement of their biosynthesis[J]. Plant Biol, 2005, 7(6): 581-591.
[9] CHENG Aixia, LOU Yonggen, MAO Yingbo, et al. Plant terpenoids: biosynthesis and ecological functions[J]. Journal of Integrative Plant Biology, 2007, 49(2): 179-186.
[10] PRISIC S, XU Meimei, WILDERMAN P R, et al. Rice contains two disparate ent-Copaly1 diphosphate synthases with distinct metabolic functions[J]. Plant Physiology, 2004, 136(4): 4228-4236.
[11] JIANG P, BURCZYNSKI F, CAMPBELL C, et al. Rutin and flavonoid contents in three buckwheat species Fagopyrum esculentum, F. tataricum, and F. homotropicum and their protective effects against lipid peroxidation[J]. Food Research International, 2007, 40(3): 356-364.
[12] KIM S J, ZAIDUL I S M, SUZUKI T, et al. Comparison of phenolic compositions between common and tartary buckwheat (Fagopyrum) sprouts[J]. Food Chemistry, 2008, 110(4): 814-820.
[13] ROSLER J, KAEKEL F, AMRHEIN N, et al. Maize phenylalanine ammonia-lyase has tyrosine ammonia-lyase activity[J]. Plant Physiol, 1997, 113(1): 175-179.
[14] WANNER L A, LI Guoqing, WARE D, et al. The phenylalanine ammonia-lyase gene family in Arabidopsis thaliana[J]. Plant Mol Biol, 1995, 27(2): 327-338.
[15] 刘金福, 李晓燕, 孟蕊. 发芽过程中促进黄酮合成的因素初探[J]. 食品工业科技, 2006, 27(10): 106-108.
[16] 程水源, 许锋陈, 昆松. 银杏苯丙氨酸解氨酶基因的克隆和序列分析[J]. 林业科学研究, 2005, 18(5): 573-577.
[17] 赵宗方, 赵勇. 果实花青素含量与PAL活性关系的研究[J]. 园艺学报, 1994, 21(2): 199-200.
[18] 原永兵, 曹宗巽. 水杨酸在植物体内的作用[J]. 植物学通报, 1994, 11(3): 1-9.
Cloning and Sequence Analysis of Phenylalanine Ammonia-lyase (PAL) Gene from Fagopyrum esculentum
LI Cheng-lei,MENG Hua,ZHANG Xiao-wei,CHEN Hui,SHAO Ji-rong,WU Qi*
(College of Life Science, Sichuan Agricultural University, Ya’an 625014, China)
The cDNA ORF sequence of phenylalanine ammonia-lyase gene (FePAL) from Fagopyrum esculentum was cloned by RT-PCR. The cDNA sequence was 2169 bp in length, encoding 722 amino acids and had a high homology (80%-97%) with PAL genes from other plants. The deduced amino acid sequence of FePAL contained the typical sequence (GTTTASGDLVPLSYIA) in PAL activity center region, deamination residues and catalytic active sites. Phylogenetic tree analysis revealed that FePAL was most closely related to the PAL of Fagopyrum tataricum.
Fagopyrum esculentum;phenylalanine ammonia-lyase gene;cloning;sequence analysis
Q943.2;S517.032
A
1002-6630(2011)07-0255-03
2010-07-04
四川省科技厅科技攻关项目(04NG001-015;2006Z08-012)
李成磊(1983—),男,博士研究生,研究方向为基因工程。E-mail:lichenglei1998@yahoo.com.cn
*通信作者:吴琦(1973—),男,副教授,博士,研究方向为基因工程。E-mail:wuqiwq@yahoo.cn

