利用来源于Paenibacillus macerans的α-CGTase突变体Y89D制备α-环糊精
王 宁,吴 丹,陈 晟,陈 坚,吴 敬,*
利用来源于Paenibacillus macerans的α-CGTase突变体Y89D制备α-环糊精
王 宁1,2,吴 丹1,2,陈 晟1,2,陈 坚1,2,吴 敬1,2,*
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;
2.江南大学生物工程学院,工业生物技术教育部重点实验室,江苏 无锡 214122)
对α-环糊精葡萄糖基转移酶(α-CGTase)突变体Y89D制备α-环糊精的影响因素进行初步研究。其因素包括淀粉种类(马铃薯淀粉、玉米淀粉、木薯淀粉、可溶性淀粉)、加酶量、反应时间、pH值、有机溶剂(乙醇、异丙醇、正丁醇、正癸醇)和温度。结果表明:选用5g/100mL马铃薯淀粉、pH5.0、温度30℃、加酶量控制在每克淀粉5U左右,反应体系中加入体积分数5%的正癸醇,反应6h后,淀粉总转化率可达70%,其中α-环糊精在产物中质量分数约为85%,转化产物中含有少量β-环糊精(15%),而极少生成γ-环糊精。因此,α-CGTase突变体Y89D在制备α-环糊精工艺中具有很好的工业化应用前景。
α-环糊精;α-环糊精葡萄糖基转移酶;有机溶剂;转化率
环糊精葡萄糖基转移酶(CGTase,EC2.4.1.19)是α-淀粉酶家族的重要成员,其独特功能是能将淀粉转化为环糊精[1]。环糊精是由6个以上葡萄糖连结而成的具有环状疏水圆锥形结构的低聚糖非还原性化合物系列,其中最常用的是α-环糊精、β-环糊精和γ-环糊精,它们分别由6、7、8个葡萄糖单元构成[2]。环糊精分子的内表面呈疏水性,外表面呈亲水性,这种独特的分子结构使它可以通过范德华力、疏水作用力等与一些疏水性客体分子或基团形成包合物,从而改变客体分子的物理和化学性质如溶解度、稳定性等,因此其在食品、医药、农业、纺织、环保、化妆品、生物技术和分析化学等领域具有广泛的应用[3-5]。3种常用的环糊精中,由于β-环糊精溶解度最小,可以很方便地通过分步结晶的方法制得,因此,目前工业生产中大量制备和广泛应用的是β-环糊精,但是β-环糊精无法取代α-环糊精的用途,相比于β-环糊精,α-环糊精具有更小的空腔,更适于包合具有低分子质量的分子,并且是一种非常好的膳食纤维,在食品等领域已显示出无可比拟的优势。虽然市场上对α-环糊精有较大的需求,但由于CGTase的产物特异性差,而且α-环糊精的水溶性相对较高,不容易分离纯化,因此造成生产成本高,α-环糊精价格昂贵。国外虽然已有相关研究报道,但是产量非常有限,国内尚未见α-环糊精生产工艺的报道,因此研究α-环糊精的酶转化与制备工艺显得至关重要。
生产α-环糊精的方法主要有化学法和生物法,化学法是将马赛兰氏淀粉与四氯乙烷反应,生成α-环糊精粗品,再经过滤和水蒸气蒸馏后得到纯度相对较高的α-环糊精[6]。由于α-环糊精溶解度较大,所以化学法制备比较困难,而且会对环境造成较大污染。生物法目前被认为是极具应用潜力的方法。然而关于生物法生产α-环糊精的报道则很少。陈龙然等[7]从土壤中分离出一株地衣芽孢杆菌,该菌发酵得到的CGTase作用于淀粉后,产物以α-环糊精为主,β-环糊精次之,二者比例为 2.47:1,环糊精总产率为29.8%。王俊英等[8]从其实验室保存的一株Bacillus sp. 60221细菌中纯化了一种α-CGTase,利用该酶转化淀粉24h,总转化率可达41%,其中α-环糊精占总转化产物的78%。
目前,所有已知的野生型CGTase生产的均是α-环糊精、β-环糊精和γ-环糊精的混合物,这给产物的分离纯化带来很大不便,因此如何提高环糊精生产的特异性成为了近几年研究的热点。研究表明,通过一些定点突变的设计,对CGTase活性中心底物结合凹槽附近的一个或多个重要的氨基酸残基进行取代、插入或者删除等会改变CGTase产物中α、β、γ构型的比例,从而改善环糊精的产品特异性,并减弱产物抑制[9-11]。
根据文献报道,CGTase的一级结构是决定产物特异性的主要内在因素,CGTase活性中心凹槽至少包括9个糖结合位点[12],在环化过程中,葡萄糖残基在亚位点-3上的结合模式发生改变,最近的一些定点突变结果证实了与定位在亚位点-3上的葡萄糖残基有相互作用的氨基酸残基对CGTase的产物特异性具有重要的作用[13]。氨基酸残基89 (按照Peanibacillus macerans CGTase编号)是亚位点-3的组成部分,因此在前期研究中,本实验室选择Peanibacillus macerans JFB05-01 CGTase中的Tyr89作为定点突变的目标,将Peanibacillus macerans JFB05-01 CGTase中位于亚位点-3处89位的酪氨酸(Y)突变成天冬氨酸(D),发现该突变体可以显著提高α-环糊精特异性[14]。本实验对α-CGTase突变体Y89D制备α-环糊精的影响因素进行初步研究,从而为α-环糊精的工业化生产提供参考。
1 材料与方法
1.1 材料与试剂
大肠杆菌cgt/pET-20b(+)/E.coli BL21(DE3)由本实验室构建并保存[15];大肠杆菌cgt-Y89D/pET-20b(+)/ E.coli BL21(DE3) 由本实验室构建并保存[14]。
α-环糊精、β-环糊精、γ-环糊精 Sigma-Aldrich (上海)公司;玉米淀粉 诸城兴贸玉米开发有限公司;马铃薯淀粉 宁夏固原六盘山淀粉公司;木薯淀粉 广西武鸣淀粉厂;乙腈(色谱纯) 美国Honeywell公司;其他试剂均为国产分析纯。
1.2 仪器与设备
7200型分光光度计 尤尼柯上海仪器有限公司;PYX-DHS型隔水式电热恒温培养箱 上海跃进医疗器械厂;冷冻立式离心机CF16RX 日本Hitachi公司;高速离心机 德国Eppendorf公司; W201D电热恒温水浴摇床 江苏金坛国华仪器厂;Waters 600HPLC色谱仪、Waters自动进样器、Waters2410示差检测器 美国Waters公司;色谱柱Lichrosorb NH2(4.6mm×150mm)德国Merch公司。
1.3 方法
1.3.1 野生α-CGTase及α-CGTase突变体Y89D粗酶液的制备
种子培养:将保藏的菌种接入装有50mL LB培养基的250mL三角瓶中,回旋式摇床转速200r/min,培养温度为37℃,培养8h。
发酵培养:将培养好的种子培养液按体积分数4%的接种量,接种至装有100mL TB培养基的500mL三角瓶中进行发酵培养,摇床转速200r/min,培养温度为25℃,培养4d。各培养基使用前添加100μg/mL氨苄青霉素。将发酵液于4℃、10000r/min离心20min 除菌体,收集上清液,上清液即为粗酶液。
1.3.2 α-CGTase活力的测定
甲基橙法测定酶环化活力。将适当稀释的粗酶液加入装有预先用50mmol/L磷酸缓冲液(pH6.0)配制1g/100mL可溶性淀粉溶液的试管中,在40℃反应10min后,加入1.0mL 1.0mol/L的盐酸停止反应,再加入1.0mL用50mmol/L磷酸缓冲液配制的0.1mmol/L甲基橙,在20℃保温20min,在波长505nm处测定吸光度。酶活单位(U)定义为在上述条件下每分钟生成1μmol的α-环糊精所需的酶量。
1.3.3 HPLC法测定环糊精产量
采用HPLC法进行酶产物分析。用磷酸盐缓冲溶液配制5g/100mL淀粉溶液,沸水浴中加热糊化10min,冷却至反应温度后添加一定量的α-CGTase和有机溶剂,充分混匀后在40℃、200r/min水浴摇床中反应24h,相隔一定时间取样500μL,加热灭酶后于12000r/min离心25min,上清液经0.45μm超滤膜过滤后取10μL上机分析。
采用HPLC进行产物分析的色谱条件为:Waters 6 0 0 H P L C色谱仪、W a t e r s自动进样器、色谱柱Lichrosorb NH2(4.6mm×150mm);Waters2410示差检测器;流动相为65%乙腈水溶液,流速1mL/min;柱温3 0℃。
1.3.4 α-CGTase突变体Y89D作用淀粉生产α-环糊精的影响
1.3.4.1 淀粉种类对α-CGTase突变体Y89D生产α-环糊精的影响
参照1.3.3节方法分别以可溶性淀粉、玉米淀粉、马铃薯淀粉、木薯淀粉作为原料制备α-环糊精,HPLC检测分析环糊精产量。
1.3.4.2 加酶量对α-CGTase突变体Y89D生产α-环糊精的影响
配制pH6.0的5g/100mL马铃薯淀粉溶液,每克淀粉分别加入2.5、5、10、20、30、40U的CGTase粗酶液,参照1.3.3节制备α-环糊精,HPLC检测分析环糊精产量。
1.3.4.3 温度对α-CGTase突变体Y89D生产α-环糊精的影响
参照1.3.3节方法配制pH6.0的5g/100mL马铃薯淀粉溶液,加酶量控制在每克淀粉5U左右,反应6h,分别在不同的温度条件下制备α-环糊精,HPLC检测分析环糊精产量。
1.3.4.4 pH值对α-CGTase突变体Y89D生产α-环糊精的影响
参照1.3.3节方法用不同pH值缓冲溶液配制5g/100mL马铃薯淀粉溶液,控制加酶量为每克淀粉5U,于30℃进行转化反应,HPLC检测分析环糊精产量。
1.3.4.5 有机溶剂对α-CGTase突变体Y89D生产α-环糊精的影响[16]
配制pH5.0的5g/100mL马铃薯淀粉溶液,加酶量控制在每克淀粉5U,反应体系中分别加入2%的乙醇、异丙醇、正丁醇、正癸醇,反应温度30℃,参照1.3.3节方法制备α-环糊精,HPLC检测分析环糊精产量。
1.3.4.6 正癸醇添加量对α-CGTase突变体Y89D生产α-环糊精的影响
配制pH5.0的5g/100mL马铃薯淀粉溶液,反应体系中分别加入体积分数1%、2%、5%、7.5%、10%的正癸醇,加酶量控制在每克淀粉5U,反应温度30℃,反应6h,反应结束后水蒸气蒸馏[17]除去正癸醇,参照1.3.3节方法制备α-环糊精,HPLC检测分析环糊精产量。
2 结果与分析
2.1 野生酶与α-CGT酶突变体Y89D生产环糊精的比较

图1 野生酶与α-CGTase突变体Y89D生产环糊精的比较Fig.1 Comparison of α-cyclodextrin production between the wide-type α-CGTase and mutation Y89D of α-CGTase
从图1可见,对于野生CGTase,在反应起始阶段,α-环糊精是主要产物,而只生产少量的β-环糊精、γ-环糊精;反应8h,β-环糊精的质量浓度已经开始超过α-环糊精的质量浓度,随着反应时间的延长,α-环糊精占总环糊精产物的比例降低,β-环糊精比例增加,反应24h时,β-环糊精的产量明显大于α-环糊精的产量,产物中α-环糊精、β-环糊精和γ-环糊精质量比为44.4:53:2.6。与野生酶相比,α-CGT酶突变体Y89D能提高α-环糊精的生产能力,降低β-环糊精的生产能力,在反应的起始阶段,α-环糊精仍然是主要产物,而β-环糊精的生成速率与野生酶相比明显降低,反应4h,α-环糊精的质量浓度达到最高,随后α-环糊精的质量浓度逐渐降低,β-环糊精的比例逐渐增加,但是增加幅度非常缓慢,反应6h,α-环糊精的质量浓度大约是野生CGTase的1.2倍,而β-环糊精的质量浓度下降到野生CGTase的89%,反应24h后,产物中几乎有等量的α-环糊精和β-环糊精,α-环糊精和β-环糊精比例为52:48,而没有检测到γ-环糊精。这说明突变体Y89D比野生酶更适合α-环糊精的工业化生产。由于本实验中,反应4~6h,体系中α-环糊精的质量浓度最高,因此生产时控制反应时间在4~6h,不仅可以获得较高的α-环糊精产量还可以减少反应时间而降低生产成本。
2.2 淀粉种类对α-CGTsae突变体Y89D生产α-环糊精的影响
从表1可见,CGTase作用于淀粉后所产生的α-环糊精和β-环糊精量及总的环糊精产率在不同淀粉类型之间有所不同。4种淀粉生产环糊精的总转化率中马铃薯淀粉最高为35.07%,木薯淀粉、可溶性淀粉和玉米淀粉分别为32.53%,32.14%和25.81%;4种淀粉中,可溶性淀粉生成的α-环糊精的比例最高,其次为马铃薯淀粉。由于环糊精生产中通常采用淀粉作为原料,淀粉由直链淀粉和支链淀粉组成,不同类型的淀粉具有不同的直链与支链比例,这些结构上的差异,对环糊精的生产有很大的影响,有研究表明[18-19]支链淀粉含量高的淀粉生产环糊精的产率较高,这可能是因为支链淀粉只能被淀粉酶部分水解为麦芽糖,而直链淀粉可以被淀粉酶完全水解为麦芽糖,而CGTase本身属于淀粉酶家族的一员,它可以水解淀粉,麦芽糖是小分子糖,它的存在有利于CGTase将环糊精的环打开,从而对环糊精的生成有抑制作用[7],所以支链淀粉含量很高的马铃薯淀粉就有利于环糊精的生产,这与本实验的结果一致。考虑到工业化生产以及后期提取的成本因素,由于可溶性淀粉的价格较昂贵,因此综上分析,选用马铃薯淀粉生产α-环糊精不仅可以降低成本还可以获得高淀粉转化率。

表1 淀粉种类对α-环糊精生产的影响Table 1 Effect of starch type on α-cyclodextrin production
2.3 加酶量对α-CGTase突变体Y89D生产α-环糊精的影响

图2 加酶量对α-环糊精生产的影响Fig.2 Effect of enzyme amount onα-cyclodextrin production
从图2可以看出,α-环糊精的产量随着加酶量的增加先上升后下降,当加酶量达到5~10U/g时,α-环糊精的产量最高,随着加酶量的继续增加,α-环糊精的产量一直下降,而β-环糊精的产量随着加酶量的增加一直上升,加酶量越大,越有利于β-环糊精的生成(数据未列出)。
CGTase是一种多功能型酶,它能催化4种不同的反应:环化反应、偶合反应、歧化反应和水解反应,这4种反应的机理基本相同,仅仅是受体分子不同[7]。1)环化反应:它是CGTase的特征反应,α-(1→4)葡聚糖分子通过分子内糖基转移反应生成环糊精,反应一般从α-(1→4)葡聚糖的非还原性末端开始;2)偶合反应:偶合反应是环化反应的逆反应,它可以将环糊精的环打开,然后转移到葡萄糖和麦芽糖等受体上,其中二糖被认为是最为有效的受体糖,这个反应一般发生在转化后期,这可以解释在淀粉转化为环糊精的过程中,随着反应时间延长产物由α-环糊精向β-环糊精转变的现象,在反应体系中存在高浓度麦芽低聚糖或葡萄糖的情况下容易发生偶合反应[1];3)歧化反应:直链寡糖分子间进行糖基转移的作用,生成重合度不同的各种糖分子,如果底物是淀粉,主要发生在CGTase催化反应的初始阶段,表现为糊化液黏度快速下降;4)水解作用:即CGTase可以在一定程度上催化环糊精的分解。本实验中随着加酶量的增加,相应CGTase的歧化、偶合反应能力也随着增强,反应体系中的小分子糖浓度增加,高浓度小分子糖的存在更有利于发生偶合反应,从而将生成的α-环糊精的环打开,然后转移到小分子糖受体上生成β-环糊精。因此在生产中要控制好CGTase的添加量,尤其是生产α-环糊精时,使加酶量保持在 5~10U/g的范围内,不仅可以提高α-环糊精的产量还可以降低生产成本。
2.4 温度对α-CGTase突变体Y89D生产α-环糊精的影响

表2 温度对α-环糊精生产的影响Table 2 Effect of temperature on α-cyclodextrin production
从表2可以看出,温度对α-糊精产率影响作用比较显著,30℃时,淀粉总转化率最高可达到39%,其中α构型与β构型质量比为65:35,随着温度的继续升高,淀粉总转化率逐渐降低,且α-环糊精在环糊精中的比例也逐渐下降,说明温度越低越有利于α-环糊精的生成。
酶是一种蛋白质,蛋白质一级结构中的氨基酸序列与生物功能密切相关,一级结构的变化往往导致蛋白质生物功能的变化。α-CGTase突变体Y89D相比于野生酶,其一级结构的改变可能会使该酶的热稳定性有所降低,因此低温条件更有利于该酶合成α-环糊精;同时在高温条件下,CGTase的天然构象可能被破坏,酶分子变性失活,所以造成淀粉转化率降低。因此本实验选用30℃作为生产α-环糊精的反应温度。
2.5 pH值对α-CGTase突变体Y89D生产α-环糊精的影响

图3 pH值对α-环糊精生产的影响Fig.3 Effect of pH on α-cyclodextrin production
从图3可以看出,α-CGTase突变体Y89D转化淀粉生成α-环糊精的最适pH值为5.0。pH5.0时,反应6h,Y89D突变体转化淀粉生成的α-环糊精产量最高达到13.5g/L,明显高于其他pH值条件下α-环糊精的产量。随着pH值的继续升高,在pH6.0~8.0范围内,α-环糊精的产量及合成速率相比于pH5.0时都有所下降。当pH值降低到4.0时,α-环糊精的产量最低。pH值之所以对酶催化有很大影响,从酶反应动力学的角度看,很可能是因为它改变了酶活性部位有关基团的解离状态。在最适pH值时,酶分子上活性基团的解离状态最适于酶与底物的结合;而高于或低于最适pH值时,酶活性部位基团解离状态不利于酶与底物的结合,酶活力也相应降低,因此淀粉转化率也很低。另外,pH值除了对酶活性有很大影响外,对酶的稳定性也有很大影响。过高过低的pH值会改变酶的活性中心的构象,甚至改变整个酶分子的结构使其变性失活。因此本实验选用pH5.0作为α-环糊精生产的条件。
2.6 有机溶剂对α-CGTase突变体Y89D生产α-环糊精的影响
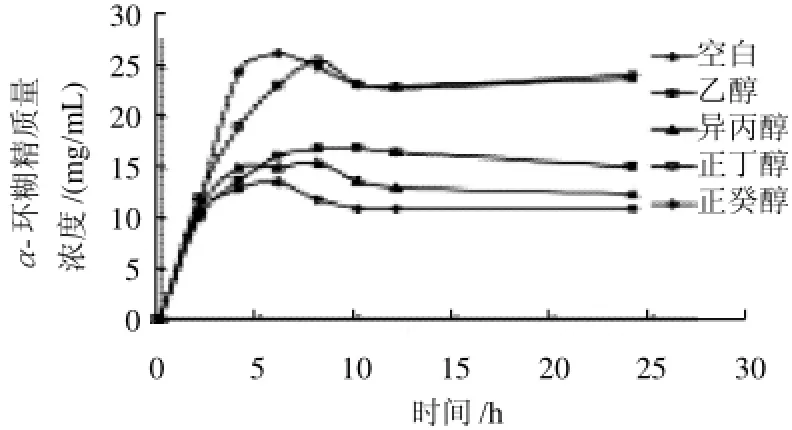
图4 有机溶剂对α-环糊精生产的影响Fig.4 Effect of organic solvent on α-cyclodextrin production
有文献报道[20-22],向反应体系中添加有机溶剂可以提高环糊精的生成量,本实验考察了乙醇、异丙醇、正丁醇、正癸醇对α-环糊精生产的影响,结果如图4所示。
由图4可见,所有有机溶剂都能提高α-环糊精的产量,乙醇和异丙醇对α-环糊精产量的提高不是很明显,而添加正丁醇和正癸醇能显著提高α-环糊精的产量,但是从反应时间看,正癸醇比正丁醇更有利于α-环糊精的生产。添加正癸醇反应6h,α-环糊精的产量即可达到26.5g/L,是未添加有机溶剂时的2倍,此时淀粉的转化率最高达到了60%,是对照组的1.4倍,其中α-环糊精、β-环糊精和γ-环糊精质量比为83:17:0;而添加正丁醇反应8h,α-环糊精的产量才可达到25.7g/L,此时淀粉的转化率最高只有5 9%,其中α-环糊精、β-环糊精和γ-环糊精质量比为79:20:1,因此正癸醇更有利于α-环糊精的生产。
不溶性的有机溶剂如正癸醇能提高环糊精的产量一方面是因为有机溶剂能与生成的环糊精形成不溶性络合物,经过沉淀,连续从反应系统中去除环糊精,改变反应的平衡,使其向着环糊精的生成方向不断进行,有利于环糊精生产;另一方面,环糊精与有机溶剂形成包络物的同时,也解除了环糊精本身的产物抑制,因此反应能不断的进行[17]。对于可溶性的有机溶剂如乙醇、正丁醇等能提高环糊精的转化率也是因为它们能与环糊精形成络合物,但是这些络合物溶于水,为α-环糊精的后期提取造成困难。考虑到工业化生产以及后期提取成本的因素,综上分析,本实验选用正癸醇作为生产α-环糊精的有机溶剂。
2.7 正癸醇添加量对α-CGTase突变体Y89D生产α-环糊精的影响

表3 正癸醇添加量对α-环糊精生产的影响Table 3 Effect of n-decanol amount on α-cyclodextrin production
由表3可见,淀粉总转化率随着正癸醇体积分数的增加先升高后降低,正癸醇体积分数为5%时,反应6h,淀粉总转化率即可达到70%,其中α构型与β构型质量比为85:15,α-环糊精的产量可达到2.76g(体系中总淀粉量为5g)。随着正癸醇体积分数的继续增加,淀粉总转化率反而降低,分析原因可能是因为体系中高浓度的有机溶剂会影响CGTase的稳定性,从而影响淀粉的转化率。 因此综上分析,本实验选用体积分数5%的正癸醇生产α-环糊精。
3 结 论
随着环糊精的应用越来越广泛,对α-环糊精的需求越来越大,因此迫切需要研究α-环糊精的酶转化与制备工艺,国内尚未见相关工艺的报道。本实验研究了利用α-CGTase突变体Y89D制备α-环糊精的工艺。结果表明:选用5g/100mL马铃薯淀粉、pH5.0、温度30℃、加酶量控制在5U/g左右,反应体系中加入体积分数5%的正癸醇,反应时间6h,可获得70%的淀粉总转化率,其中α-环糊精在产物中约占85%,转化产物中只含有少量β-环糊精(15%),而极少生成γ-环糊精,高于国内报道的最高转化率与比例[7-8]。这说明该突变体非常适合α-环糊精的工业化生产,具有广阔的实际应用前景。同时该工艺流程简单,生产周期短,反应6h即可获得较高的α-环糊精转化率,并且降低了α-环糊精的生产成本,这为利用该突变体工业化生产α-环糊精的后续研究奠定了良好的基础。
[1]UITDEHAAG J, van der VEEN A, LUBBERT D, et al. Catalytic mechanism and product specificity of cyclodextrin glycosyltransferase, a prototypical transglycosylase from the α-amylase family[J]. Enzyme and Microbial Technology, 2002, 30(3): 295-304.
[2]BENDER H. Production characterization and application of cyclodextrin [J]. Advances in Biotechnological Processes, 1986(6): 31-71.
[3]PRAMILA R, SURESH C, NARASIMHA R D, et al. Digestion of residualβ-cyclodextrin in treated egg using glucoamylase from a mutant strain of Aspergillus niger[J]. Food Chemistry, 1999, 65(3): 297-301.
[4]田辉, 杨国武, 徐颐玲, 等. 环状糊精与环状糊精葡萄糖基转移酶[J].工业微生物, 1995, 25(2): 33-38.
[5]LI Zhaofeng, WANG Miao, WANG Feng, et al. Gamma-cyclodextrin: A review on enzymatic production and applications[J]. Appl Microbiol Biotechnol, 2007, 77(2): 245-255.
[6]汪家铭. 环状糊精生产应用及市场前景[J]. 武汉化工, 1998(2): 3-4.
[7]陈龙然, 康培, 冯明光, 等. 一株产环糊精葡萄糖基转移酶的地衣芽孢杆菌的选育、产酶条件及酶学特性[J]. 微生物学报, 2005, 45(1): 97-101.
[8]王俊英, 钞亚鹏, 关东明, 等. 一种α-环糊精葡萄糖基转移酶的纯化及性质研究[J]. 中国生物工程杂志, 2008, 28(7): 67-70.
[9]van der VEEN B A, UITDEHAAG J C M, DIJKSTRA B W, et al. The role of arginine 47 in the cyclization and coupling reactions of cyclodextrin glycosyltransferase from Bacillus circulans strain 251 implications for product inhibition and product specificity[J]. Eur J Biochem, 2000, 267 (12): 3432-3441.
[10]SIN K A, NAKAMURA A, MASAKI H, et al. Replacement of an amino acid residue of cyclodextrin glucanotransferase of Bacillus ohbensis doubles the production ofγ-cyclodextrin[J]. J Biotechnol, 1994, 32(3): 283-288.
[11]van der VEEN B A, UITDEHAAG J C, PENNINGA D, et al. Rational design of cyclodextrin glycosyltransferase from Bacillus circulans strain 251 to increaseα-cyclodextrin production[J]. J Mol Biol, 2000, 296 (4): 1027-1038.
[12]STROKOPYTOV B, KNEGTEL R M, PENNINGA D, et al. Structure of cyclodextrin glycosyltransferase complexed with a maltononaose inhibitor at 2.6 angstrom resolution. Implications for product specificity [J]. Biochemistry, 1996, 35(13): 4241-4249.
[13]WIND R D, UITDEHAAG J C, BUITELAAR R M, et al. Engineering of cyclodextrin product specificity and pH optima of the thermostable cyclodextrin glycosyltransferase from Thermoanaerobacterium thermosulfurigenes EM1[J]. J Biol Chem, 1998, 273(10): 5771-5779.
[14]LI Zhaofeng, ZHANG Jiayu, WANG Miao, et al. Mutations at subsite-3 in cyclodextrin glycosyltransferase from Paenibacillus macerans to enhanceα-cyclodextrin specificity[J]. Appl Microbiol Biotechnol, 2009, 83(3): 483-490.
[15]LI Zhaofeng, LI Bin, GU Zhengbiao, et al. Extracellular expression and biochemical characterization ofα-cyclodextrin glycosyltransferase from Paenibacillus macerans[J]. Carbohydrate Research, 2010, 345(7): 886-892.
[16]GAWANDE B, PATKAR A. Alpha-cyclodextrin production using cyclodextrin glycosyltransferase from Klebsiella pneumoniae AS-22[J]. Starch-, 2001, 53(2): 75-83.
[17]FLASCHEL E, LANDERT J P, SPIESSER D, et al. The production of α-cyclodextrin by enzymatic degradation of starch[J]. Annals of the New York Academy of Sciences, 1984, 434: 70-77.
[18]LEE J H, CHOI K H, CHOI J Y, et al. Enzymatic production of αcyclodextrin with the cyclomaltodextrin glucanotransferase of Klebsiella oxytoca 19-1[J]. Enzyme and Microbial Technology, 1992, 14(12): 1017-1020.
[19]SAKINAHA A M M, ISMAILB A F, HASSAND O, et al. Influence of starch pretreatment on yield of cyclodextrins and performance of ultrafiltration membranes[J]. Desalination, 2009, 239(1/3): 317-333.
[20]SHIEH W, HEDGES A. Process for producingα-cyclodextrin using cyclomaltodextrin glucanotransferase in presence of cyclohexane: US, 5326701[P]. 1994-07-05.
[21]BLACKWOOD1 A D, BUCKE C. Addition of polar organic solvents can improve the product selectivity of cyclodextrin glycosyltransferase solvent effects on CGTase[J]. Enzyme and Microbial Technology, 2000, 27(9): 704-708.
[22]LEE Y D, KIM H S. Effect of organic solvents on enzymatic production of cyclodextrins frorn unliquefied corn starch in an attrition bioreactor[J]. Biotechnology and Bioengineering, 1992, 39(10): 977-983.
Preparation ofα-Cyclodextrin by Mutation Y89D of Cyclodextrin Glycosyltransferase from Paenibacillus macerans
WANG Ning1,2,WU Dan1,2,CHEN Sheng1,2,CHEN Jian1,2,WU Jing1,2,*
(1. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, China;2. Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, China)
The factors for preparingα-cyclodextrin by mutation Y89D of α-cyclodextrin glycosyltransferase (α-CGTase) were investigated. The factors include starch types (potato, corn, cassava and soluble starch), enzyme amount, reaction time, pH, organic solvents (ethanol, isopropanol, n-butanol and n-decanol) and temperature. Results indicated that the optimal conditions were 5 g/100 mL potato starch, 5 U/g CGTase, pH 5.0, 30 ℃, 5% n-decanol and reaction time of 6 h. Under the optimal conditions, 70% conversion rate of starch to cyclodextrins was achieved, which included 85% α-cyclodextrin, 15% β-cyclodextrin and trace γ-cyclodextrin. Therefore, the mutation Y89D of α-CGTase has promising industrial application prospect.
α-cyclodextrin;α-cyclodextrin glycosyltransferase;organic solvent;conversion rate
Q814.9;TS202
A
1002-6630(2011)03-0165-06
2010-04-29
国家杰出青年基金项目(20625619);食品科学与技术国家重点实验室科研基金项目(SKLF-MB-200802);国家“973”项目(2007CB 714036)
王宁(1987—),女,硕士研究生,研究方向为工业酶技术。E-mail:wangwang-115566@163.com
*通信作者:吴敬(1969—),女,教授,博士,研究方向为基因工程和分子酶学工程。E-mail:jingwu80@hotmail.com

