环介导等温扩增法快速检测耐甲氧西林金黄色葡萄球菌
朱 丽,霍贵成*
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
环介导等温扩增法快速检测耐甲氧西林金黄色葡萄球菌
朱 丽,霍贵成*
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
建立一种应用环介导等温扩增(loop-mediated isothermal amplification,LAMP)方法快速检测耐甲氧西林金黄色葡萄球菌(methicillin-resistan Staphylococcus aureus,MRSA)中mecA和spa基因的检测方法。以金葡菌和其他相关菌种为试验对象,分别用聚合酶链式反应(ploymerase chain reaction,PCR)和LAMP方法检测mecA和spa基因。结果表明:LAMP法在64℃等温条件下可在60min内成功扩增基因,且与传统PCR方法结果相同;通过琼脂糖凝胶电泳可知,LAMP对mecA和spa基因的检测限分别为每菌管102个和10个细胞;肉眼可检测到的mecA和spa基因的检测限分别为每菌管103个和10个细胞;然后用LAMP法检测人工污染原料乳样本中MRSA,用LAMP法检测原料乳中的mecA和spa基因与PCR方法显示出相同的结果。LAMP方法可快速检测mecA和spa基因,此方法可应用于原料乳中MRSA的检测。
环介导等温扩增(LAMP);mecA基因;耐甲氧西林金黄色葡萄球菌(MRSA);肉眼检测;spa基因
抗生素的广泛使用,一方面对治疗细菌感染起到了至关重要的作用,另一方面又导致了多种耐药菌株的出现。由于人们对抗生素缺乏科学的认识,盲目使用和依赖致使细菌获得耐药性的机率大大增加,因此耐药菌株的检出呈逐年上升的态势,严重威胁着人们的生命安全[1]。耐药细菌所致的感染性疾病己构成对新世纪抗感染治疗的新挑战。及时准确地掌握细菌耐药机制,建立耐药菌株的快速检测方法,对指导临床合理用药和新的抗菌药物的研制具有重要意义。
金黄色葡萄球菌(Staphylococcus aureus,SAU)是重要的病原菌,其中,耐甲氧西林金黄色葡萄球菌(methicillin-resistan Staphylococcus aureus,MRSA)是目前引起感染性疾病的重要致病菌与研究的热点,目前在临床上己发现耐万古霉素及对万古霉素中度敏感的金黄色葡萄球菌出现,由于它的高度耐药性,己成为医院感染的主要致病菌之一[2]。由于金黄色葡萄球菌不会引起动物的死亡或者是立即发病,所以在动物上的重视程度不够,但随着人们生活水平的提高,人们对乳制品的质量也有了更高的要求,近年来有关MRSA的研究也逐渐增多[3]。已有研究表明动物源性耐甲氧西林金黄色葡萄球菌已经在人群中出现[4],且已证实我国牛群中有耐甲氧西林金黄色葡萄球菌感染[5]。
mecA基因只存在于耐甲氧西林金黄色葡萄球菌中,且高度保守,根据其核苷酸序列设计不同的引物,用PCR对菌株中青霉素结合蛋白2a(penicillin binding protein 2a,PBP2a)靶DNA特定片段mecA进行扩增,发展了快速检测葡萄球菌中耐甲氧西林菌株的分子诊断技术。美国国家临床实验室标准化委员会(national committee for clinical laboratory standards,NCCLS)指出,一旦金黄色葡萄球菌检出mecA基因或PBP2a蛋白即可定为MRSA[6]。Song等[7]已获得了mecA基因的克隆,其序列也已发布。目前,RT-PCR已广泛应用于检查mecA基因[8]。一般而言,与常规培养方法相比,PCR方法可以相对快速、简单的方式完成检测,但是PCR方法需要特殊的仪器,如循环变温加热器。
环介导等温扩增(loop-mediated isotherm al amplification,LAMP)方法首先由Notomi等[9]在2000年发明。LAMP法可在60~65℃等温的条件下进行,且其特异性可归因于能够识别6个不同序列的四条引物。在等温的条件下连续扩增可在30~60min内产生大量的目标DNA,并且此方法可用肉眼通过在反应混合物中加入SYBR greenⅠ颜色的变化判断DNA的扩增[10]。由于本方法仅需要一种类型的酶,且不需要特殊的仪器,LAMP将适用于现场检测原料乳中金黄色葡萄球菌对甲氧西林的耐药性。本研究应用LAMP法同时检测培养细胞和实际样本中的mecA基因,此外,蛋白A (staphylococcal protein A,spa)是金黄色葡萄球菌细胞壁的一个组成部分,是SAU的种特异基因[11],还应用LAMP检测了spa基因。
1 材料与方法
1.1 材料、试剂与仪器
金黄色葡萄球菌(Staphylococcus aureus ATCC25923甲氧西林敏感)、大肠杆菌(E s c h e r i c h i a c o l i ATCC25922)、铜绿假单胞菌(Pseudomonas aeruginosa ATCC27853) 黑龙江省应用微生物研究所;沙门氏菌(Salmonella sp CGMCC 1.155 2)、荧光假单胞菌(Pseudomonas fluorescence CGMCC 1.1802)、恶臭假单胞菌(Pseudomonas putida CGMCC1.1819) 中国普通微生物菌株保藏中心;福氏志贺氏菌(Shigella fleχneri 51571-10)、痢疾志贺氏菌(Shigella dysenteriae 51253)、大肠杆菌(Escherichia coli O157∶H7 ATCC 43889)、单增李斯特菌(Listeria monocytogenes HJ-350) 黑龙江省出入境检验检疫局;ETEC∶ 44247(615∶16)、EPEC∶44706(111∶58)、单增李斯特菌(Listeria monocytogenes CMCC 54002) 医学微生物菌种保藏管理中心;耐甲氧西林金黄色葡萄球菌(methicillin-resistan Staphylococcus aureus,MRSA ATCC43300) 温州康泰生物有限公司;沙门氏菌(Salmonella e nterica AT CC13076)、蜡样芽孢杆菌(Bacillus cereus KLDS71)、瑞士乳杆菌(Lactobacillus helveticus KLDS-8 )、乳酸乳球菌(Lactococcus lactis KLDS-36)、嗜热链球菌(Streptococcus th ermophilus KLDS )、双歧杆菌(Lactobacillus bifidus KLDS) 本实验室保藏;BstDNA聚合酶(New England Biolab)、DNA markerDL2000 大连宝生物工程有限公司。
SYBR GreenⅠ 日本Takara Bio公司;DYY-10C型电泳仪 北京市六一仪器厂;UVP凝胶成像仪 美国UVP公司。
1.2 方法
1.2.1 培养条件
MRSA培养于添加苯唑西林的高盐甘露醇(6mg/mL)的琼脂平板,37℃培养48h。甲氧西林敏感金黄色葡萄球菌(MSSA)培养于甘露醇盐琼脂;大肠杆菌培养于LB肉汤;沙门氏菌培养于缓冲蛋白胨水(BPW);单核增生李斯特菌培养于含0.6%酵母浸膏的胰酪胨大豆肉汤(TSB-YE);荧光假单胞菌、恶臭假单胞菌、蜡样芽孢杆菌培养于普通的营养肉汤培养基中;志贺氏菌培养于GN增菌液;瑞士乳杆菌、乳酸乳球菌、嗜热链球菌、双歧杆菌培养于MRS培养基。
1.2.2 mecA基因表型检测
在血琼脂平板上连续分纯3次得到单个菌落,根据NCCLS推荐的头孢西丁纸片扩散法检测,若抑菌圈直径小于等于19mm,则判断为MRSA,苯唑西林的最低抑菌浓度(minimum inhibitory concentration,MIC)采用琼脂稀释法。
1.2.3 DNA提取
培养菌株使用热解法进行DNA提取,原料乳样本先采用三氯乙酸法进行处理,再用热裂解法提取DNA。简单地说,将获得的菌株接种于10mL营养肉汤中37℃培养过夜,取5mL细菌菌液置于5mL离心管中,10000r/min离心5min,弃去上清液,加5mL裂解液,100℃水浴10min后,15000r/min离心5min,上清液作为DNA模板,-20℃保存备用[12-13]。
1.2.4 聚合酶链式反应检测mecA和spa基因
应用已有文献报道的特异引物及反应条件进行聚合酶链式反应(polymerase chain reaction,PCR)扩增mecA基因和spa基因[6,14],这些引物的序列如下:mecA正向引物(mA1):5'-TGCTATCCACCCTCAAAC AGG-3';m e c A反向引物(m A 2):5'-A A C G T T G T A ACCACCCCAAGA-3';spa正向引物(1095F):5'-GACGATC CTTCAGTGAGCAAAG-3';spa反向引物(1517R):5'-GCAGCAATTTTGTCAGCAGTA-3'。将PCR产物进行2%琼脂糖凝胶电泳。
1.2.5 LAMP反应
应用已有文献[14]报道的特异引物及反应条件进行LAMP扩增mecA基因和spa基因。每组包括4条引物,一个正向内引物(FIP)、一个反向内引物(BIP)和两个外引物(F3和B3)(表1)。

表1 LAMP扩增mecA和spa引物Table 1 Primers for LAMP amplification of mecA and spa genes
LAMP反应体系共25μL。反应混合物包括FIP、BIP各40pmol,F3、B3各5pmol,2μL模板,1μL BstDNA聚合酶(8U),1.6mmol/L dNTPs,0.8mmol/L betaine,4mmol/L MgSO4,20mmol/L Tris-HCl(pH8.8),10mmol/L KCl,10mmol/L (NH4)2SO4,混匀。反应在64℃等温条件下扩增60min。保温完成后将反应混合物在80℃反应5min结束反应。
1.2.6 LAMP产物的检测
LAMP产物通过肉眼或琼脂糖凝胶电泳检测。对于肉眼检测,在反应混合物中加入1μL 10-1稀释的SYBR GreenⅠ,且颜色变化可在自然光下观察到。对于电泳检测,2μL反应混合物加入到2%的琼脂糖凝胶电泳。凝胶剂与染色剂溴化乙啶(50μg/mL)混合,在紫外灯(302nm)下进行照相。
1.2.7 原料乳样品的检测
采用本实验建立的LAMP方法对采自农场的原料乳进行实际样品检测,同时对实际样本进行药敏试验、PCR检测,并与这两种方法进行对比,确定LAMP直接检测乳品中金黄色葡萄球菌的特异性、灵敏度。
2 结果与分析
2.1 MRSA检出情况
所购买金黄色葡萄球菌经头孢西丁检测其抑菌圈直径平均值为14mm(小于19mm),为MRSA(图1a),质控菌株大肠杆菌ATCC 25922直径平均值为24mm(图1b),MSSA直径平均值为29mm(图1c)。

图1 药敏试验结果Fig.1 Antimicrobial activity of cefoxitin against methicillin-resistant Staphylococcus aureus and E. coli
2.2 LAMP反应的特异性
对19株培养菌株进行LAMP mecA基因和spa基因特异性检测。提取DNA样本(菌液浓度为108CFU/mL),琼脂糖凝胶电泳检测LAMP产物。电泳检测的结果见图2。LAMP成功地扩增出了MRSA中的mecA基因,其他测试菌株未发生扩增。LAMP反应也成功地扩增了MRSA和MSSA中的spa基因,同时用相同的DNA样本采用常规PCR方法进行mecA和spa基因检测。PCR结果与LAMP结果一致(图2和表2)。

图2 LAMP和PCR方法分别检测mecA和spa基因的的特异性实验结果Fig.2 Specificity of LAMP and PCR for mecA and spa gene detection
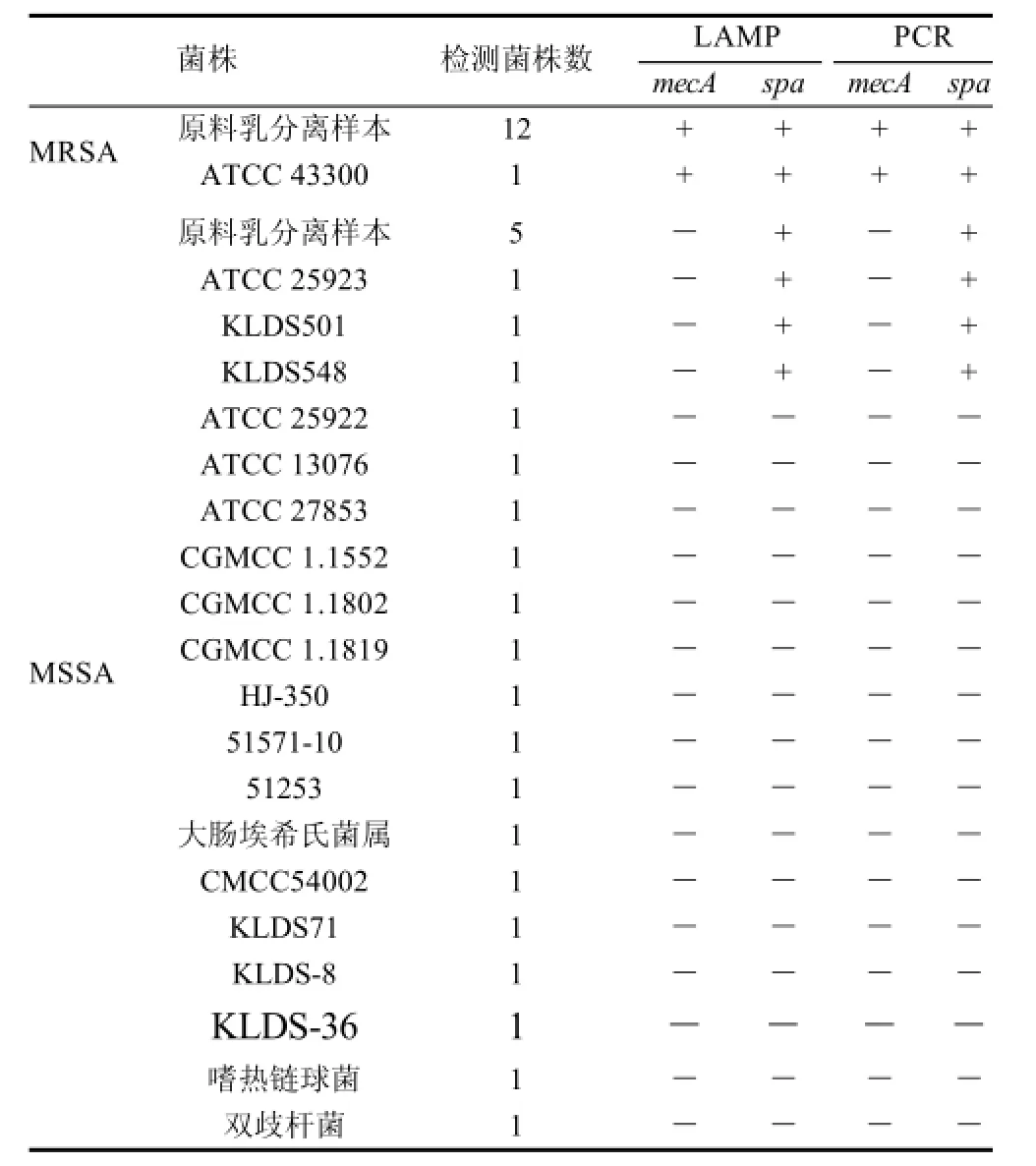
表2 原料乳及相关菌株中mecA和spa基因检测结果Table 2 Detection of mecA and spa genes in MRSA strains and other relevant bacteria
2.3 LAMP和常规PCR方法的检测限
以提取自梯度稀释的MRSA菌株(ATCC 43300)的DNA为模板,确定LAMP反应检测限,通过电泳和肉眼两种检测方法进行产物检测。由图3可知,LAMP检测mecA的检测限小于102CFU(图3a),spa的检测限小于10CFU(图3b)。肉眼检测结果见图4。

图3 LAMP法检测mecA和spa基因的检测限和传统PCR方法检测结果Fig.3 Detection limits of LAMP and conventional PCR method for mecA and spa genes
当DNA样本浓度高于103CFU/mL时,通过添加SYBR GreenⅠLAMP检测mecA反应混合物的颜色呈现为绿色,反之,当细胞数小于102CFU/mL时,最初的橙黄色未改变(图4a)。同样,肉眼检测对于spa的检测限也适用于细胞数为10CFU/mL的情况(图4b)。与LAMP方法一样,采用热裂解法提取菌体DNA,常规PCR方法对于mecA基因和spa基因的检测限细胞数见图3,分别为106、106、107CFU。

图4 肉眼检测LAMP扩增mecA(a)和spa(b)Fig.4 Naked-eye observation of LAMP amplified mecA (a) and spa (b) genes
2.4 应用LAMP法检测原料乳样本中的金黄色葡萄球菌
原料乳样本的mecA和spa基因采用LAMP方法检测。同时也应用传统方法及常规PCR方法进行检测,并将LAMP法与这两种方法的结果进行比较(表3、4)。收集东北农业大学原生态牧场及个体散户原料乳125份,LAMP法检测出了82份样品中含有spa基因(65.6%),12份原料乳样本中检测出mecA基因(14.6%)。LAMP方法与常规PCR方法对原料乳样本的检测结果100%一致(表3),国标法共检测出85份样品为阳性(68%),同时也采用传统方法——K-B药敏试验法对MRSA进行检测,其与LAMP检测结果比较见表4、5。
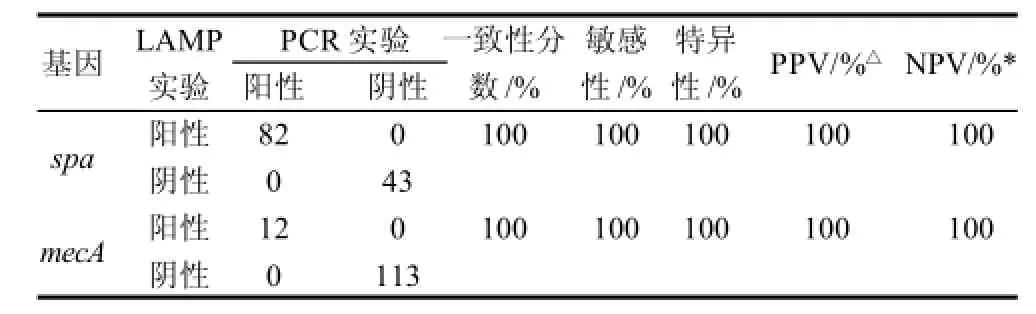
表3 原料乳样本mecA、spa基因检测结果Table 3 Detection of mecA and spa in raw milk samples

表4 L AMP法检测原料乳中MSSA、MRSA的实用性评价Table 4 Practical evaluation of LAMP for quantitative determination of Staphylococcus aureus in raw milk

表5 LAMP法与K-B法药敏试验检出个数比较Table 5 Comparison of mecA gene positive detection rate of LAMP and K-B methods
由表5可知,LAMP法与K-B药敏试验结果相比,LAMP阳性一致率为91.67%。
3 讨 论
由于牧场使用抗生素的量日益增加,所以必须对MRSA菌株抗生素耐药性加以重视。PCR方法是一种快速检测微生物的分子技术,然而,往往由于缺乏设备,尤其对现场检测来说,该方法常常很难实施。因此,对于乳品安全来说发展一种快速、简单的检测抗生素耐药性的方法十分必要。mecA是MRSA耐药决定基因,91.7%的MRSA含mecA[3]。在本研究中,应用LAMP方法进行mecA和spa基因检测。
传统的培养方法需要24~48h,PCR方法需要2~4h的反应时间,LAMP反应可在60min内完成。与这些方法相比,应用LAMP方法检测mecA和spa基因具有明显的优势——快速。然而,以PCR方法为基础发展起来的Rt-PCR也拥有快速的优势。尽管需要昂贵的仪器,但是通过加入SYBR Green化学物,完成该反应与LAMP方法所需要的花费相似[15]。检验员需要根据检测的目的和现场检测环境选择合适的方法。
LAMP方法由于其特殊设计的2条内引物和两条外引物以识别6个不同区域的序列而具有明显的特异性。使用培养的细胞进行特异性检验,LAMP方法检测mecA和spa基因和预期的一样具有高度特异性。LAMP方法与传统的PCR方法结果完全一致。
通过琼脂糖凝胶电泳,LAMP检测mecA和spa基因的检测限分别为小于103、10CFU,然而,为了适宜于现场检测对DNA快速、简便提取的需求,对于PCR方法也应用热裂解提取的菌体DNA为模板进行扩增,结果其检测mecA和spa基因的检测限分别为小于106、107CFU,这充分说明LAMP方法在DNA模板纯化方面的优越性。但是,本实验在对原料乳样本的实际检测时采用试剂盒提取的菌体DNA作为PCR扩增的模板,此时PCR扩增结果与LAMP结果相同。因此,LAMP方法与PCR方法相比其灵敏性基本相当或高于PCR方法。并且LAMP反应可通过加入环引物加快反应的进行,并提高灵敏度。
肉眼检测LAMP扩增spa基因的产物与电泳检测结果具有相同的灵敏度(每管细胞数为10 CF U),然而LAMP对mecA基因检测的灵敏度下降到103CFU。通过延长反应时间,肉眼检测mecA基因的扩增结果的灵敏度可提高到102CFU。对于LAMP方法来说相当简单、快速的肉眼检测办法将会很有应用价值。
对于实际原料乳样本的检测,LAMP方法和PCR方法结果相同,这表明实际应用该方法检测原料乳样本的可能性。本研究中DNA的提取是采用简单的煮沸法。原料乳样本的分析对于揭示抗生素耐药性的携带与乳房炎的关系具有重要的检测意义。
用本研究所建立的检测方法对所收集的125份样品进行检测,新建方法的阳性检出率为91.67%。其中两株mecA为阳性,而耐药性为阴性,这种现象说明mecA表达PBP2a所致耐药性,还受到其他基因的调控。另有一株常规药敏试验鉴定为MRSA,而LAMP基因检测mecA为阴性,随后用培养的菌落进行同样的基因检测,结果mecA为阳性,说明热裂解法提取金黄色葡萄球菌DNA时,可能对样品中细菌量少的细菌可能落检[16]。
LAMP反应检测mecA和spa基因均在1h内完成,且具有高度的特异性和灵敏性。此外,由于可通过肉眼进行检测,LAMP方法具有明显的简单、快速的优势。本研究所建立的LAMP检测方法很有潜力成为检测mecA和spa基因的有力工具。
[1]李静媚, 凌玲, 杨坤祥. 食品中金黄色葡萄球菌的耐药性分析[J]. 职业与健康, 2009, 25(3)∶ 255-256.
[2]HIRAMATSU K, HANAKI H, INO T, et a1. Methicillin-resistant Staphylococcus aureus clinical train with reduced vancomycin susceptibility[J]. J Antimicrob Chemother, 1997, 40(1)∶ 135-136.
[3]刘君, 陈创夫, 褚明亮. 牛源耐甲氧西林金黄色葡萄球菌的分离鉴定[J]. 动物医学进展, 2008, 29(9)∶ 42-44.
[4]邓艳琴. 美国《Emerging Infectious Diseases》2007年第12期有关人兽共患病论文摘译[J]. 中国人兽共患病学报, 2008, 24(2)∶ 90.
[5]谭磊. 基于PCR的牛源金黄色葡萄球菌基因分型研究[D]. 大庆∶ 黑龙江八一农垦大学, 2008.
[6]胡继红, 高振翔, 尹铭芳. 美国NCCLS 2002年版抗生素药敏试验操作标准更新内容[J]. 中华检验医学杂志, 2002, 25(6)∶ 367.
[7]SONG M D, WACHI M, DOI M, et a1. Evolution of an inducible penicillin-target protein in methicillin-resistant Staphylococcus aureus by gene fusion[J]. FEBS Lett, 1987, 221(1)∶ 167-171.
[8]MAKGOTLHO P E, KOCK M M, HOOSEN A, et al. Molecular identification and genotyping of MRSA isolates[J]. FEMS Immunol Med Microbio, 2009, 57(2)∶ 104-115.
[9]NOTOMI T, OKAYAMA H, MASUBUCH H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Res, 2000, 28(13)∶63.
[10]IWAMOTO T, SONOBE T , HAYASHI K. Loop-mediated isothermal amplification for direct detection of Mycobacterium tuberculosis complex, M. avium, and M. intracellulare in sputum samples[J]. J Clin Microbiol, 2003, 41(6)∶ 2616-2622.
[11]HALLIN M, FRIEDRICH A W , STRUELENS M J. Spa typing for epidemiological surveillance of Staphylococcus aureus[J]. Methods Mol Biol, 2009, 551∶ 189-202.
[12]ENOSAWA M, KAGEYAMA S, SAWAI K, et al. Use of loop-mediated isothermal amplification of the IS900 sequence for rapid detection of cultured Mycobacterium avium subsp. paratuberculosis[J]. J Clin Microbiol, 2003, 41(9)∶ 4359-4365.
[13]AKEMI Y, RIKA I, RIE H. Rapid and sensitive detection of heat-labileⅠand heat-stableⅠenterotoxin genes of enterotoxigenic Escherichia coli by loop-mediated isothermal amplification[J]. J Microbiological Methods, 2007, 68(2)∶ 414-420.
[14]SHOPSIN B, GOMEZ M, MONTGOMERY S O, et al. Evaluation of protein A gene polymorphic region DNA sequencing for typing of Staphylococcus aureus strains[J]. J Clin Microbiol, 1999, 37(11)∶ 3556-3563.
[15]KOIDE1 Y, MAEDA1 H, YAMABE1 K, et al. Rapid detection of mecA and spa by the loop mediated isothermal amplification (LAMP) method [J]. J Letters in Applied Microbiology, 2010, 50(4)∶ 386-392.
[16]SILVERMAN G J, GOODYEAR C S, SIEGEL D L. On the mechanism of staphylococcal protein A immunomodulation[J]. Transfusion, 2005, 45(2)∶ 274-280.
Rapid Detection of Methicillin-resistant Staphylococcus aureus by Loop-mediated Isothermal Amplification
ZHU Li,HUO Gui-cheng*
(Key Laboratory of Dairy Science, Ministry of Education, Northeast Agricultural University, Harbin 150030, China)
A rapid assay was developed for the detection of mecA and spa gene present in methicillin-resistant Staphylococcus aureus (MRSA) using loop-mediated isothermal amplification (LAMP). Staphylococcus aureus and other relevant bacteria were detected for their mecA and spa genes by both polymerase chain reaction (PCR) and LAMP methods. Gene amplification was successfully achieved by LAMP within 60 min when the temperature was held at 64 ℃, and the results were consistent results with those of the conventional PCR methods. The limits of detection of the LAMP method for mecA and spa genes were identified by agarose gel electrophoresis to be 102and 10 cells per tube and observed by naked eyes to be 103and 10 cells per tube respectively. The LAMP method was then applied to artificially polluted raw milk, and gave identical results with the traditional PCR methods. LAMP can rapidly detect mecA and spa genes, thus providing an applicable assay for detecting MRSA in raw milk.
loop-mediated isothermal amplification (LAMP);mecA gene;methicillin-resistant Staphylococcus aureus (MRSA);naked-eye observation;spa gene
TS207.4
A
1002-6630(2011)16-0213-06
2010-10-17
“十一五”国家科技支撑计划项目(2006BD04A08)
朱丽(1985—),女,硕士研究生,研究方向为乳品科学。E-mail:thpzhuli@163.com
*通信作者:霍贵成(1958—),男,教授,博士,研究方向为乳品科学。E-mail:gchuo58@126.com

