超声提取鼠尾草叶多糖工艺优化及其DPPH自由基清除能力评价
祝元婷,吴文林,张 利*,刘 琪
(四川农业大学生命科学与理学院,四川 雅安 625014)
超声提取鼠尾草叶多糖工艺优化及其DPPH自由基清除能力评价
祝元婷,吴文林,张 利*,刘 琪
(四川农业大学生命科学与理学院,四川 雅安 625014)
以鼠尾草(Salvia officinalis L.)叶为材料,采用单因素试验和正交试验,探讨超声提取其多糖的最佳工艺条件,并利用1,1-二苯基苦基苯肼(DPPH)自由基清除法评价该多糖的自由基清除能力。结果表明:超声提取多糖的最佳工艺条件为:提取时间7min、提取2次、料液比1∶40,在此条件下鼠尾草叶多糖的提取率为3.27%。同时该多糖对DPPH自由基有较好的清除作用,当质量浓度为160μg/mL时,清除率达到82%,并且对DPPH自由基清除能力IC50为112μg/mL。
鼠尾草;多糖;超声提取;1,1-二苯基苦基苯肼(DPPH)
唇形科(Lamiaceae)鼠尾草属植物鼠尾草(Salvia officinalis L.),又名撒尔维亚、厨房鼠尾草、达尔马希亚鼠尾草,为多年生草本植物,原产于欧洲地中海地区[1]。在国外,广泛饮用“鼠尾草茶”,并常常将其作为厨房用的香草,用作防腐、烹饪的调味料等。
根据国外研究结果,鼠尾草具有防腐抗菌[2]、抗氧化[3]、抗突变[4]、保护肠胃[5]、消炎[6-7]和调节免疫[8]等作用,其多糖具有免疫[8-10]、抗氧化[11]等活性。我国从20世纪80年代开始在上海、北京等地引种鼠尾草,并对其精油抗菌活性[12]、叶提取物抗氧化作用[13]等进行一些研究,但尚未见国内关于鼠尾草多糖的研究。
目前,国外已有对鼠尾草叶多糖的研究,采用传统的热水浸提法提取[14]。近年来,超声波、微波、酶等提取方法,已广泛应用于多糖的提取[15]。本实验采用超声提取法对鼠尾草叶多糖的提取工艺进行研究,并评价其DPPH自由基清除能力,旨在为鼠尾草天然保健品的开发利用提供一定理论基础。
1 材料与方法
1.1 材料与试剂
鼠尾草,由美国国家种质资源库(national plant germplasm system,NPGS)提供,四川农业大学生命科学与理学院植物学教研室鉴定为唇形科植物鼠尾草(Salvia officinalis);DPPH(分析纯) 美国Sigma公司;甲醇、氯仿、乙醇和正丁醇(均为分析纯) 成都科龙化工有限公司;实验用水均为超纯水(电阻率≥18 MΩ·cm)。
1.2 仪器与设备
中药粉碎机 天津泰格斯仪器有限公司;UV-3200PC紫外分光光度计 上海美谱达仪器有限公司;JP99-2D超声波细胞粉碎仪 宁波新芝生物科技股份有限公司;RE-52AA旋转蒸发仪 上海亚荣生化设备仪器有限公司;SHZ-D(Ⅲ)型循环水真空泵 浙江黄岩求精真空泵厂。
1.3 多糖的提取及含量测定
鼠尾草叶60℃烘干、粉碎,过60目筛;甲醇∶氯仿(10∶1,V/V)回流5h;挥干溶剂,继续用80%乙醇回流5h,干燥粉碎备用;准确称取0.5g(精确至0.1mg)材料粉末,加入超纯水,使用超声波粉碎仪提取,提取液定容至100mL,即得多糖提取液。苯酚-硫酸法[16]测定多糖含量,以葡萄糖为标准物,用UV-3200PC紫外可见分光光度计作比色分析。
1.4 影响多糖提取率的单因素和正交试验
1.4.1 不同提取时间对多糖提取率的影响
采用料液比1∶50,提取次数3次,提取时间分别为1、2、3、4、5、6、7、8 m i n,以鼠尾草叶多糖提取率为评价指标,考察不同提取时间对鼠尾草叶多糖提取率的影响。
1.4.2 不同提取次数对多糖提取率的影响
采用料液比1∶50,提取时间5min,提取次数分别为1、2、3、4、5、6次,以鼠尾草叶多糖提取率为评价指标,考察不同提取次数对鼠尾草叶多糖提取率的影响。
1.4.3 不同料液比对多糖提取率的影响
采用提取时间5min,提取次数3次,料液比分别为1∶20、1∶30、1∶40、1∶50、1∶60,以鼠尾草叶多糖提取率为评价指标,考察不同料液比对鼠尾草叶多糖提取率的影响。
1.4.4 鼠尾草叶多糖提取工艺正交试验
在单因素试验基础上,以超声提取时间、提取次数和料液比为3因素,各取3个水平,用L9(34)正交表进行试验,以鼠尾草叶多糖提取率为评价指标,确定提取鼠尾草叶多糖的最佳提取工艺。
1.5 DPPH自由基清除活性
1.5.1 鼠尾草叶多糖的纯化
称取50g材料,按最佳工艺进行超声提取。将提取液按Y a n g等[17]报道方法纯化:将提取液浓缩至400mL,并加入95%(V/V)的乙醇水溶液,醇沉,于4℃放置12h。所得粗多糖沉淀用100mL水进行溶解,用Sevag法除蛋白,脱蛋白溶液用超纯水透析48h,然后用4倍体积的95%乙醇溶液再沉淀。沉淀物分别采用无水乙醇和丙酮进行洗涤,然后干燥得多糖样品,备用。
1.5.2 清除率测定
参考Capek等[11]方法测定DPPH自由基清除率,并以VC作为阳性对照。将多糖和VC溶于水中,并分别配制成6个梯度的多糖和VC溶液(10、20、40、80、160、320μg/mL),分别取2mL上述溶液和2mL DPPH溶液(0.08mg/mL)于三角瓶中,混合摇匀,室温下静置30min,在517nm处以空白作对照测定吸光度。自由基清除能力按如下公式进行计算:

式中:ADPPH为未加入多糖样品或VC的DPPH溶液的吸光度;A样品为DPPH溶液加多糖样品或VC后的吸光度。
2 结果与分析
2.1 超声提取鼠尾草叶多糖单因素试验
2.1.1 超声提取时间对多糖提取率的影响

图1 超声时间(A)、提取次数(B)和料液比(C)对多糖提取的影响Fig.1 Effects of ultrasonic treatment time, number of extractions and material-to-liquid ratio on polysaccharide yield
由图1A可知,随着提取时间的增加,多糖的提取率提高,在提取时间6min时,多糖提取率最高。当提取时间大于6min后,多糖提取率不再增加,反而有所降低。这可能是因为随着时间的延长,由于超声波的空化效应,固液扩散速度加快,有利于多糖的浸出;而当提取时间继续延长时,多糖结构受到破坏,且溶剂蒸发较快,都将影响多糖的提取率。所以,选择5、6、7min作为正交试验的3个水平。
2.1.2 超声提取次数对多糖提取率的影响
由图1B可知,随着提取次数的增加,多糖的提取率升高。当提取次数大于3后,提取率增幅趋于平缓。这是因为在所设定的超声提取条件下,经3次提取,大部分多糖已经提取出,继续增加提取次数,多糖提取率的增加不明显。所以,选择2、3、4次作为正交试验的3个水平。
2.1.3 超声提取料液比对多糖提取率的影响
由图1C可知,在料液比为1∶30时多糖提取率达到最大,此后,随着液料比的增加,多糖提取率迅速降低,其原因可能在于过大的溶剂体积,使超声波在液体中的空化效应不均匀,底层的样品粉末所受的空化效应偏低,导致多糖提取率降低。所以,选择料液比1∶20、1∶30、1∶40作为正交试验的3个水平。
2.2 鼠尾草叶多糖提取工艺的优化
根据提取时间、提取次数、料液比的单因素试验结果选择的3个水平,设计L9(34)正交试验及结果见表1。

表1 鼠尾草叶多糖提取正交试验设计及结果Table 1 Orthogonal array design and corresponding experimental results
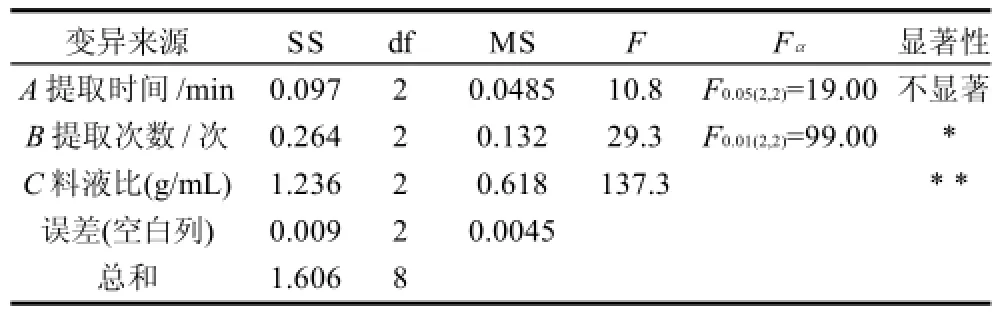
表2 正交试验结果方差分析Table 2 Analysis of variance for polysaccharide yield with various extraction conditions
由表1R值可知,影响多糖提取率的因素主次关系为C(料液比)>B(提取次数)>A(提取时间),即料液比对多糖提取率的影响最大。由表2方差分析可知,C(料液比)对鼠尾草叶多糖的超声提取率具有极显著影响,B (提取次数)对多糖的提取率具有显著影响,而A(提取时间)对超声法提取鼠尾草多糖的提取率无显著性影响。
综上所述,最优工艺组合条件为A3B1C3,即正交试验中的第7组试验,即鼠尾草叶多糖提取的最佳工艺条件为提取时间7min,提取次数2次,料液比1∶40,在此条件下多糖提取率为3.27%。
2.3 DPPH自由基清除活性
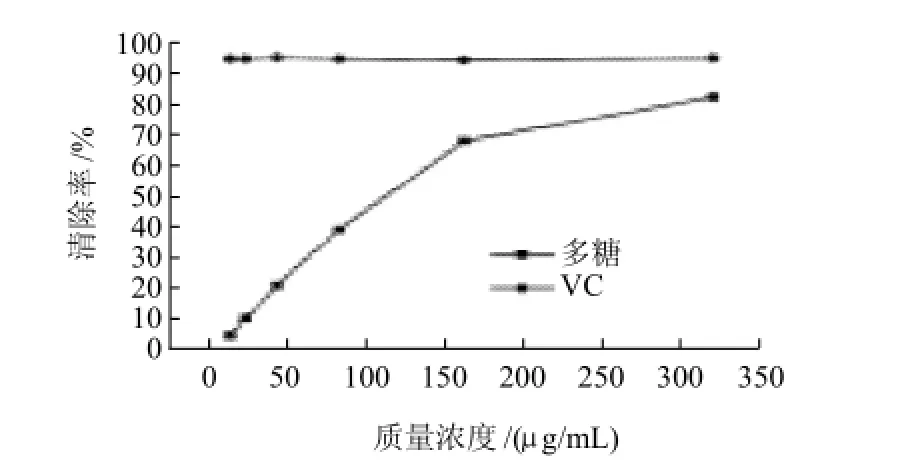
图3 鼠尾草多糖的清除作用Fig.3 Comparison of DPPH free radical scavenging rates of VC and polysaccharides from Salvia officinalis L. leaves
由图3可以看出,该多糖对DPPH自由基有较强的清除能力,当多糖质量浓度10μg/mL时,对DPPH自由基的清除率为54.04%,随着多糖质量浓度的增加,对DPPH自由基的清除作用增加,当多糖质量浓度在10~160μg/mL时,呈现出明显的剂量效应,当多糖质量浓度为160μg/mL时,对DPPH自由基的清除率达到82%。此后,继续增大多糖的质量浓度,其清除率提高趋于平缓。同时,从分析可得,鼠尾草叶多糖对DPPH自由基清除能力IC50为112μg/mL。由此可见,该多糖的自由基清除作用相当显著。
3 结 论
采用超声提取鼠尾草叶多糖的最佳工艺条件为提取时间7min,提取次数2次,料液比1∶40,在此条件下鼠尾草叶多糖的提取率为3.27%。同时该多糖对DPPH自由基有较好的清除作用,IC50值为112μg/mL,并且当质量浓度为160μg/mL时,清除率达到82%。
[1]吴征镒, 李锡文. 中国植物志∶ 第66卷[M]. 北京∶ 科学出版社, 1977∶140-141.
[2]BOUAZIZ M, YANGUI T, SAYADI S, et al. Disinfectant properties of essential oils from Salvia officinalis L. cultivated in Tunisa[J]. Food and Chemical Toxicology, 2009, 47(11)∶ 2755-2760.
[3]LU Y R, FOO L Y. Antioxidant activities of polyphenols from sage[J]. Food Chemistry, 2001, 75(2)∶ 197-202.
[4]FILIPIC M, METKA F, BARICEVIC D, et al. Antimutagenic activity of Salvia officinalis extracts against UV induced mutations in E. coli strains[J]. Mutation Research, 1997, 379(1)∶ 182-183.
[5]MAYER B, BAGGIO C H, FREITAS C S, et al. Gastroprotective constituents of Salvia officinalis L.[J]. Fitoterapia, 2009, 80(7)∶ 421-426.
[6]BODIRLAU R, SPIRIDON I, TEACA C A, et al. Anti-inflammatory constituents from different plant sepecies[J]. Environmental Engineering and Management Journal, 2009, 8(4)∶ 785-792.
[7]BARICEVIC D, SOSA S, DELLA LOGGIA R, et al. Topical antiinflammatory activity of Salvia officinalis L. leaves∶ the relevance of ursolic acid[J]. Journal of Ethnopharmacology, 2001, 75(2/3)∶ 125-132.
[8]CAPEK P. Water-soluble polysaccharides from Salvia officinalis L. possessing immunomodulatory activity[J]. Phytochemistry, 2004, 65 (13)∶ 1983-1992.
[9]CAPEK P. A water soluble glucomannan isolated from an immunomodulatory active polysaccharide of Salvia officinalis L.[J]. Carbohydrate Polymers, 2009, 75(2)∶ 356-359.
[10]CAPEK P, HRIBALOVA V, SVANDOVA E, et al. Characterization of immunomodulatory polysaccharides from Salvia officinalis L.[J]. International Journal of Biological Macromolecules, 2003, 33(1/3)∶ 113-119.
[11]CAPEK P, MACHOVA E, TURIAN J. Scavenging and antioxidant activities of immunomodulating polysaccharides isolated from Salvia officinalis L.[J]. International Journal of Biological Macromolecules, 2009, 44(1)∶ 75-80.
[12]QIU Huixia, YAO Lei, HONG Limei, et al. Seasonal analyses of the essential oil of Salvia officinalis L. cultivtated in shanghai of China[J]. Journal of Shanghai Jiaotong University (Agricultural Science), 2005, 23(3)∶ 213-218.
[13]秦海燕, 陈季武, 胡斌, 等. 鼠尾草叶提取物清除自由基、抗氧化作用的研究[J]. 食品科学, 2006, 27(7)∶ 89-92.
[14]HROMADKOVA Z, EBRINGEROVA A, VALACHOVIC P. Comparison of classical and ultrasound-assisted extraction of polysaccharides from Salvia officinalis L.[J]. Ultrasonics Sonochemistry, 1999, 5(4)∶163-168.
[15]徐春龙. 超声提取中草药成分研究进展[J]. 药物分析杂志, 2007, 27 (6)∶ 933-937.
[16]徐晓飞, 陈健. 多糖含量测定的研究进展[J]. 食品科学, 2009, 30(21)∶443-448.
[17]YANG Xiaoming, YU Wei, QU Zhongping, et al. Antioxidant and imuunity activity of water extract and crude polysaccharide from Ficus carica L. fruit[J]. Plant Foods for Human Nutrition, 2009, 64 (2)∶ 167-173.
Optimization of Ultrasonic Extraction of Polysaccharides from Salvia officinalis L. Leaves and Their DPPH Free Radical Scavenging Activity
ZHU Yuan-ting,WU Wen-lin,ZHANG Li*,LIU Qi
(College of Biology and Science, Sichuan Agricultural University, Ya'an 625014, China)
The conditions for ultrasonic extraction of polysaccharides from Salvia officinalis L. leaves were optimized by onefactor-at-a-time and orthogonal array design methods. A material-to-liquid ratio of 1∶40 for 7 min extractions performed twice proved optimal. The resultant polysaccharide yield was 3.27%. The polysaccharide extract obtained had excellent DPPH free radical scavenging effect, revealing a scavenging rate of 82% at the concentration of 160μ g/mL and an IC50 of 112μ g/mL.
Salvia officinalis;polysaccharide;ultrasonic extraction;1,1-diphenyl-2-picrylhydrazyl (DPPH)
TQ929.2
A
1002-6630(2011)16-0076-04
2010-11-22
四川省青年科技基金资助项目(08ZQ026-034);四川省科技厅科技支撑计划资助项目(2008FZ0148;2008SZ0074)
祝元婷(1990—),女,学士,研究方向为植物化学。E-mail:zhuyuantingwode@163.com
*通信作者:张利(1969—),女,教授,博士,研究方向为天然产物化学。E-mail:zhang8434@sina.com

