马铃薯WRKY6基因的克隆、序列分析与原核表达研究
李立芹,黄玉碧,王西瑶
(四川农业大学农学院,四川 雅安625014)
WRKY转录因子是近年来发现植物特有的一类重要基因,WRKY蛋白最初是从甘薯中发现的一类转录因子,当时命名为SPF1[1]。后来相继从其他植物中也鉴定出了这种蛋白。迄今为止,已从拟南芥(Arabidopsis thaliana)、野生马铃薯(Solanum tuberosum)、棉花(Gossypium spp.)、水稻(Oryza sativa)、烟草(Nicotiana tabacum)、大麦(Hordeum vulgare)、辣椒(Capsicum annuum)、遏蓝菜(Thalaspi arvense)等植物分离出许多的WRKY蛋白[2-9],这类蛋白共同特点是在其N端含有高度保守的具有60个氨基酸的WRKY结构域,其中包括1个十分保守的七肽WRKYGQK,WRKY蛋白也由此得名。同时该结构域中还含有一类新的类似锌指的结构域,因而WRKY蛋白也可能是一类锌指蛋白。根据已有的一些研究表明WRKY蛋白参与植物病菌信号转导[10]、衰老[2,11]、生长发育[12-13]、代谢调控[4]和非生物逆境等众多生理过程[14-16]。
马铃薯是世界范围内重要粮菜兼用的经济植物,是位列于水稻、小麦(Triticum aestivum)和玉米(Zea mays)之后的第四大粮食作物[17]。马铃薯品种“米拉”是我国西南地区长期以来的主栽品种,1956年从德国引入我国。它的优点是适应性极强,能够适应不同的气候和土壤环境,同时高抗晚疫病,因此推测其含有很多优异的基因。利用基因工程等生物技术手段有目的寻找其抵御逆境胁迫的优良基因,以期将来应用于马铃薯遗传育种研究,这将具有重要的研究意义。本研究从该品种中克隆出与抗逆性相关WRKY家族成员WRKY 6,通过生物信息学分析,克隆的WRKY 6基因属于WRKY家族第3组成员,锌指结构为C-X7-C-X23-H-X-C。然后在大肠杆菌(Escherichia coli)中成功表达该蛋白,纯化后获得了特异性高的融合蛋白,这对于下一步在体外研究其功能具有重要意义。
1 材料与方法
1.1 试验材料
供试马铃薯品种米拉,由四川农业大学马铃薯研究中心提供;大肠杆菌DH5α和DE3、DNA凝胶回收纯化试剂盒购于天根生化科技(北京)有限公司;pMD19-T克隆载体、ExTaqDNA聚合酶、T4DNA连接酶购于TaKaRa公司(大连)。
1.2 方法
1.2.1 提取马铃薯米拉总RNA和反转录 试验于2010年3月进行,以组培苗的幼嫩叶片为材料,采用Trizol法提取总RNA,然后反转录为cDNA。反转录的反应体系为20 μL,在DEPC(焦碳酸二乙酯)水处理过的小管中依次加入下列组分 :Oligod T1μL;dNTPs(40 mmol/L)1 μL;RNA 5 μg;补水至13 μL 。65 ℃变性5 min,迅速在冰上冷却至少1 min,稍微离心,然后加入:5×First-Strand buff 4 μL;0.1 mol/L DTT(二硫苏糖醇)1 μL;Super-ScriptTMIIRT(反转录酶)1 μL。反应条件是42℃反应60 min,70℃处理15 min。反转录产物在-20℃保存备用。
1.2.2 扩增WRKY 6基因 根据GenBank公布的马铃薯WRKY 6基因编码序列(登陆号EU056918.1),利用Premier 5.0设计同源引物,该引物分别对应位于该基因编码区上游起始密码子及C端终止密码区,可扩增该基因的完整编码区。以cDNA模板,以WRKY 6-F(5′-GGATCCATGGATAACTCATCGACTG-3′,下划线处表示酶切位点,以下同)和 WRKY6-R 引物(5′-CCCGGGCTACACT TGATCAAAATTCC-3′),对 WRKY 6 基因的编码区进行PCR扩增。PCR反应体系以1 μL cDNA为模板,加入10×ExTaq缓冲液5 μL(含Mg2+),WRKY6-F和 WRKY6-R 各 1 μL(10 μ mol/L),40 mmol/L dNTP 0.5 μL,ExTaq DNA 聚合酶 0.25 μL(5 U/μL),加水至50 μL。PCR反应的条件:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,共35个循环;最后72℃延伸10 min。PCR产物于1%琼脂糖凝胶电泳检测。
1.2.3 基因克隆及测序 扩增产物经电泳检测后,回收目的片段,然后与pMD19-T载体16℃连接过夜,连接产物转化大肠杆菌DH5α感受态,然后在涂有氨苄青霉素及X-gal/IPTG(5-溴-4-氯-3-吲哚-β-D-半乳糖苷/异丙基硫代半乳糖苷)的LB平板上进行蓝白斑筛选,挑取白色单克隆,进行菌落PCR检测。然后随机选取3个独立的阳性克隆进行测序(上海Invitrogen生物工程技术服务有限公司)。
1.2.4 序列分析 基因的编码框用NCBI提供的在线ORF Finder寻找(http://www.ncbi.nlm.nih.gov/gorf/gorf.html);核苷酸及氨基酸序列的同源序列搜索由NCBI提供的在线BLAST进行(http://blast.ncbi.nlm.nih.gov);DNA序列的翻译、比对及系统演化树用DNAMAN(6.0 DEMO)进行。
1.2.5 原核表达载体的构建与鉴定 利用引物WRKY6-F和WRKY6-R对测序正确的质粒进行PCR扩增并回收目的基因。纯化的PCR产物及pGEX-4T-2质粒分别用BamHⅠ和SmaⅠ进行双酶切,回收、纯化酶切片段,并用T4DNA连接酶16℃连接过夜,转化宿主菌大肠杆菌DH5α,蓝白斑筛选阳性克隆,进行菌落PCR检测;用碱裂解法提取质粒,然后进行双酶切和测序鉴定。
1.2.6 原核表达蛋白的诱导 经鉴定阅读框正确的阳性重组质粒转化BL21感受态细胞,涂板挑菌,筛选出阳性重组菌。在含氨苄青霉素的LB培养基中37℃振摇培养过夜后,取重组菌按1∶100体积比转接到含氨苄青霉素的LB培养基中,37℃振摇培养至OD值达到0.6~0.8时,菌液中加入终浓度为0.2和0.5 mmol/L IPTG分别在37和18℃条件下诱导表达,收集1 mL菌液分装于1.5 mL的离心管中,离心5 min,沉淀用PBS(磷酸缓冲液pH 7.4)悬浮,再加入5×聚丙烯酰胺凝胶电泳(SDS-PAGE)上样缓冲液,水浴煮沸5 min,12 000 r/min离心5 min,取上清进行SDS-PAGE电泳。聚丙烯酰胺胶采用考马斯亮蓝法进行染色。
1.2.7 融合蛋白纯化 将诱导成功的GST-StWRKY6菌液按1∶100体积比转接于5 mL LB液体培养基中,37℃振摇培养过夜。将活化的菌液按1∶50的接种量转接到200 mL含氨苄青霉素的LB培养基中,37℃培养至OD值达到0.6~0.8时,加入诱导剂IPTG至终浓度为0.2 mmol/L,18℃诱导培养过夜。将诱导的菌液离心收集于50 mL离心管中,弃上清,加入含适量溶菌酶的裂解液,吹匀后转到50 mL离心管中。超声破碎菌体,离心收集上清,然后加入适量已平衡好的谷胱甘肽-Sepharose 4B珠子,4℃结合4 h以上,离心收集结合有目的蛋白的谷胱甘肽-Sepharose 4B珠子。用不含溶菌酶的裂解液清洗非特异结合在谷胱甘肽-Sepharose 4B珠子上的杂蛋白。还原型谷胱甘肽洗脱液洗脱GST-StWRKY6融合蛋白。最后用SDSPAGE分析GST-StWRKY6融合蛋白纯度。纯化后蛋白冷冻干燥保存于冰箱待用。

图1 马铃薯WRKY6基因扩增结果Fig.1 WRKY6 PCR product
2 结果与分析
2.1 目的基因的PCR扩增及克隆
用引物WRKY6-F和WRKY6-R对马铃薯米拉cDNA进行扩增,PCR扩增产物用1%琼脂糖凝胶电泳检测后,可见1条约为990 bp的条带(图1)。该条带回收纯化后,与pMD19-T载体连接,转化产物经过蓝白斑及菌落PCR筛选后,将获得阳性克隆随机挑选3个进行测序。

图2 StWRKY6蛋白与不同物种WRKY蛋白保守结构域比较Fig.2 Conserved protein domain between StWRKY6 and other WRKY protein from other species
2.2 序列分析
核酸序列分析结果表明,该基因的开放阅读框为990 bp,编码 330氨基酸。利用 NCBI数据库进行Blast分析发现,克隆序列与其他学者登录的马铃薯WRKY 6(EU056918.1)序列一致,说明在同种植物中该基因的保守性程度非常高。用WRKY6的氨基酸序列在NCBI网站中的Blast进行在线比对,从中选出同源性较高的19条氨基酸序列进行保守域分析,通过比对从中选择同源性较高的 WRKY结构域进行作图,结果表明克隆的WRKY6含有1个保守WRKY结构域,其锌指结构模式为C-X7-C-X23-H-X-C,属于WRKY家族的第3组(图2)。同时根据这20个蛋白的氨基酸序列(包括StWRKY6)构建系统发育树(图3)。分析发现,该蛋白与来自拟南芥的WRKY70(XP 002878082.1)、油菜 WRKY70(ACQ76810.1)和西瓜WRKY70(ACV29874.1)聚为紧密一支,说明它们的亲缘关系较近,与来自大麦的WRKY4(ABR87002.1)距离最远。
2.3 原核表达载体的构建和重组子鉴定
利用BamHⅠ和SmaⅠ对StWRKY6-pMD19T载体和原核表达载体pGEX-4T-2进行双酶切,然后纯化酶切产物、连接,构建重组表达载体。单克隆经菌落PCR检测,可扩增出1条990 bp左右插入片段,与目的片段(990 bp)分子量基本相符;通过双酶切鉴定可将重组质粒酶切为990 bp左右的片段和4 900 bp左右片段(图4)。载体pGEX-4T-2的分子量是4 900 bp。重组质粒经测序表明,与克隆序列完全一致,开放阅读框正确。表明StWRKY6的原核表达载体构建成功。
2.4 目的蛋白表达的SDS-PAGE分析
在37和18℃的温度条件下分别添加0.2和0.5 mmol/L IPTG对含有重组质粒的大肠杆菌DE3进行诱导目的蛋白的表达,结果表明在18℃条件下诱导该融合蛋白的表达量高于在37℃条件下(结果未显示),在18℃条件下使用0.2和0.5 mmol/L IPTG诱导时,目的蛋白没有显著差异。因此确定StWRKY6蛋白最佳诱导条件是在 18℃培养条件下添加0.2 mmol/L IPTG。StWRKY6蛋白分子量39.6 kD,加上GST-tag标签蛋白26 kD,融合蛋白分子量应为66 kD左右,含有目的质粒的大肠杆菌经过诱导表达出蛋白分子量约66 kD左右,与理论值相符,而含有空载体菌株未见表达出目的蛋白(图5)。
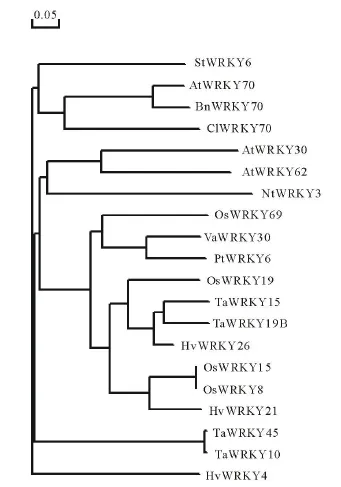
图3 马铃薯WRKY6与不同物种WRKY蛋白的系统演化分析Fig.3 Phylogenetic analysis of the deduced amino acid sequence between PtWRKY6 and other WRKY protein

图4 重组质粒的鉴定Fig.4 Double enzyme digestion result

图5 GST-StWRKY6表达产物的SDS-PAGEFig.5 SDS-PAGE of expression of GST-StWRKY6 in BL21
2.5 目的蛋白纯化的SDS-PAGE分析
纯化的结果表明,GST-StWRKY6融合蛋白在大肠杆菌BL21(DE3)中获得高效表达。试验表明在18℃条件下添加0.2 mol/L IPTG诱导8 h后可得到大量融合蛋白。纯化后融合蛋白约为66 kD(图6),SDS-PAGE显示其条带特异性好,纯度高。
3 讨论
植物中WRKY蛋白结构的共同特点含有1~2个WRKY结构域,结构域 C端具有一个 C2H2或C2HC的锌指结构。根据WRKY结构域的数目和锌指结构的类型,WRKY蛋白可分成3组:第1组含2个WRKY结构域,锌指结构模式为C-X4-5-C-X22-23HX-H,第2和3组均含 1个WRKY结构域,第2组锌指结构模式与第1组相同;第3组仅在组成锌指的氨基酸有变化,C-X7-C-X22-23-H-X-C[18]。在高等植物中,第3组WRKY蛋白占该家族成员的20%,在低等植物例如苔藓(Bryophyta)植物中不存在[19]。表明该类WRKY蛋白可能处在陆生植物进化的较后位置,可能与高等植物适应复杂多变的环境相关。应用生物信息学的相关软件可以根据已知生物的基因组图谱和功能信息,来预测未知基因和功能蛋白的相关信息和构建物种遗传图谱;是当前研究生物基因组学的主要手段之一[20]。本研究以GenBank中其他学者已公布序列(EU056918.1)设计引物,利用 RT-PCR获得了StWRKY6的cDNA序列。分析比对后发现,其与已公布cDNA序列一致,说明对于同种植物,该基因十分保守,系统进化分析表明该蛋白与其他物种间的同源性较低,为21%~63%,这与其他学者的研究一致,即属内同源性高,属间相对低[21,22]。

图6 GST-StWRKY6纯化产物的SDS-PAGEFig.6 SDS-PAGE of purified GST-StWRKY6
目前关于WRKY蛋白二级结构研究不多,Yamasaki等[23]采用核磁共振技术对AtWRKY44蛋白C末端WRKY结构域进行分析,发现C末端由4条β链折叠组成,WRKYGQK位于β链的N端,其中甘氨酸残基处形成扭结使得色氨酸残基具有很强的疏水作用,这有助于β链折叠。Duan等[24]研究AtWRKY1蛋白C末端晶体结构域发现它由5个β链组成1个反向平行的β折叠球形结构,在另一端存在 1个新型锌离子结合位点。通过 AntheProt 3D蛋白软件分析,本研究中StWRKY6蛋白的二级结构中螺旋占27%,折叠占18%,转角占27%,蜷曲占28%。这为进一步研究该蛋白的结构提供一定的线索。通过氨基酸序列分析比对,StWRKY6蛋白属于第3组,构建系统发育树的结果表明StWRKY6与拟南芥的 WRKY70、油菜WRKY70和西瓜 WRKY70聚为紧密一支。拟南芥第 3组成员WRKY70敲除的突变体能降低SA(水杨酸)介导对二孢白粉菌抗性,而超表达植株能提高这种抗性,但会降低JA(茉莉酸)介导的对甘蓝黑斑病抗性,因此AtWRKY70在拟南芥SA和JA防御信号途径起到一个重要的平衡作用[19]。油菜BnWRKY70也属于第3组成员,该蛋白能在转录水平上参与调节与真菌侵染和激素刺激相关的基因[25],而西瓜ClWRKY70的功能未见报道。由于AtWRKY70和 BnWRKY70被报道与植物的病菌侵染相关,因此推测StWRKY6可能与马铃薯的抗病性相关,当然这还需要通过进一步实验证明。现在已报道的第3组成员还包括在大豆(Glycinemax)中克隆的GmWRKY57B,通过将该基因在烟草中的过量表达,可以提高转基因烟草的抗旱性[26]。因此到目前为止WRKY家族第3组成员主要被发现与植物的生物和非生物胁迫相关。
目前,已经在公共数据库中发表了多个物种的WRKY基因序列,其数目已经超过1 000个,目前WRKY蛋白的研究主要集中在拟南芥、水稻和玉米等已经测序完成的物种。马铃薯作为一种世界范围内重要的经济作物,相比较而言,WRKY转录因子的研究较少,StWRKY1是采用差减杂交的方法从马铃薯中分离到1个WRKY基因,该基因编码172个氨基酸,并包含1个WRKY结构域。该基因是受到软腐病诱导表达,但是SA、MJ(茉莉酸甲酯)、乙烯和伤害对它的表达没有影响,推测它参与马铃薯软腐病的抵御过程[27]。ScWRKY1转录因子是从野生马铃薯胚珠中分离到的,它在受精后16 d的鱼雷期胚胎中有瞬时高表达,但是在已完全发育的果实、根、茎和花瓣中表达量很低,表明ScWRKY1可能参与胚胎形成过程[3]。本研究克隆了马铃薯中WRKY6的完整编码框,并成功在大肠杆菌中表达和纯化出特异性高的融合蛋白,进一步的工作可以采用凝胶电泳迁移改变实验来验证其是否具有结合W盒的能力,以及采用瞬时表达融合GFP(绿色荧光蛋白)的方法来研究其定位,这些对于确定该WRKY转录因子的功能是必需的。虽然马铃薯中WRKY转录因子的研究起步较晚,但是该物种的基因组序列框架图在2009年9月已完成。相信以此为契机将来会有更多的WRKY转录因子的信息被注释。WRKY蛋白中保守的WRKY结构域可以结合启动子区域的W盒,因此所有启动子区域含有W盒的基因都有可能是其靶基因。这其中包括WRKY基因本身[18]。随着马铃薯基因信息的日益完善,寻找WRKY转录因子靶基因将成为可能,这对于阐明WRKY转录因子调控植物生理机制具有重要的意义。
[1]Ishiguro S,Nakamura K.Characterization of a cDNA encoding a novel DNA-binding protein,SPF1,that recognizes SP8 sequences in the upstream regions of genes coding for sporamin and beta-amylase from sweet potato[J].Molecular and General Genetics,1994,244(6):563-571.
[2]Robatzek S,Somssich I E.A new member of the Arabidopsis WRKY transcription factor family,AtWRKY6,is associated with both senescence-and defence-related processes[J].Plant Journal,2001,28:123-133.
[3]Lagacé M,M atton D P.Characterization of a WRKY transcription factor expressed in late torpedo stage embryos of Solanum chacoense[J].Planta,2004,219:185-189.
[4]Xu Y H,Wang J W,Wang S,etal.Characterization of GaWRKY1,a cotton transcription factor that regulates the sesquiterpene synthase gene(+)-δ-cadinene synthase-A[J].Plant Physiology,2004,135:507-515.
[5]Zhang Z L,Xie Z,Zou X L,et al.A rice WRKY gene encodes a transcriptional repressor of the gibberellin signaling pathway in aleurone cells[J].Plant Physiology,2004,134:1500-1513.
[6]Chen C,ChenZ.Isolation and characterization of two pathogen and salicylic acid-induced genes encoding WRKY DNA-binding proteins from tobacco[J].Plant Molecular Biology,2000,42:387-396.
[7]Sun C X,Palmqvist S,Olsson H,etal.A novel WRKY transcription factor,SUSIBA2,participates in sugar signaling in barley by binding to the sugar-responsive elements of theiso1 promoter[J].Plant Cell,2003,15:2076-2092.
[8]Hwang E W,Kim K A,Park S C,etal.Expression profiles of hot pepper(Capsicumannum)genes under cold stress conditions[J].Journal of Biosciences,2005,30(5):657-667.
[9]Wei W,Zhang Y X,Han L,et al.A novel WRKY transcriptional factor from thlaspi caerulescens negatively regulates the osmotic stress tolerance of transgenic Tobacco[J].Plant Cell Reports,2008,27(4):795-803.
[10]Wang J,Zhang S,Stacey G.Activation of a mitogen-activated protein kinase pathway in Arabidopsis by chitin[J].Molecular Plant Pathology,2004,5:125-135.
[11]Robatzek,Somssich I E.Targets of AtWRKY6 regulation during plant senescence and pathogen defense[J].Genes Development,2002,16:1139-1149.
[12]Jonson C S,Kolevski B,Smyth D R.TRANSPARENT TESTA GLA-BRA 2,a trichome and seed coat development gene of Arabidopsis,encode a WRKY transcription factor[J].Plant Cell,2002,14:1359-1375.
[13]Luo M,Dennis E S,Berger F,etal.A MINI SEED3(MINI3),a WRKY family gene,and HAIKU2(IKU2),a leucine-rich repeat(LRR)kinase gene,are regulators of seed size in Arabidopsis[J].Proceedings of the National Academy of Sciences USA,2005,102:17531-17536.
[14]M are C,Mazzucotelli E,Crosatti C,et al.Hv-WRKY38:A new transcription factor involved in cold and drought response in barley[J].Plant M olecular Biology,2004,55:399-416.
[15]Devaiah B N,Karthikeyan A S,Raghothama K G.WRKY75 transcription factor is a modulator of phosphate acquisition and root development in Arabidopsis[J].Plant Physiology,2007,143:1789-1801.
[16]ChenY F,Li L Q,Xu Q,etal.The WRKY6 transcription factor modulates PHOSPHA TE1 expression in response to low Pi stress in Arabidopsis[J].The Plant Cell,2009,21:3554-3566.
[17]程天庆.马铃薯栽培技术(第2版)[M].北京:金盾出版社,2004.
[18]Eulgem T,Rushton P J,Robatzek S,et al.The WRKY superfamily of plant transcriptional factor[J].Trends Plant Science,2000,5(5):199-206.
[19]Li J,Brader G,Palva E T.The WRKY70 transcription factor:A node of convergence for jasmonate-mediated and salicylatemediated signals in plant defense[J].Plant Cell,2004,16(2):319-331.
[20]郑轶琦,刘建秀.草坪草分子遗传图谱的构建与应用研究进展[J].草业学报,2009,18(1):155-162.
[21]尚以顺,杨春燕,钟理.贵州野生匍匐剪股颖种质资源遗传多样性的ISSR分析[J].草业学报,2009,18(3):67-73.
[22]沈宝云,刘玉汇,张俊莲,等.马铃薯块茎GBSSⅠ基因的cDNA克隆及其序列特征分析[J].草业学报,2010,19(5):1-8.
[23]Yamasaki K,Kigawa T,Inoue M,et al.Soltuion structeru of an Arabidopsis WRKY DNA bidning doamin[J].Plant Cell,2005,(37):944-956.
[24]Duan M R,Nan J,Liang Y H,et al.DNA binding mechanism revealed by high resolution crystal structure of Arabidopsis thaliana WRKY1 protein[J].Nucleic Acids Research,2007,35:1145-1154.
[25]Yang B,Jiang Y,Rahman M H,et al.Identification and expression analysis of WRKY transcription factor genes in canola(Brassicanapus L.)in response to fungal pathogens and hormone treatments[J].BMC Plant Biology,2009,9:68-87.
[26]张兰,王晓萍,毕影东,等.大豆转录因子GmWRKY57B的基因克隆及功能分析[J].科学通报,2008,53(21):2604-2611.
[27]Dellagi A,Helibronn J,Avrova A O,et al.A potato gene encoding a WRKY-like transcription factor is induced in interactions with Erwinia carotovora subsp.atroseptica and Phytophthora infestans and is coregulate with classI endochitinase expression[J].M olecular Plant Microbe Interactions,2000,13(10):1092-1101.
