GFP小鼠皮肤成纤维细胞皮下注射后转归的实验研究
丁小邦 王 健 曹谊林
GFP小鼠皮肤成纤维细胞皮下注射后转归的实验研究
丁小邦 王 健 曹谊林
目的 研究绿色荧光蛋白转基因小鼠(C57BL/6-gfp小鼠)皮肤成纤维细胞皮下注射后的转归。方法 以GFP小鼠皮肤成纤维细胞为研究对象,培养收集第3代皮肤成纤维细胞,按细胞浓度20×106cells/mL注射到裸鼠头皮下,分别于细胞注射后1周、2周、3周、6周及12周,通过活体荧光检测仪、组织学观察、冰冻切片荧光显微镜观察及GFP蛋白的免疫组化来研究注射部位成纤维细胞的转归。结果 GFP小鼠皮肤成纤维细胞皮下局部注射后2周内明显存在,3周后注射部位成纤维细胞明显减少,并随时间推移逐渐减少,12周后仅有少量细胞存活。结论 单纯注射成纤维细胞并依赖其存活以达到除皱的效果是非常有限。
绿色荧光蛋白 皮肤成纤维细胞 皮下注射 转归
临床上尚没有一种效果良好且持久、方法简便易于被患者接受的除皱方式。自应用于面部除皱的可注射牛胶原出现后,注射除皱越来越被人们所青睐。目前,国内外常用的注射除皱物包括:①肉毒素;②医用胶原和透明质酸等;③化学合成的颗粒充填剂,如PMMA(主要成份为Atecoll)等;④自体成纤维细胞注射(如Isolagen)。
自体成纤维细胞注射除皱技术是从皮肤中分离出皮肤成纤维细胞,再通过体外培养扩增,收集后回注到自体,2个月内进行3次注射。自体培养的成纤维细胞(Isolagen)是单纯细胞技术在注射除皱方面的应用[1],Watson等[2]对10例因皱纹、痤疮后瘢痕的病例分两组进行观察,结果表明单纯注射Isolagen组效果可持续12个月,而注射+激光组效果更佳,且光镜显示术后真皮层胶原厚度和密度增加。
目前认为,自体成纤维细胞注射除皱技术的作用机制可能是多次创伤刺激组织增生,也可能是成活的皮肤成纤维细胞促进生长及胶原分泌。临床应用发现,自体成纤维细胞注射除皱技术对细浅皱纹有一定效果,对稍深的皱纹则无效,其原因可能与单纯成纤维细胞注射后细胞成活少,且细胞不易固定等因素有关。因此,有效研究成纤维细胞皮下注射后的转归情况,是值得探索的课题。
1 材料与方法
1.1 实验动物
绿色荧光蛋白转基因小鼠(C57BL/6-gfp小鼠,以下简称GFP小鼠),雌雄不限,体质量230 g以上,由南京大学模式动物研究所提供。
裸鼠,雌雄不限,体质量230 g以上,由中国医学科学院整形外科医院动物室提供。
1.2 方法
1.2.1 GFP小鼠皮肤成纤维细胞的分离
将GFP小鼠皮肤剪至2 mm×2 mm×2 mm大小,PBS振洗1遍;加入0.1%中性蛋白酶4℃消化过夜,无血清DMEM培养液清洗、终止消化,并揭去表皮层。余下的真皮组织以0.1%Ⅰ型胶原酶,37℃恒温振荡消化,分3个阶段收获成纤维细胞(间隔分别为2 h,4 h,8 h)。消化产物以150目尼龙筛过滤,细胞悬液1 000 r/min离心5 min,弃上清。加入PBS振荡混匀,1 000 r/min离心5 min,弃上清。取少量细胞悬液用4%乙酸等体积稀释破坏红细胞,加入台盼蓝(Trypan Blue)进行拒染试验,证实活细胞占总数的85%以上,用血球记数板对活细胞量进行计数后,用于实验。
1.2.2 GFP小鼠成纤维细胞接种、培养、观察和扩增
将最终获得的成纤维细胞置DMEM培养液(10%FCS,100 U/mL青霉素,100 μg/mL链霉素)中混匀,以1×104cells/cm2的密度接种于培养皿,37℃恒温培养箱(5%CO2)内培养,每3天换液1次,细胞长至85%融合后传代。
1.2.3 GFP小鼠成纤维细胞收集
收集第3代细胞作为种子细胞。PBS稀释至20×106cells/mL,以备注射用。
1.2.4 动物分组
共16只裸鼠。其中1只设为对照,另15只裸鼠随机分为5组,每组3只,分别于细胞注射后1周、2周、3周、6周及12周进行检测。
1.2.5 动物麻醉
整个实验过程中,实验动物均以10%水合氯醛0.3~0.35 mL/Kg腹腔注射进行麻醉。
1.2.6 GFP小鼠成纤维细胞裸鼠皮下注射
因裸鼠身体皮肤太薄,皮下过于疏松,故本实验选择裸鼠头皮部注射,用1 mL注射器抽取细胞液,30G BD注射针头注射,每个注射点注射0.15 mL,细胞尽量注射到头皮与颅骨之间全层(图1),共注射15只裸鼠。
1.3 检测
1.3.1 活体动物可见光成像仪定性及定量检测
分别于细胞注射后1周、2周、3周、6周及12周,将各组裸鼠麻醉后,对每只裸鼠头部进行活体荧光扫描(激发光波长530 nm),检测GFP小鼠成纤维细胞注射后在体内的分布情况,并采集荧光成像图,以未予任何细胞注射的裸鼠头部作空白对照。通过尼康NIS-Elements BR 3.0图像分析处理软件,计算荧光信号强度值,并定量分析荧光信号分布趋势,绘制柱状图。
1.3.2 取材
分别于细胞注射后1周、2周、3周、6周及12周取材。分别取两眼之间及其两侧1 cm范围内全层头部皮肤组织,分两部分。其中1/2皮肤入10%中性福尔马林溶液固定,以行石蜡包埋切片;另1/2皮肤入液氮,以行OCT包埋,冰冻切片(图1)。
1.3.3 冰冻切片的制备、染色
标本放入液氮,OCT包埋,冰冻切片机切片,厚度约8 μm。每个标本切2张。一张切片封片剂封片后,直接于荧光显微镜下观察,同一视野下拍摄荧光照片,DAPI照片,以示踪注射的GFP小鼠成纤维细胞。另一张切片用HE快速染色法染色。以荧光、DAPI照片为参照拍摄HE照片,以便确定荧光所在组织层次。
1.3.4 GFP蛋白的免疫组化检测[3]
石蜡切片脱蜡,通过免疫组织化学技术检测GFP小鼠成纤维细胞内的GFP蛋白,以便确定注射的成纤维细胞的存在。
1.4 统计学分析
采用SPSS 17.0软件包对各组定量数据进行统计学分析。
2 结果
2.1 GFP小鼠皮肤成纤维细胞生长和形态学观察
GFP小鼠皮肤成纤维细胞在DMEM全培养液中单层培养,刚贴壁时呈三角形,随着生长时间延长而呈梭形和纺锤形(图2)。
2.2 活体荧光成像结果
2.2.1 荧光成像观察结果
分别于细胞注射后1周、2周、3周、6周及12周,将各组裸鼠麻醉后,对每只鼠头部进行活体荧光扫描并采集荧光成像图(图3)。直接观察结果表明:随着时间的推移,荧光面积逐渐减小,荧光强度逐渐减弱,第12周仍有荧光存在,和阴性对照比较,提示有少量细胞存活。
2.2.2 活体荧光信号定量分析
通过荧光检测仪获得定量的灰度值,分析表明第1周荧光强度最强,第2周开始大幅减弱,并随时间推移,荧光强度逐渐减弱,但第12周仍有一定的荧光强度,表明有少量的GFP小鼠皮肤成纤维细胞存活。统计学分析表明,荧光灰度值第1周与第2周、第3周、第6周及第12周均有显著差异(P<0.01);第2周和第3周无统计学差异(P>0.05);第2周和第6周、第12周有统计学差异(P<0.05);第3周和第6周无统计学差异(P>0.05);第3周和第12周有统计学差异(P<0.05);第6周和第12周也无统计学差异(P>0.05)(图4)。

图3 注射GFP小鼠成纤维细胞后不同时间活体荧光成像结果Fig.3 Living fluorescence imaging at different time after injection
2.3 冰冻切片荧光显微镜观察
结果表明,第1、2周可明显发现注射部位GFP成纤维细胞发出的绿色荧光,主要集中在皮下肌肉交界处。第3、6周仍可发现少量荧光 ,第12周仅能发现极少量细胞呈现绿色荧光(图5)。
2.4 GFP蛋白免疫组化染色
结果表明,第1、2周可明显发现注射部位GFP蛋白的存在,第3周可发现注射部位少量GFP蛋白的存在,第6周、12周仅能发现极少量GFP蛋白的存在(图6)。
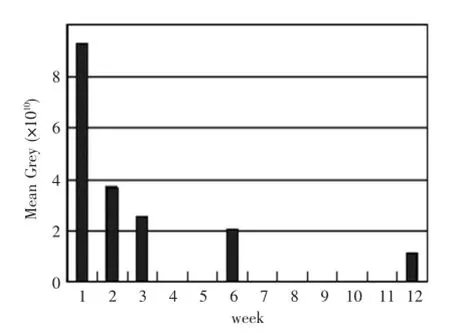
图4 每组裸鼠头部活体荧光检测的灰度强度均值Fig.4 Mean grey level of living fluorescence imaging at different groups

图5 不同时间点取材冰冻切片荧光显微镜观察结果(100×)Fig.5 The distribution and survival of GFP-labeled fibroblasts at different time under the fluorescence microscope(100×)

图6 不同时间点取材石蜡切片GFP免疫组化染色结果(100×)Fig.6 GFP immunohistochemistry of GFP-labeled fibroblasts at different time
3 讨论
传统的研究细胞转归的方法[4]是标记移植细胞,然后检测其标记物。传统标记细胞的方法在研究细胞转归时存在局限性。
使用胞浆标记物,常用的主要有Hoechst、Dil等荧光色素细胞移植前用荧光素进行预先标记,移植后可以利用荧光显微镜观察荧光标记细胞的存活和迁移情况,荧光色素已经被广泛用于细胞的标记和追踪方面的研究,但存在以下不足:①随着细胞的分裂,标记物也几乎等份地分配给两个子细胞,子细胞的荧光强度也随之下降;②只能靠观察到的荧光判断细胞的存在,而难以观察细胞形态及存活状态。
使用核酸标记物,常用的有胸腺嘧啶同位素标记、5-溴脱氧尿嘧啶核苷(BrdU)标记等,是反映细胞增殖及跟踪监测移植细胞的理想指标,但标记准确性及标记率存在差异。标记细胞如果发生凋亡或死亡,其释放的BrdU则可渗入到处于细胞循环S期的任何细胞,从而难以区分移植细胞和宿主细胞,出现假阳性。
改变细胞基因使其表达特异性的标志物,但经过基因修饰的细胞遗传特性并不稳定,可能在分析正常基因对子代细胞分化方向时产生影响,或在移植后生成肿瘤。
由于传统标记细胞方法的局限性,本研究选择了绿色荧光蛋白转基因小鼠的皮肤成纤维细胞作为研究对象,绿色荧光蛋白转基因小鼠其细胞可以正常培养,分裂扩增,其细胞活力不受细胞标记物的影响,其细胞内均含GFP蛋白,细胞荧光不会随细胞分裂而衰减,其荧光不会随时间而减弱,其死亡后代谢消失,不易出现假阳性。
检测细胞存在的手段很多,受影响的因素也很多,单一检测会存在假阳性或假阴性,本研究采用了多种检测手段相结合的方法,以避免上述结果的出现。
活体动物可见光成像仪器可以达到对活体荧光的定性和定量检测,不易出现假阴性,注射部位有荧光,而非注射部位无荧光,可清晰表明注射部位细胞的存活情况及存活量。GFP蛋白质本身发光,冰冻切片荧光显微镜下直接观察注射细胞后荧光的存在,容易出现假阳性,如果切片没有切到注射部位,也可能出现假阴性。GFP小鼠成纤维细胞内含GFP蛋白质,通过免疫组织化学技术,在裸鼠头皮的注射细胞部位,检测GFP小鼠成纤维细胞内的GFP蛋白,以便确定注射的成纤维细胞的存在。免疫组化同样也存在假阳性和假阴性。
故本研究以GFP小鼠成纤维细胞为研究对象,将3种方法相结合,以提高研究结果的准确性,为细胞体内转归的研究提供了一种有效的手段。
目前自体成纤维细胞注射除皱在欧洲广泛应用于临床,美国也进入3期临床。其特点是对细纹、浅纹、痤疮后凹陷性瘢痕治疗效果较好,对深皱纹和面部凹陷的治疗效果不尽人意。
本研究结果显示,皮肤成纤维细胞皮下局部注射后2周内明显存在,12周后仅有少量细胞存活,故单纯皮下注射成纤维细胞,并依赖其存活,从而达到除皱的效果是十分有限的。而注射自体成纤维细胞,对细纹、浅纹、痤疮后凹陷性瘢痕产生较好效果可能是由于多次创伤刺激组织增生而达到的。
组织工程[5-6]是应用细胞生物学和工程学的原理,研究和开发用于修复和改善人体各种组织或器官损伤后功能和形态的一门新兴学科,核心就是建立细胞与生物材料的三维空间复合体,即具有生命力的活体组织,用以对病损组织进行形态、结构和功能的重建并达到永久性替代。根据组织工程研究发现[7-8],没有和生物材料的结合,单纯细胞注射皮下成活量有限,且无法形成具有三维结构的组织,产生除皱的填充效果。而和生物支架材料相结合,细胞存活率明显提高,并可再生新的三维组织。为了提高本研究中成纤维细胞的成活率,及除皱时的填充效果,下一步可以将成纤维细胞和可降解的生物材料结合进行进一步研究。
[1] Homicz MR,Watson D.Review of injectable materials for soft tissue augmentation[J].Facial Plast Surg,2004,20(1):21-29.
[2] Watson D,Keller GS,Lacombe V,et al.Autologous fibroblasts for treatment of facial rhytids and dermal depression[J].Arch Facial Plast Surg,1999,1(3):165-167.
[3] Matsuo S,Kurisaki A,Sugino H,et al.Analysis of skin graft survival using green fluorescent protein transgenic mice[J].Med Invest, 2007,54(3-4):267-275.
[4] 金旭红,杨柳.骨髓间充质干细胞标记及活体示踪技术研究进展[J].中华创伤杂志,2007,23(4):311-313.
[5] Boss WK Jr,Usal H,Chernoff G.Autologous cultured fibroblasts as cellular therapy in plastic surgery[J].Clin Plastic Surg,2000,27 (10):613-626.
[6] Boss WK Jr,Usal H,Fodor PB,et al.Autologous cultured fibroblasts: a protein repair system[J].Ann Plast Surg,2000,44(5):536-542.
[7] 张涤生.组织工程学简介[J].中华整形烧伤外科杂志,1998,14(3): 211-214.
[8] Langer R,Vacanti JP.Tissue engineering[J].Science,1993,260 (5110):920-926.
Research on prognosis of fibroblast after injection In vivo
DING Xiaobang,WANG Jian,CAO Yilin.
Plastic Surgery Hospital,Peking Union Medical College,Chinese Academy of Medical Science,Beijing 100144,China.Corresponding author:Cao Yilin(E-mail:Yilincao@yahoo.com).
Objective To investigate the prognosis of mouse C57BL/6-GFP fibroblast after injection in vivo.Methods Fibroblasts were derived from Green Fluorescent Protein(GFP)transgenic mice.The 3rdpassage of fibroblasts were harvested and injected subcutaneously into the scalp of nude mice with density of 20×106cells/mL.Night OWL LB983 imaging system, fluorescence microscope,histological examination and GFP immunohistochemistry were used to investigate the prognosis of the fibroblasts around the injection area at 1,2,3,6 and 12 week after injection.Results Large amount of fibroblasts were observed 2 weeks after injection,less fibroblasts were observed 3 weeks after injection and only a few fibroblasts were found 12 weeks after injection.As time went by,a few fibroblasts could be detected.Conclusion The fibroblast injection is not indication for facial rejuvenation.
Green Fluorescent Protein;Fibroblast; Hypodermic injection;Prognosis
Q813.1+2
A
1673-0364(2011)04-0181-05
2011年6月16日;
2011年7月21日)
10.3969/j.issn.1673-0364.2011.05.001
北京市科委科技计划重大项目(D090800046609003),卫生部部属医院临床学科重点项目,国家自然科学基金青年科学基金项目 (30801192),北京市自然科学基金(7102134),高等学校博士学科点专项科研基金(新教师基金课题, 200800231078)。
100144 北京市 北京协和医学院,中国医学科学院整形外科医院。
曹谊林(E-mail:yilincao@yahoo.com)。

