CD40-CD40L在儿童过敏性紫癜发病机制中的作用研究
崔丽霞
(郑州市妇幼保健院儿科,河南郑州450012)
过敏性紫癜(HSP)是儿童时期常见的皮肤或其他器官过敏所致血管炎性疾病,表现为皮肤瘀点、瘀斑、关节酸痛、腹部症状和肾脏损害等的综合征,其病因和发病机制尚未完全明确。大量研究结果表明,HSP患儿存在免疫调节功能紊乱,表现为血浆中IgA、IgE水平的异常增高。本研究通过测定HSP患儿治疗前后外周血单个核细胞中CD40-CD40L的表达情况,探讨其与HSP患儿免疫紊乱发生的关系,进一步研究HSP的发病机制,为寻找新的免疫治疗手段提供实验依据。
1 资料与方法
1.1 一般资料
2008年3月~2010年12月收住院的30例HSP患儿均符合HSP的诊断标准[1]。其中男16例,女14例,年龄5~12岁,平均10.4岁,分别于治疗前及治疗后(潘生丁、维生素C、钙剂、有感染者加抗感染药物,有腹痛或尿异常者给予强的松治疗)病情缓解时采集静脉血;对照组30例,选取自门诊体检的健康儿童,年龄4~12岁,男17例,女13例,平均10.1岁。各组年龄、性别比较差异无统计学意义(P>0.05)。
1.2 主要试剂
单克隆荧光标记抗体CD40-FITC、CD40L-PE均购自eBioscience公司。
1.3 实验方法
用密度梯度离心法提取外周血单个核细胞,取100µL单个核细胞悬液分别加入含CD40-FITC、CD40L-PE各10µL的试验管中,混匀后20~25℃避光孵育20~30min,PBS液洗涤后用流式细胞仪(FACScan,BD公司)检测。每份标本均设有阴性对照。
1.4 统计学处理
2 结果
与对照组比较,CD40L在治疗前和治疗后的表达均增高(分别为P<0.01,P<0.05),CD40在两组的表达增高,但差异无统计学定义(P>0.05);
CD40L在治疗前表达高于治疗后(P<0.05),CD40在治疗前表达高于治疗后,但差异无统计学意义(P>0.05)。见表1。
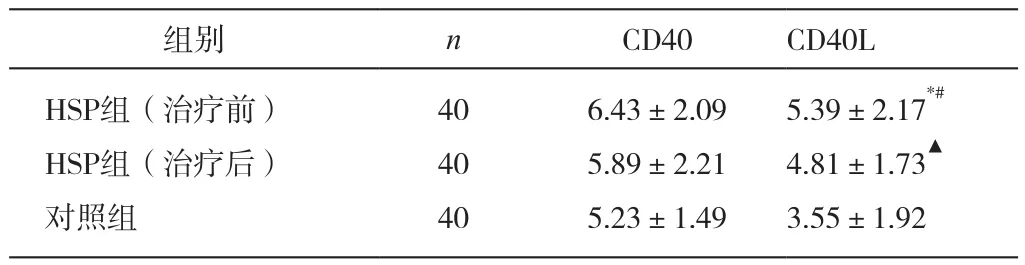
表1 HSP患儿治疗前后外周血单个核细胞CD40、CD40L的表达情况(%)
3 讨论
过敏性紫癜是儿童时期最常见的一种由免疫复合物介导的系统性血管炎。血管壁因免疫损伤而导致通透性增高,血液和淋巴液渗出,引起皮肤、黏膜、关节、胃肠道、肾脏等多部位病变。其临床特点是血小板不减少性紫癜,常伴关节肿痛、腹痛、血便、血尿和蛋白尿等,病因尚不明确。有研究指出,病毒、细菌感染或动物性食物蛋白过敏是其最主要的诱因[2]。肾脏受累程度是决定HSP预后的主要因素。Davin等[3]发现,超过20%的紫癜性肾炎患儿最终发展为慢性肾衰竭,给患儿及其家属带来了极大的经济和心理负担。患儿急性期血浆炎症性细胞因子增高以及淋巴细胞凋亡延迟等均表明该病为免疫反应异常所致的血管炎症性疾病。实验证明,过敏性紫癜患者外周血淋巴细胞CD23高表达,且和血清中IgE浓度呈正相关,表明过敏性紫癜患者体内的B淋巴细胞处于高激活状态[4]。多项研究表明,HSP患儿急性期存在T细胞功能紊乱,在抗原物刺激下导致B 细胞多克隆活化,在HSP发病机制中可能具有重要作用。
CD40-CD40L为体内特异性免疫系统重要的一对共刺激分子,其相互作用可以降低抗原活化静止B细胞的阈值,诱导B细胞增殖、免疫球蛋白类型转换及抗体的合成和分泌,在机体的体液免疫和细胞免疫反应中均起重要作用,其表达异常与某些炎症反应、自身免疫性疾病和免疫缺陷病密切相关。本实验结果显示,CD40L表达与对照组相比明显增高,与朱国际[5]研究结果一致,表明CD40L在HSP的发病过程中可能起到重要作用,由于T细胞功能紊乱,B细胞多克隆激活,CD40L表达异常增高,从而导致免疫球蛋白产生异常。实验亦显示治疗前表达高于治疗后,表明病情缓解时患儿体内免疫调节紊乱得到纠正,而应用特异性单克隆抗体治疗HSP,尤其是目前尚无特效治疗的紫癜性肾炎可能会取得较好疗效。
[1] 胡亚美,江载芳. 实用儿科学[M].第7版. 北京:人民卫生出版社,2002:635.
[2] Sileikiene R,Tamakauskiene E,Baksiene D. Henoch-Schonlein purpuraone of the most common types of systemic vasculitis in childhood[J]. Medicine,2003,39(5):476-479.
[3] Davin JC,Weening JJ. Henoch-Schonlein purpura nephritis:an update[J]. Eur J Pediatr,2001,160(12):689-695.
[4] 许天友,罗芳. 过敏性紫癜小儿CD23的表达及意义[J]. 中国当代儿科杂志,2010,12(1):69-70.
[5] 朱国际. 儿童过敏性紫癜CD40-CD40L的表达[J]. 中国血液流变学杂志,2005,15(1):115-116.

