多途径干预HH cy致兔动脉粥样硬化的对比研究
康爱英 王国庆
南阳医学高等专科学校 南阳 473058
近年研究发现,高同型半胱氨酸血症(HHcy)是诱发动脉粥样硬化(AS)的独立危险因素[1],因此,开展HHcy致AS的防治研究是心、脑血管病领域的热点问题。目前,对HHcy的防治多集中在补充叶酸和维生素B6、B12方面,而牛磺酸(Taurine,Tau)和中药丹参(Salvia M iltiorrhiza)对HH-cy的影响国内外少有报道。本文采用高蛋氨酸饮食的方法建立HHcy兔动物模型,观察HHcy致AS形成机制;比较分析牛磺酸、维生素及丹参对HHcy所致AS的干预效果,为HHcy的防治,延缓或阻止AS的形成,降低心、脑血管病的发生风险开辟新途径。
1 材料与方法
1.1 药品、仪器 L-蛋氨酸购自张家港市华昌药业有限公司,牛磺酸上海伯奥生物科技公司提供。同型半胱氨酸(H cy)、丙二醛(MDA)、超氧化物岐化酶(SOD)、总胆固醇(TC)、甘油三酯(TG)、一氧化氮(NO)、内皮素(ET)、血栓素B2(TXB2)试剂盒购自北京九强生物技术和南京建成有限公司。美国GELg-9彩色多普勒超声诊断仪,TBA-120FR生化分析仪,日本JVCTK-C921EC显微镜摄像机、OLYM PUSCX31显微镜,德国m ICROMGMBH Hm 200切片机、CSˉ摊片机。
1.2 动物分组 筛选健康雄性家兔50只(武汉嘉禾实验动物公司提供),月龄3~5个月,体质量1.5~2.0 kg,标准饲料适应性喂养2周,随机分为对照组(NC)、蛋氨酸组(Met)、牛磺酸组(Tau)、维生素组(V it)、丹参组(SM)5组,每组10只。
1.3 H hcy动物模型的建立 (1)蛋氨酸饲料的制备:标准饲料按家兔标饲配方制成,在标饲中添加2%的蛋氨酸即为蛋氨酸饲料。(2)丹参口服液由南阳医专中医药教研室用丹参经煎制、过滤、浓缩为1g/m L(以生药计),经高压灭菌备用。(3)动物饲养:NC组喂标准饲料;Met组喂蛋氨酸饲料;Tau组蛋氨酸饲料+牛磺酸0.3g/(kg◦d)只灌胃;Vit组蛋氨酸饲料+叶酸1.5 mg/(kg◦d)、VB120.25 mg/(kg◦d)、VB620 mg/(kg◦d)灌胃;SM组蛋氨酸饲料+丹参口服液3.3 g/(kg◦d)灌服。动物饲料按100g/(d◦只)计算,分笼饲养,隔周称重,连续喂养8周。(4)Hhcy模型判定:0周时测定各组兔血浆H cy含量,确定正常参考值;4周时再次检测,以血浆Hcy水平超过正常参考值上限,判定HHcy病理模型是否成功。
1.4 生化指标检测 分别于第0周、4周、8周末时,自兔耳缘静脉采血2 m L,用酶法或比色等法测定Hcy、TC、TG、NO、M DA、SOD、ET、TXB2含量,试剂盒由北京九强和南京建成公司提供。
1.5 血管超声检查 用彩色多普勒超声诊断仪,血管探头频率为4~10 MHz,分别于第4周、8周末对各组家兔进行腹主动脉血管超声检查,测量动脉内-中膜厚度(IM T)及血流峰值(Vp)。同时观察血管内膜光滑程度、有无粥样斑块形成。
1.6 病理学检查 实验8周末,处死动物,取腹主动脉血管,10%福尔马林固定、取材、石蜡切片、H-E染色,光镜观察。
2 结果
2.1 各组家兔血浆H cy含量变化 0周时各组家兔血浆H cy含量16.67~22.44μmol/L(即正常参考值),超过上限确定为HHcy。实验期间各组家兔一般情况良好,Met组有2只、Tau组1只死亡。各组兔血浆H cy含量变化见表1。
表1 各组家兔血浆H cy含量比较 (±s,μmol/L)

表1 各组家兔血浆H cy含量比较 (±s,μmol/L)
注:与NC组比较,*P<0.05,**P<0.01;与Met组比较,★P<0.01;与Tau组比较,◆P<0.05,◆◆P<0.01
组别0周(只)4周(只)8周(只)NC组18.15±1.71(10)18.12±1.33(10)19.09±1.20(10)Met组19.34±1.65(10)62.92±2.26(9)**65.23±1.12(8)**Tau组18.47±1.02(10)57.03±2.19(10)**58.27±2.25(9)**SM组18.13±2.01(10)53.44±2.33(10)**56.37±1.29(10)**Vit组19.23±2.47(10)32.53±1.28(10)*★◆22.35±2.30(10)★◆◆
2.2 各组家兔血清TC、TG、MDA、SOD含量变化 各组血清TC、TG、MDA、SOD含量变化见表2。
表2 各组家兔血清TG、TC、MDA、SOD含量比较 (¯±s)

表2 各组家兔血清TG、TC、MDA、SOD含量比较 (¯±s)
注:与NC组同期比较,*P<0.05,**P<0.01;与Met组同期比较,﹟P<0.05,﹟﹟P<0.01
组 别时间n TG(mmol/L)TC(mmol/L)M DA(μmol/L)SOD(U/m L)NC组4周10 1.05±0.13 1.56±0.11 21.83±7.32 368.32±25.14 8周10 1.06±0.09 1.57±0.12 22.32±6.02 370.28±23.46 Met组4周9 1.21±0.03*1.74±0.08*40.06±9.03**311.58±24.38**8周8 1.41±0.09*1.93±0.14*45.27±8.16**285.35±26.30**Tau组4周10 1.13±0.10 1.56±0.16#28.27±5.11*#406.69±22.06##8周9 1.12±0.11 1.61±0.15﹟24.36±6.72##423.28±24.21##SM组4周10 1.07±0.11#1.52±0.16#26.20±0.18#439.62±27.63##8周10 1.02±0.07#1.66±0.13#23.12±0.17##473.69±28.09##V it组4周10 1.08±0.12#1.59±0.10 25.24±5.58#416.16±18.97##8周10 1.09±0.12#1.65±0.18#22.48±7.44##420.48±21.56##
2.3 各组家兔血清NO、ET、TXB2含量变化 实验8周时,各组血清NO、ET、TXB2含量变化见表3。
表3 实验8周各组家兔NO、ET、TXB2含量比较 (±s)
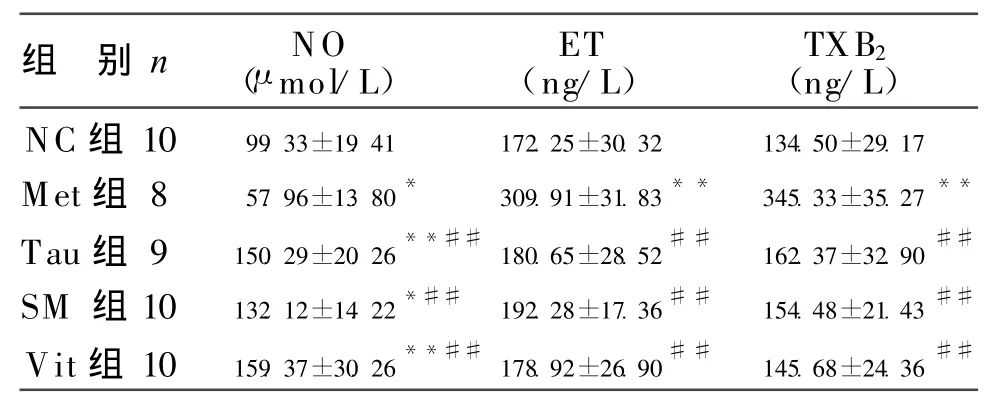
表3 实验8周各组家兔NO、ET、TXB2含量比较 (±s)
注:与NC组比较,*P<0.05,**P<0.01;与Met组比较,#P<0.05,##P<0.01
组 别n NO(μmo l/L)ET(ng/L)TXB2(ng/L)NC组10 99.33±19.41 172.25±30.32 134.50±29.17 Met组8 57.96±13.80*309.91±31.83**345.33±35.27**Tau组9 150.29±20.26**##180.65±28.52##162.37±32.90##SM组10 132.12±14.22*##192.28±17.36##154.48±21.43##V it组10 159.37±30.26**##178.92±26.90##145.68±24.36##
2.4 各组家兔腹主动脉超声检查结果比较 实验4周时,NC组血管内膜线细、光滑、连续性好;M et组血管内膜欠光滑,边缘不整齐,有中等偏低回声团块(即软斑形成);Tau、SM和V it干预组无明显改变。8周末,M et组血管IM T明显增厚(P<0.01),有偏强回声团,斑块边界不清,Vp显著增快(P<0.01)。Tau、SM和Vit干预组与Met比较IM T显著减小,Vp显著减慢(P<0.05),均未见斑块形成,3组间比较差异无显著性。
2.5 各组家兔腹主动脉血管病理变化 大体观察:沿腹主动脉管壁剪开,NC组无斑块形成,M et组可见不规则隆起斑块。光镜下观察:NC组血管内膜薄而光滑,连续性好,中膜平滑肌细胞排列整齐,管壁厚薄均匀。M et组:血管内膜明显增厚,斑块突出于内膜面,内膜下大量排列不规则的平滑肌细胞,中层结构紊乱,斑块深部的泡沫细胞有变性坏死、崩解,形成细颗粒状粥糜样物质,中膜变浅,浅层肌纤维分离断裂。Taut、SM和Vit干预组血管内膜光滑,8周时内膜有轻度增厚,内膜下有少量含脂质的泡沫细胞,中膜平滑肌细胞排列整齐,管壁厚薄均匀。
3 讨论
AS、脑卒中、冠心病是现代医学中最大的医学难题,由此而引起的致死率在中国乃至全世界都直线上升。近年的研究证实HH cy是AS新的、独立的危险因子,引起HHcy的原因有营养因素或遗传因素。
3.1 HHcy家兔病理模型制备成功 本研究给家兔喂饲高蛋氨酸饲料,实验第0周、4周、8周时测定血清Hcy水平,Met组血清H cy含量均显著高于同期NC组,表明兔HHcy模型制备成功。腹主动脉超声及组织学检查显示,血管内膜明显增厚,中层结构紊乱,有细颗粒状粥糜样物质及斑块形成,均为动脉硬化改变,故认为,HHcy可引起动脉血管发生病理改变,是致AS的独立危险因素。
3.2 HHcy致动脉粥样硬化的机制 HHcy致动脉粥样硬化的机制目前尚未完全阐明,可能与血管内皮损伤和功能失调、刺激血管平滑肌增值、促进血小板聚集、破坏体内凝血与纤溶之间的平衡等因素有关[2]。血管内皮细胞作为血管壁与血流之间的屏障,其损伤和功能的减退是动脉粥样硬化的重要始动因素。H cy升高可通过氧化应激及活性氧基团导致内皮功能紊乱,引起血管内皮损伤。实验中发现,Met组家兔血清MDA、TG、TC、ET和TXB2含量显著高于NC组,而NO含量、SOD活力则明显降低。结果提示,HHcy家兔体内氧化应激增强,Hcy是多功能损伤因子[3],其分子中含自由的巯基,在自身氧化生成同型胱氨酸的同时,生成多种强氧化产物(如H2 O2、氧自由基等),造成血管内皮细胞损伤和强烈的毒性作用,并启动细胞膜脂质过氧化反应,使MDA产生增多,消耗了SOD等自由基清除系统;而且H cy的升高可抑制SOD的表达和分泌,导致内皮细胞抗氧化机制受损[4],并加强了超氧自由基介导的NO灭活作用,引起内皮细胞功能失调,破坏细胞的完整性,使血管内皮细胞骨架结构发生变化;Hcy还能促进脂蛋白的沉积,并被巨噬细胞吞噬形成泡沫细胞,损伤血管内皮细胞,引起动脉粥样硬化斑块形成。
本实验M et组家兔血清ET、TXB2显著增多,NO含量明显减少,与文献报道相符。家兔腹主动脉内膜发生明显病理改变,充分表明HH cy家兔体内正常的血管内环境稳定被破坏,是因为Hcy升高损伤了血管内皮,促进血管平滑肌细胞增殖、迁移,使多种血管活性物质的生成和分泌失衡[5],即收缩血管,促进血小板聚集和血栓形成,刺激平滑肌细胞增殖的ET、TXB2增多,而血管松弛因子NO含量减少,从而导致内皮依赖性血管舒张功能失调,促进AS的发生和发展。
3.3 FA、B6、B12有效地降低血浆H cy水平 FA在体内还原为四氢叶酸,参与甲基的转移;维生素B12为蛋氨酸合成酶的辅酶,催化N5-甲基四氢叶酸脱去甲基再生成四氢叶酸,而Hcy获得甲基生成蛋氨酸。维生素B6是胱硫醚合成酶的辅酶,催化Hcy与丝氨酸结合成胱硫醚,进一步分解代谢。本实验V it干预组血清Hcy、MDA、ET、TXB2含量显著低于Met组,NO含量、SOD活力明显升高;血管超声及组织学观察,内膜较光滑,内膜及中膜平滑肌细胞未见增生,与NC组比较无显著差异。提示FA、VB6、VB12是同型半胱氨酸代谢主要的辅助因子,加速了H cy再甲基化或硫化进程,有效降低H cy水平,从而减轻血管内皮的损伤、血管平滑肌的增值,阻止或延缓了AS发生。
3.4 牛磺酸的抗动脉硬化作用 牛磺酸是一种含磺酸基的自由氨基酸,不参与蛋白质的合成,长期被看作是含硫氨基酸代谢的无功能产物。近年研究发现[6],牛磺酸具有维持渗透压、稳定细胞膜、调节细胞钙稳定、清除自由基、抑制脂质过氧化等生物学效应。HHcy还可导致大鼠血管内皮细胞结构受损,弹力纤维层排列紊乱、血浆ET含量增加,外源性增补牛磺酸完全抑制了H cy诱导的上述血管病变。
本研究Tau组家兔血清MDA、ET、TXB2含量显著低于M et组,NO含量、SOD活力明显升高,而H cy含量显著高于NC组但与Met组比较无显著差异;血管超声及组织学观察,血管内膜光滑,IM T比Met组显著变薄,Vp显著减慢,与NC组比较无显著差异。结果显示,牛磺酸不仅抑制Hcy诱导的呼吸链电子漏出及氧自由基生成[7]和脂质过氧化,降低MDA含量,增加SOD活力,拮抗Hcy引起的氧化应激损伤;还可上调NO含量,降低ET、TXB2水平,从而起到舒张血管,保护内皮细胞作用。牛磺酸作为H cy的生物拮抗剂,可不通过降低血浆H cy水平而直接拮抗H cy引起的血管病变和氧化应激损伤,从而发挥抗AS形成的作用。
3.5 丹参对HH cy家兔动脉粥样硬化形成的干预作用 本研究中SM组血浆Hcy含量高于NC组,但与M et组同期比较TG、TC、MDA、ET、TXB2含量显著降低,NO、SOD活显著升高;血管超声及组织学观察无斑块形成,故认为丹参不但有抗高脂血症引起的AS,而对HH cy所致家兔动脉粥样硬化的形成也有干预作用。其机制可能是丹参的有效成分丹参酮具有天然抗氧化作用[8],通过消除脂类自由基而阻断脂质过氧化的链式反应;降低缩血管成分ET、TXB2水平,提升血管松弛因子NO含量,起到舒张血管,保护内皮细胞;调节HHcy家兔体内凝血与纤溶之间的平衡等因素,从而发挥其延缓或阻止HHcy兔动脉粥样硬化形成的作用。
综上所述,高蛋氨酸饮食可诱发家兔HHcy,Hcy升高可通过损伤血管内皮、促进血管平滑肌增殖等机制,导致AS的发生。外源性补充FA、B6、B12加速Hcy代谢,降低血浆Hcy水平,减轻血管内皮的损伤;牛磺酸和丹参虽不能降低血浆H cy含量,但通过抑制Hcy诱导的氧化应激和细胞增值,调节血管舒缩及凝血与纤溶之间的平衡等因素,发挥其抗AS形成的作用。可见丹参、牛磺酸、维生素通过不同途径干预HH cy家兔AS形成,其干预效果维生素和丹参优于牛磺酸。
[1] 穆红,陈欣.亚甲基四氢叶酸还原酶基因突变与心脑血管梗死发生的关系[J].国外医学临床生物化学与检验学分册,2005,26(3):145-147.
[2] 刘娜,张书平,曹治宸,等.高同型半胱氨酸血症对老年人血管疾病的影响[J].临床荟萃,2003,18(19):1 139-1 141.
[3] 耿彬,常林,杜军保,等.防止高同型半胱氨酸血症的新策略[J].北京大学学报,2005,37(2):215-219.
[4] 刘晓军.高同型半胱氨酸血症致动脉粥样硬化机制研究进展[J].肠外与肠内营养,2007,14(2):120-125.
[5] 孟磊,高炜,赵春玉,等.高同型半胱氨酸血症引起家兔动脉硬化[J].北京大学学报,2001,33(6):536-539.
[6] 石彦荣,唐朝枢.牛磺酸的跨膜细胞转运[J].国外医学◦生理病理科学与临床分册,2001,61:453-456.
[7] 常林,赵晶,徐建兴,等.牛磺酸抗同型半胱氨酸诱导的线粒体呼吸链自由基生成和同型半胱氨酸抑制线粒体牛磺酸转运体[J].中国病理生理杂志,2004,20:1 126-1 133.
[8] 董春桃.丹参药理作用与临床应用进展[J].山西医药杂志,2007,1(1):54-55.

