一种简化的马来酸桂哌齐特的合成方法
金晓峰,田春贵,周付潮,江天驰,严 军
(1.上海医药工业研究院 联合实验室,上海 200040;2.常州制药厂有限公司合成实验室,江苏 常州 213018;3.黑龙江大学 化学化工与材料学院,哈尔滨 150080)
0 引 言
马来酸桂哌齐特 (Cinepazide Maleate),化学名为1-[(1-吡咯烷羰基)甲基]-4-(3,4, 5-三甲氧基肉桂酰基)哌嗪顺丁烯二酸盐,分子式为C26H35N3O2,马来酸桂哌齐特具有弱钙离子阻滞作用,能阻止钙离子跨膜进入血管平滑肌细胞内而引起平滑肌松弛,使脑血管、冠状血管、外周血管扩张,使血管痉挛缓解,阻力下降,血流量增加[1];另可以抑制血小板凝聚,减少氧自由基产生,减少中性粒细胞对血管内皮细胞的趋化,提高红细胞的韧性和变形能力,并降低血液黏度,从而改善微循环灌注[2]。临床适应症主要有脑血管疾病[3-4]、心血管疾病[5-6]、外周血管疾病[7]、眼底血管病引发的耳鸣耳聋[8-9]等。1992年法国狄朗药厂生产的桂哌齐特注射液曾获准进口我国,在2002年北京四环制药有限公司获得了生产马来酸桂哌齐特的生产批文。
相关文献 [10-14]报道了其合成方法,主要都采用了3,4,5-三甲氧基肉桂酸经酰化得到3, 4,5-三甲氧基肉桂酰氯,再与1-[(1-吡咯烷羰基)甲基]哌嗪反应得到桂哌齐特游离碱,然后再与马来酸成盐得到马来酸桂哌齐特的路线,但是该路线中的3,4,5-三甲氧基肉桂酰氯很不稳定,易水解,给生产过程带来很大的不便且致使终产品的质量得不到保障,更不适合于湿度较大的南方气候。
本研究在参考相关文献 [15-17]基础之上,通过不同实验的研究与比较,进行了反应条件改进和优化,得到了一锅法制备桂哌齐特游离碱的方法,一锅法不再受湿度等环境因素的影响,且马来酸桂哌齐特产品的质量可以得到稳定的保障,该法与其他方法相比:①降低了成本提高了收率;②简化了后处理操作过程,更适合工业化生产;③操作过程不受环境因素的影响,进一步保证了产品的质量。反应方程式见图1。
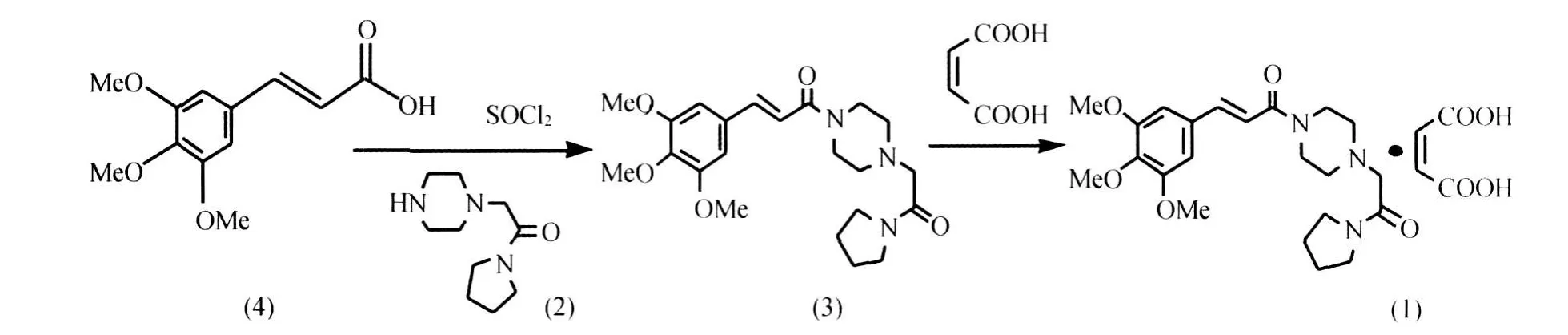
图1 (1)的合成路线Fig.1 Synthetic route of(1)
1 实 验
1.1 仪器与试剂
熔点用YRT-3型药物熔点仪测定,温度未经校正;高效液相色谱仪用Waters-2487色谱仪检测;日本JEOL公司JMS-T100LC(AccuTOF)型质谱仪;Avance400MHz超导核磁共振仪(DMSO为溶剂,TMS为内标)。
所用试剂均为分析纯。
1.2 合 成
1.2.1 桂哌齐特游离碱(3)的合成
将3,4,5-三甲氧基肉桂酸 (4)600 g (2.52 mol)加入到2 000 mL二氯甲烷中,加热至完全溶解,搅拌下加入450 g(3.78 mol)氯化亚砜,回流反应3 h,滴加1-[(1-吡咯烷羰基)甲基]哌嗪(2)500 g(2.52 mol)的二氯甲烷溶液,继续搅拌回流30 min后,降至室温,加入5%氢氧化钾溶液调pH=10~12,搅拌30 min,分出水层,向有机层中加5%的盐酸500 mL,充分搅拌,分液,有机层用5%盐酸500 mL分别提取两次,合并所有水层,以10%的氢氧化钾溶液调节pH值=9,加入1 500 mL二氯甲烷提取3次,合并有机层,以1 000 mL水洗涤两次,加入硫酸钠干燥。过滤,加入活性炭搅拌30 min脱色处理,过滤,将有机层常压浓缩,得油状物,加入1 500 mL乙酸乙酯,加热溶解,冷却至3~5℃,搅拌析晶2 h,得黄色固体 (3)682 g。产率: 65%,mp125~128℃。
1.2.2 马来酸桂哌齐特(1)的合成
取上述中间体(3)680 g(1.63 mol),溶于无水乙醇3 400 mL中,并加入马来酸190 g(1.63 mol)。搅拌溶解,冷却至室温静止8 h,抽滤得到白色固体,加入丙酮,搅拌溶解,回流30 min,冷却至室温,抽滤,干燥,得到白色晶体782 g,纯度99.86%(HPLC面积归一化法)。产率: 90%,mp173~174℃ [文献 [5]:mp170~175℃]。
2 结果与讨论
2.1 分析结果
IR分析(图2)表明(1)在3 448 cm-1出现了宽峰及1 612 cm-1出现的极强峰,对应分子结构中的羧酸盐结构;1 655 cm-1出现的特征吸收峰,表明分子结构中存在叔酰胺结构;1 528 cm-1、 1 503 cm-1处的特征吸收峰及相关峰,表明分子结构中存在苯环结构。由867 cm-1特征吸收峰的存在,推断分子结构中存在 “1,2,3,5-四取代苯环”基团;由 2 946 cm-1、2 845 cm-1、1 451 cm-1及1 277 cm-1处的吸收峰,表明分子中存在与芳环连接甲氧基;由2 976 cm-1、2 875 cm-1、1 434 cm-1处的吸收峰,归属为分子中的亚甲基; 965 cm-1处的特征吸收峰,表明分子结构中存在与苯环共轭的反式双键结构。
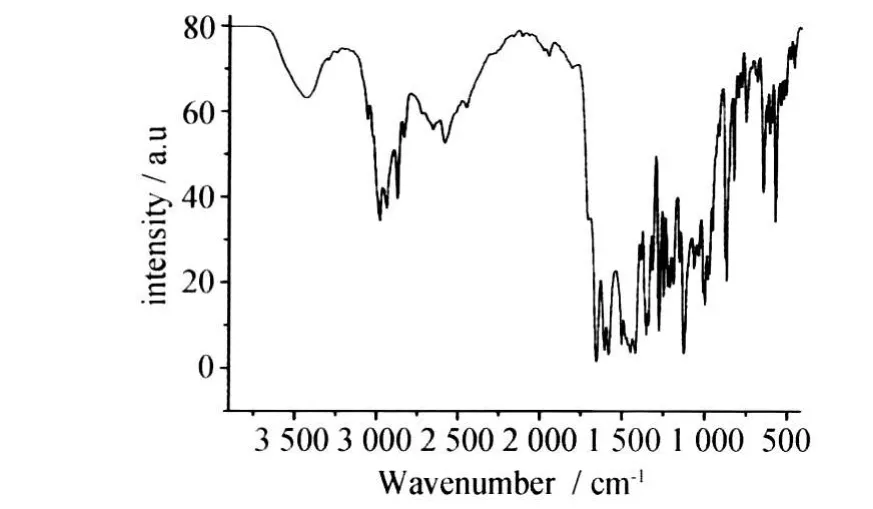
图2 产品(1)的IR图谱Fig.2 IR spectrum of the product(1)
通过对(1)的1H-NMR图谱(图3)和数据进行解析1H NMR(CDCl3):δ 1.83(m,2H, -CH2-),δ 1.92(m,2H,-CH2-),δ 3.14 (brs,4H,2×-CH2-),δ 3.36(m,2H,-CH2-),δ 3.39(m,4H,2×-CH2-),δ 3.67 (s,3H,OCH2),δ 3.83(s,6H,2×OCH2), δ 3.99(brs,4H,2×-CH2-),δ 6.08(s,2H, 2×-CH=),δ 7.06(s,2H,2×ArH),δ 7.18 (d,1H,J=12.2 ArH),δ 7.49(d,1H,J= 12.2 ArH),可以证明产品测试结果与马来酸桂哌齐特完全相符。
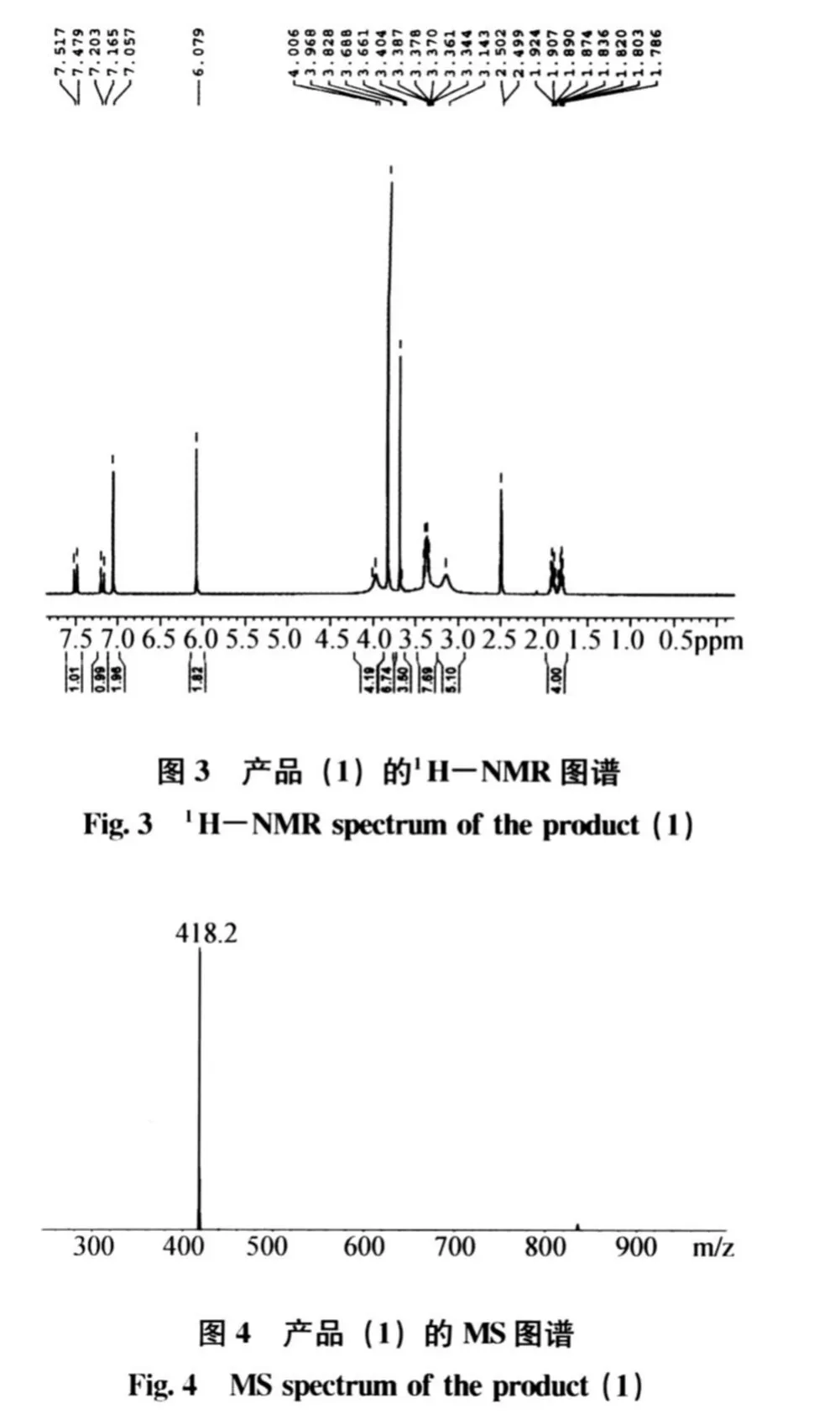
MS分析结果表明:马来酸桂哌齐特碱基 [M +1]分子离子峰为418.2(图4),计算其分子量约为417.2,与马来酸桂哌齐特碱基分子量相符。
2.2 桂哌齐特游离碱(3)合成条件的选择
3,4,5-三甲氧基肉桂酸 (4)为2.52 mol,反应物摩尔比r=n(4)∶n(SOCl2)∶n(2),考察反应条件对合成(3)的影响。
2.2.1 反应物摩尔比r
其他反应条件同1.2,考察r对合成(3)的影响,结果见表1。由表1可见,产率随着r的提高相应提高,当r=1.0∶1.5∶1.0时,产率65%,再加大r,产率增加幅度不大,综合考虑r宜选择1.0∶1.5∶1.0。
2.2.2 析晶温度
其他反应条件同1.2,考察析晶温度对合成(3)的影响,结果见表2。由表2可见,温度对析晶收率有明显影响,在3~5℃析晶,产率65%,再降低温度对产率影响很小,因此选择3~5℃析晶。
2.2.3 析晶时间
其他反应条件同1.2,考察析晶时间对合成(3)的影响,结果见表3。由表3可见,析晶2 h,产率基本保持稳定,故析晶最佳时间选为2 h。
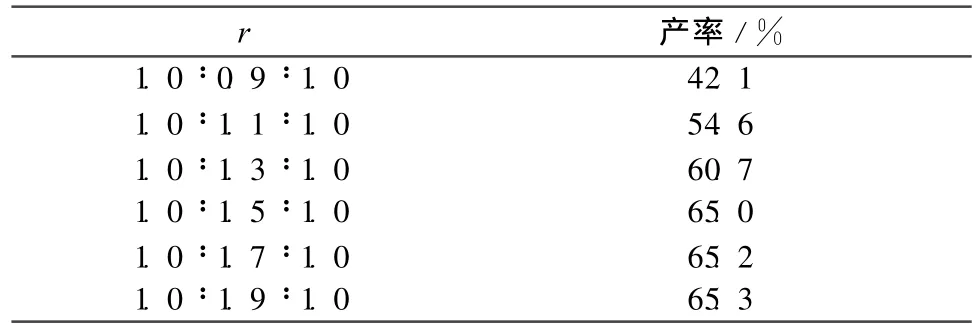
表1 反应物摩尔比r对合成(3)的影响Table 1 Effect of molar ratio of the reagents on the synthesis of(3)
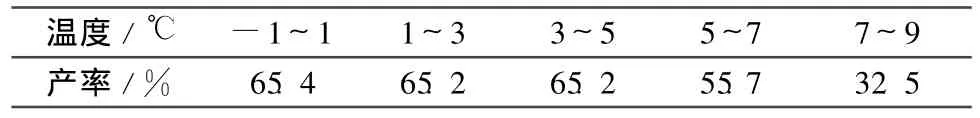
表2 析晶温度对合成(3)的影响Table 2 Effect of crystallization temperature on the synthsis of(3)
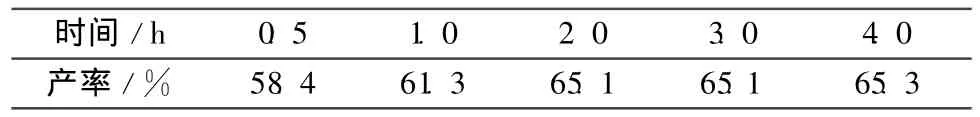
表3 析晶时间对合成(3)的影响Table 3 Effect of crystallization time on the synthesis of(3)
在n(4)∶n(2)=1:1的前提下,随着氯化亚砜量的增加,收率呈现递增趋势,当氯化亚砜量≥1.5倍量时,过多的氯化亚砜不再起到催化作用,收率几乎不再提高;析晶温度在-1~5℃基本没有变化,当从5℃逐渐升温到9℃时,由于温度的升高增大了乙酸乙酯的溶解度,从而导致结晶收率明显呈现下降趋势;当析晶时间<2 h时,收率呈现降低趋势,当析晶时间≥2 h时,结晶趋于饱和,收率基本不再受结晶时间的影响而发生明显变化。综上所述,最终确定了反应的最佳条件。
3 结 论
发展了一种简化的马来酸桂哌齐特的合成方法。其中,合成桂哌齐特游离碱(3)的最佳反应条件为:3,4,5-三甲氧基肉桂酸 (4)为2.52 mol,反应物摩尔比r=1.0∶1.5∶1.0,冷却至3~5℃,搅拌析晶2 h。
[1]耿洪叶,王少华.使用药物治疗学[M].北京:人民卫生出版社,2006:1 060-1 061.
[2]Gronstein BN.Adenosine,Enendogenous ant Inflammatory Agent[J].J APPL Physiol,1999,96(1):5-7.
[3]赵迎春.克林澳治疗脑梗死63例疗效观察[J].中华临床医学研究杂志,2003,72(8):11 928-11 930.
[4]曾艳芳.缺血性脑血管疾病患者与马来酸桂哌齐特治疗认知功能的作用 [J].中国临床康复,2003,7 (28).3 904-3 905.
[5]谢亚同.马来酸桂哌齐特注射液治疗稳定型劳力性心绞痛[J].中华临床医学月刊,2003,14(2):154-155.
[6]方金瑞,马莉雅.马来酸桂哌齐特注射液治疗糖尿病合并心绞痛的临床观察 [J].中国医院药学杂志, 2004,24(12):760-761.
[7]井爱芬,尹逊莲.马来酸桂哌齐特注射液治疗糖尿病周围血管神经病变70例[J].中国民间疗法,2004, 12(30):53-54.
[8]钟 捷.马来酸桂哌齐特改善巩膜扣带术后眼血供的初步研究[J].四川医学,2004,25(1):63-64.
[9]李玲波.马来酸桂哌齐特治疗突发性聋的临床观察[J].听力学籍言语疾病杂志,2004,12(5):356-356.
[10]Claude P F,Guy M R,Bernard M P,et al.Derivatives of 1-(3,4,-5-trimethoxycinnanoyl)Piperazine and Process for ther Preparation[P].American:US 3634411,1969.04.01.
[11]Yasuo Itho,Hideo Kato,Eiichi Koshinaka et al.1-(3,4,5-T rimethoxycinnanoyl)-4-alkylaminocarbonylethyl Piperazi-nes[P].American:US 4478838, 1984-10-23.
[12]徐 娟,王 林.血管扩张药桂哌齐特的合成研究[J].中国新药杂志,2003,12(8):625-626.
[13]高建华.马来酸桂哌齐特合成方法 [P].中国: CN1631877,2005-06-29.
[14]王雪松,车冯升.马来酸桂哌齐特改进的制备方法[P].中国:ZL200610103455,2009-12-23.
[15]付德才,康 钰,刘 畅,等.一种马来酸桂哌齐特的制备方法 [P].中国:CN 101362738,2009-02-11.
[16]Inoue H,Nishi K,HIrashma T,et al.1-(3,4,5-Trimethoxycinnampyl)Piperazine Derivative[P].Japan:JP61225177,1986-10-06.
[17]李英铁,张宝福,王 宇,等.马来酸桂哌齐特合成工艺的改进 [J].沈阳药科大学学报,2009,269 (20):116-118.

