Tregs对同种异体牙移植免疫排斥反应的抑制作用﹡
金光春 陈从容 李言君 薛江南 姜 玲 李升钟 金东春
(1.滨州医学院,山东烟台264003;2.韩国延世大学,首尔120-752;3.延边大学,吉林延吉133000))
目前,异体牙移植作为一种器官移植,因免疫排斥问题未得到解决,至今仍有许多问题有待探索。近年来,随着器官移植和免疫抑制剂研究的进展,动物实验已取得了成功。随着手术技巧的成熟和围手术期处理等方面的日益完善,异体牙移植已成为多种实质性器官终末期疾病的有效治疗手段。尽管各种新的免疫抑制剂不断问世,但移植后的排斥反应仍无法完全避免[1-3]。如何消除或降低异体牙移植后的免疫排斥反应,提高异体牙移植的成功率,是临床上亟待解决的问题。而且研究报告不尽相同,尚无统一的定论[6]。本研究针对异体牙移植免疫排斥反应,探求新的、安全有效的新型免疫抑制剂,为异体牙移植术在临床上提供基本资料。
1 对象与方法
1.1 实验对象与实验组
经过血液抗原性确认的20只白鼠(4周龄的Sprague-Dawley系)随机分为两组,同种异体移植组和接受组,选择15只雄性白鼠(30颗上颌左右第1磨牙)为异体牙供者,体重16~20g。选择15只雌性白鼠(20颗上颌左右第1磨牙)为移植牙受体者,体重16~18g,分成具有相同抗原性和不同抗原性两类。1组:免疫抑制剂未处理,分别1周、2周、4周、8周时间段采集实验标本。2组:免疫抑制剂(Tregs)处理,分别1周、2周、4周、8周时间段采集实验标本。保存溶液采用F medium。靶细胞采用Sp-20骨髓瘤细胞。
1.2 生物化学试剂、反应试剂及免疫抑制剂的应用
[3-(4,5-dimethylthiazol-2-yl)-2.5-diphenylte-trazolium bromede,MTT]
溴化二苯四偶氮盐,兔补体,蛋白水解酶。反应试剂是采用10% 二甲基亚砜(dimethyl sulfoxide,DMSO/Sigma Chemical Co.,St.Louis,USA)。术前1天晚和术前20分钟依据实验分组给予免疫抑制剂1次。
1.3 方法
1.3.1 牙移植术 采用Ketamine(0.1mL/100gm,Jaeil JaeDang,Korea)药物麻醉后,用探针进行牙周分离,尽量减少对周围组织外伤的情况下,用特制的拔牙钳子拔除异体牙供者的左右上颌第1磨牙,移植于受体者。
1.3.2 效应细胞的制备 无菌条件下取出同种异体移植组和接受组白鼠脾脏在骨凿器上磨碎,收集益出的淋巴细胞,使用60% Pecoll充分的分离淋巴细胞。
1.3.3 组织学观察 1、2、4、8周时间段进行牙移植术后,处死动物,摘除颌骨,10%福尔马林固定24h,在5%硝酸脱敏溶液中脱敏5d。以牙齿长轴1mm的间隔垂直切片,制备5μm标本,用Hematoxylin-eosin染色并观察牙根吸收程度及周围移植区的免疫排斥反应。光镜下观察各组标本的免疫排斥反应的程度。排斥反应依据Muram[7]的分类分为4级:0级-无排斥反应;1级-轻度反应;2级-中度反应;3级-重度反应。对各组各时间段的病理学标本进行分级分析,观察各组的免疫抑制效果。
1.3.4 细胞免疫学观察 使用流式细胞仪计数检测各组受体血清中T淋巴细胞亚群CD4+和CD8含量。
1.4 统计学分析
计量数据用均数±标准差表示,采用SPSS11.0统计软件进行t检验,P<0.05为差异有统计学意义。
2 结果
2.1 组织学观察
同种异体移植牙术后1周开始观察大多数牙根吸收及周围移植区的免疫排斥反应,发现牙根周围引流的免疫细胞反应。在牙根周围的单核细胞浸润及局部淋巴结内淋巴母细胞的产生。移植牙受体区域纤维血管组织长入,根尖周围牙周韧带细胞大量破坏,组织血管吸收、坏死,大量的炎细胞浸润。分布于骨质表面,形成骨吸收窝陷。免疫抑制剂未处理的实验组术后1周可持续增加排斥反应,植片平均存活时间为(16.82±2.34)d,4周达到顶峰。免疫抑制剂处理的实验组术后2周开始出现免疫排斥反应,至术后2周达到顶峰。植片观察炎细胞浸润,伴有新生血管长入牙槽骨周围,组织切片存活时间显著的延长,为(40.52±1.23)d,差异有统计学意义(P<0.01)。牙根吸收程度及周围移植区的免疫排斥反应,见图1~4。
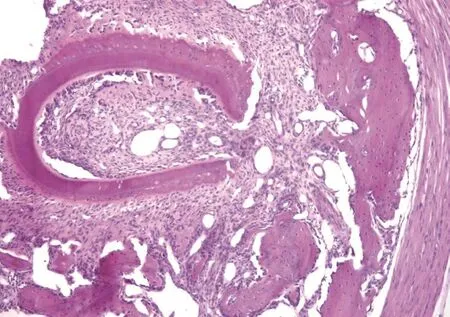
图1 1组:1~2周(HE×100)

图2 2组:1~2周(HE×100)

图3 1组:4~8周(HE×100)
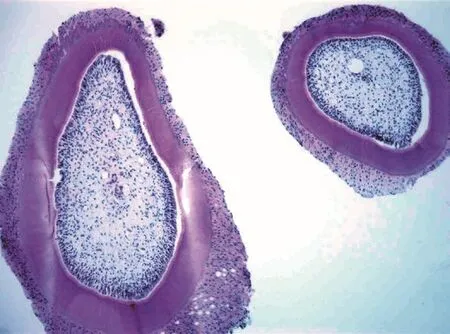
图4 2组:4~8周(HE×100)
2.2 免疫排斥反应分析
免疫检测结果表明同种异体移植接受组组织切片CD8+T细胞产生数量不如CD4+T细胞多,其表达强度明显高于CD8+T细胞阳性细胞。同种异体移植组未观察CD8+T细胞,大部分收集于移植周围区域,见表1。术后4周和8周两组检测值比较,差异有统计学意义(P<0.05)。
表1 各组不同时间CD4+T与CD8+T变化(±s,d)

表1 各组不同时间CD4+T与CD8+T变化(±s,d)
分组 1周 2周 4周 8周1组 86.82±16.27 78.23±9.23 70.88±7.67 32.13±5.39 2组 65.12±23.15 56.05±10.41 59.52±6.55 15.62±4.44
2.3 病理观察
1组与2组不同时间段比较,2组病理学观察明显低于1组(P<0.05),说明抑制剂对同种异体牙移植术后排斥反应的抑制作用。

表2 各组不同时间移植排斥反应变化
3 讨论
异体牙移植面临的一个难题是移植后的排斥反应。因此,研究异体牙移植免疫排斥反应的病理过程及发病机制,寻找有效的预防具有重要意义。
从目前文献报道来看,动物异体牙移植实验或临床异体牙移植病例的成功率约9.6%~83.0%[8-9]。对于异体牙移植排异反应的研究,国外学者大多采用非特异性检测方法,主要有:(1)宿主对来自同一供体的“二次皮肤移植”的加速排斥反应;(2)受植区域内淋巴结中免疫淋巴母细胞的产生。以往的研究认为异体牙牙周膜组织所致的移植免疫反应是导致牙根吸收、影响移植牙存活率和存活时间的重要因素[10]。
目前人们常通过选择和处理异体牙的组织相容性配型试验来消除或降低异体牙移植的免疫排斥反应。常用的决定受体组织配型方法是ABO血型相容性试验、HLA分型试验及组织相容性交叉试验。Wang等[11]发现供受体组织相容性抗原一致的异体牙在移植后1年存活率为85%,而组织相容性抗原不同的异体牙移植后1年存活率只有31%。
免疫抑制剂的使用是抑制同种异体牙移植免疫排斥反应,保证移植术成功的标准之一。寻找较低毒无害的免疫抑制方法也是目前实验研究的重点。为有效抑制排斥反应,在异体移植后应用Tregs的方案,在异体牙移植术中显示了良好的效果。Vossen 等[12]用猪同种异体肢体移植模型实验,确定了免疫抑制方法的可行性,并提出了好的建议。为研究同种异体牙移植的免疫抑制方法和移植术的改进,本研究采用了实验组免疫抑制剂未处理、免疫抑制剂(Tregs)处理,分别1、2、4、8周时间段采集实验,对比观察免疫排斥反应、术后植片存活率等。结果同种异体移植牙术后1周开始出现牙根吸收及周围移植区的免疫排斥反应,观察牙根周围的单核细胞浸润及局部淋巴结内淋巴母细胞的产生。移植牙受体区域纤维血管组织长入,根尖周围牙周韧带细胞大量破坏,组织血管吸收、坏死,大量的炎细胞浸润。分布于骨质表面,形成骨吸收窝陷。免疫抑制剂未处理的实验组术后1周可持续增加排斥反应,植片平均存活时间为(16.82±2.34)d,4周达到顶峰。免疫抑制剂处理的实验组术后2周开始出现免疫排斥反应,至术后2周达到顶峰。植片观察炎细胞浸润,伴有新生血管长入牙槽骨周围,组织切片存活时间显著延长(P<0.01),为(40.52±1.23)d。免疫检测结果表明同种异体移植接受组组织切片CD8+T细胞产生数量不如CD4+T细胞多,其表达强度明显高于CD8+T细胞阳性细胞。同种异体移植组未观察CD8+T细胞,大部分收集于移植周围区域。术后4周和8周两组检测值差异有统计学意义,证明Tregs免疫抑制方法在同种异体牙移植中可以取得有效的免疫抑制效果。
Coutinho等[13]提出CD4+T细胞和CD8+T细胞介导的细胞与移植排异反应有密切联系。CD4+T细胞和CD8+T能改变免疫抑制功能异常地指标,其值也代表了试验的免疫稳定,而且所测的指标可较好地检测免疫排斥反应的发生。在本研究免疫组化观察中,CD4+T细胞表达明显高于CD8+T细胞,分析异体牙移植免疫反应发生是依靠于CD4+T细胞介导反应,此结果与本试验研究结果基本相符,说明CD4+T细胞和CD8+T值可以检测免疫抑制的效果。
异体牙来源丰富,如果找到消除异体牙移植术后并发症的免疫排斥反应的抑制方法,延长异体牙移植术后供体的存活时间,抑制免疫排斥反应,诱导供体免疫耐受,将提高异体牙移植术的成功率,今后有待于深层的研究。本研究针对异体牙移植免疫排斥反应,探求新的、安全有效的新型免疫抑制剂,为异体牙移植术在临床上提供基本资料。
[1] Yang C,Dong Y,Zhong L. The immunogenicity of tooth allografts in mice[J]. Zhonghua Kou Qiang Yi Xue Za zhi,1997,32(3):158-160.
[2] Jager A,Gotz W.Lossdorfer S.Localization of SOST sclerostin in cementocytes in vivo and in mineralizing periodontal ligment cell in vitro[J].J Periodontal Res,2010,45(2):246-254.
[3] Rivere GR,Riviere KH,Smith KS.Molecular and immunological evidence of oral treponema in the human brain and their association with Alzheimer’s disease[J].Oral Microbio immuno,2002,17(2):113-118.
[4] Riviere G,Tarbox G.Teeth transplanted across a multiple non-H2 barreier stimulated weak cell-mediated immunity without memory[J].J Oral Surg,1979,37:477-481.
[5] Waikakul A,Punwutikorn J,Kasetsuwan J.Alveolar bone changes in autogenous tooth transplantation[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2011,111(3):1-7.
[6] Chrcanovic BR,Abreu MH,Custodio AL.Prevalence of enamel pearla in teeth from a human teeth bank[J].J Oral Sci,2010,52(2):257-260.
[7] Muramatsu K,Doi K,Akino T,et al.Longer survival of rat limb allograft:combined immunosuppression of FK-506 ergualin[J].Aca Orthop Scand,1997,68:581-585.
[8] Yang ZP.Chang CS.A 3-year follow-up of a homotransplanted tooth from a tooth bank[J].Journal of Endodontics,1990,16(1):34-37.
[9] Hupp J,Trope M. Periodontal ligament vitality and histologic healing of teeth stored for extended periods before transplantation[J].Endod Dent Traumatol,1998,14:79-83.
[10] Sveen K.,Vindenes H.,Solheim B.G.Selection of allogenic tooth graft using HLA-A,-B,-C and DR typing and the MLC test[J].Int J Oral Surg,1980, 9(6):433-438.
[11] Wang HL,Tsao YP. Histologic evaluation of socket augmentation with mineralized human allograft[J].Int J Periodontics Restorative Dent,2008,28(3):231-237.
[12] Vossen M,Majzoub RK,Edelstein J,et al. Bone quality in swine composite tissue Allograts:effects of combination immunotherapy[J].Transplantation,2005,80(4):487-493.
[13] Coutinho A,Caramalho I,Seixas E. Demengeot thymic commitment of regulatory Tcells is a pathway of TCR-dependent selection that isolates repertoires undergoing positive or negative selection[J].J Curr Top Microbio Immuno,2005,293:43-71.

