壳聚糖在1mol/L HCl中对Q235碳钢的缓蚀性能及机理研究
谭福能,庞雪辉,,隋卫平,张 洁,侯保荣
(1.济南大学 化学化工学院,山东 济南 250022; 2.中国科学院 海洋研究所,山东 青岛 266071)
碳钢因其低廉的成本、良好的力学性能及实用性,广泛应用于工业生产中[1-4]。酸洗方法也广泛用于工业中去除锈蚀及废弃金属上的附着物,盐酸是酸洗液中的一种。为了防止酸洗过程中金属基底不必要的损失及酸洗液的过量消耗,常添加缓蚀剂对在役金属采取一定的保护[5-11]。虽然用缓蚀剂是一种成本低廉、效率颇高和适用性强的措施[12-13],然而近年来工业生产中所使用的缓蚀剂对环境所表现出的生物毒性,尤其是铬酸盐[5]、有机磷[14],已引起各国的重视。因而这类缓蚀剂逐渐被限量或禁止使用[15-16],这促使对缓蚀剂的开发与应用研究,集中在高效、绿色以及多功能等方面。
本研究利用失重实验、动电位极化曲线测试、分析壳聚糖在1 mol/L HCl溶液中的缓蚀性能、缓蚀过程及缓蚀机理,以期为开发一种新型环境友好缓蚀剂提供一定的理论依据。
1 实验
1.1 试剂、材料
实验所用的碳钢型号为 Q235; 盐酸溶液浓度为1 mol/L,由37%分析纯盐酸与未除氧的二次蒸馏水稀释而成; 所需壳聚糖(又称脱乙酰壳多糖,是由甲壳素进一步脱乙酰化后得到的线性、天然含氨基的聚糖),质量浓度为 0.005、0.01、0.02、0.04、0.1、0.2 g/L,用未添加缓蚀剂浓度为1 mol/L的盐酸底液作为空白对照试样。测试时间为 3 h,测试温度为303、313、323、333 K。
1.2 失重测试
将15.3 mm×15.3 mm×30.3 mm的碳钢块用水相砂纸(150#,400#,600#,800#,1000#)逐级打磨,蒸馏水冲洗,丙酮去油、无水乙醇脱水,干燥至恒重,电子天平称重(±0.0001g),测试温度为 303 K,浸没测试时间为3 h。测试完毕后超声清洗腐蚀物,无水乙醇清洗后干燥至恒重。
1.3 动电位极化测试
电化学测试在LK2005Z恒电位仪上进行。采用3电极系统,铂电极为辅助电极,饱和甘汞电极为参比电极,碳钢电极为工作电极。工作电极与腐蚀介质的接触面积为1 cm2,其余部分均用环氧树脂固封。测试温度为303 K,测试前工作电极在待测腐蚀介质中浸泡 5~10 min,然后进行动电位极化测试,扫描电位范围:-1000~0 mV,扫描速率为0.5 mV/s,相关参数用Tafel直线外推法处理得到。
2 结果与讨论
2.1 失重测试
此法是一种检测金属腐蚀速率较经典的方法,根据腐蚀前后金属试样重量的变化来计算金属腐蚀速率,失重法可采用下式计算腐蚀速率:

式中v为金属腐蚀速率(g/m2·h),m0为试样腐蚀前的质量(g),m1为腐蚀并除去腐蚀产物后试样的质量(g),A为试样暴露在腐蚀介质中的表面积(m2),t为测试时间(h),利用下式计算缓蚀率:
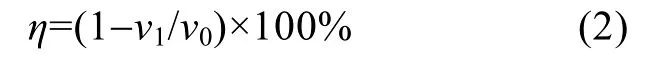
v1为加入缓蚀剂后试片的腐蚀速率(g/m2·h),v0为空白腐蚀介质中试片腐蚀速率(g/m2·h)。
图1为缓蚀效率与缓蚀剂质量浓度的关系。由图 1可知,在任一温度下,随缓蚀剂质量浓度的增大,缓蚀效率开始时显著增大,当缓蚀剂的质量浓度达到 0.1g/L时,缓蚀效率趋于平缓,同时在任一温度下,壳聚糖的缓蚀性能都存在相同的趋势,说明壳聚糖在本文中的测试条件下应有一质量浓度极值,对于这一工作,将在本课题组后续的研究中进行。 不同温度下,空白及添加缓蚀剂的腐蚀液中试样的腐蚀速率与缓蚀剂浓度、温度的关系如图 2所示。
由图 2可知,不同温度下,碳钢在 1mol/L HCl溶液中腐蚀速率随缓蚀剂浓度的增大而显著降低,这表明加入的物质对碳钢在盐酸溶液中的腐蚀有较强的抑制作用,但温度的升高不利于缓蚀剂缓蚀性能的发挥。

图1 缓蚀剂质量浓度与缓蚀效率的关系Fig.1 Relationship between inhibitor concentration and inhibition efficiency
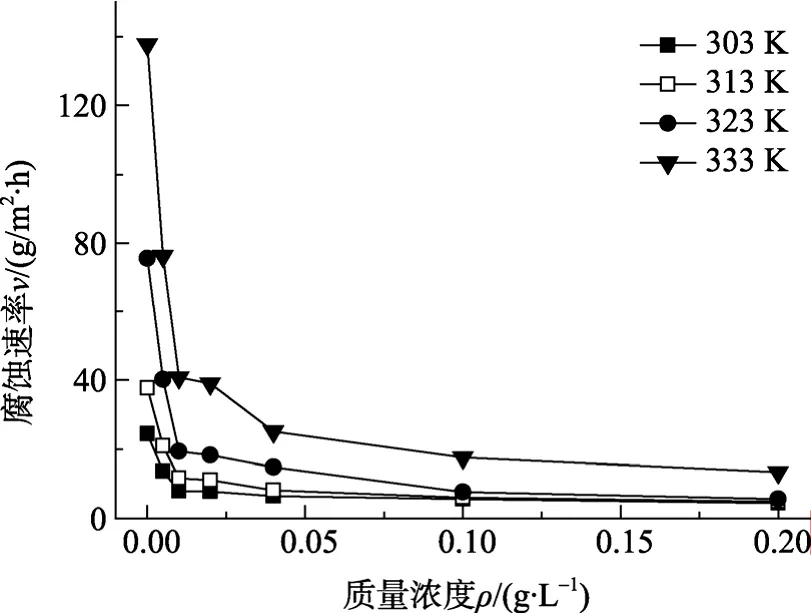
图2 缓蚀剂质量浓度与腐蚀速率的关系Fig.2 Relationship between inhibitor concentration and corrosion rate
2.2 动电位极化曲线
303 K时,在空白及添加不同质量浓度缓蚀剂的腐蚀液中,电极的动电位极化曲线见图3。表1列出了相应的拟合参数:电极的总腐蚀电流密度Jc、自腐蚀电位Ec、阴极和阳极的Tafel斜率βc、βa。缓蚀效率η按下式计算:

式中,J'c、Jc分别为空白腐蚀液及添加不同质量浓度缓蚀剂的腐蚀液中通过电极的腐蚀电流密度。
由图3、表1可知,空白溶液和加有缓蚀剂的溶液的自腐蚀电位变化不大,极化曲线的两个分支的电流密度均趋向于变小的方向,同时变化趋势未发生变化,表明加入缓蚀剂后,碳钢电极在1 mol/L的HCl溶液中的阴极和阳极腐蚀电流密度均急剧减小,通过电极的总的腐蚀电流密度Jc显著减小,同时阴极和阳极的反应机理未改变。

图3 电极在1 mol/L HCl腐蚀液中的极化曲线Fig.3 Polarization curves of electrode in hydrochloric acid etching solution(c=1mol/L)
由表 1可知,缓蚀剂的添加对溶液中电极的阴极和阳极曲线的Tafel斜率产生了影响,但随质量浓度的增大,βc增大,βa也略有增加,说明阴极和阳极同时受到一定程度的抑制; 阴极过程受到的抑制程度大于阳极过程,说明壳聚糖是阴极抑制为主的混合型缓蚀剂。
随阳极极化的增强,阳极极化曲线出现特征不同的3个区域:第1段为微极化区,缓蚀剂刚刚起缓蚀作用的区域; 第2段为弱极化区,为壳聚糖发生良好缓蚀作用的 “平台区”; 第 3段为强极化区,腐蚀电流密度急剧增大,电极表面的缓蚀剂分子发生大量脱附的无缓蚀作用区,在阳极极化足够大时,被缓蚀剂分子所覆盖的金属表面部分也不再“稳定”,发生金属的阳极溶解过程,溶解速率随极化的增强迅速增大,产生这一现象的原因是:当存在过量的热运动及溶解的金属离子的冲击力时,壳聚糖分子在金属表面的吸附-脱附平衡被打破,吸附率小于脱附率时,缓蚀剂分子在碳钢表面的覆盖程度迅速减小,导致碳钢的阳极溶解电流密度进一步增大,并引起更多的壳聚糖分子脱附,构成具有自加速特征的阳极过程,此过程最终导致吸附在碳钢表面的缓蚀剂分子脱附殆尽,缓蚀剂覆盖程度趋近于零,碳钢表面就像无缓蚀膜那样成为“裸”表面,此时,缓蚀剂层已失去对阳极过程的抑制作用。
2.3 缓蚀剂分子缓蚀行为的热力学分析
缓蚀剂分子在金属表面的覆盖度θ(%)可由下式计算得到[17-18]:

式中,W0为空白腐蚀液中试样的失重量,W为添加壳聚糖的腐蚀液中的试样的失重量。
一般认为,Langmuir等温线是研究有机缓蚀剂在金属表面作用行为的最合适型之一。根据Langmuir等温线,在一定条件下缓蚀剂在碳钢表面的覆盖度θ与缓蚀剂浓度c关系可表示为:

式中:K为吸附平衡常数。图4为以C/θ为纵坐标,以C为横坐标作图得到的不同温度下的Langmuir等温线。根据直线截距可求得不同温度下吸附平衡常数K。
图4显示,C/θ与C之间具有良好的线性关系,相关系数达到0.999 27(303 K)。拟合出的直线的斜率为1.06,接近于1。因此,1mol/L HCl溶液中缓蚀剂在碳钢表面的行为均符合Langmuir吸附等温线。据图 4计算出不同温度下的吸附平衡常数K为1.09×102,这说明缓蚀剂在碳钢表面具有一定的附着能力。

图4 壳聚糖在1 mol/L HCl溶液中碳钢表面的Lang- muir吸附等温线(303 K)Fig.4 Langmuir adsorption isotherm of chitosan on surface of carbon steel in hydrochloric acid solution(303K),c(HCl)=1mol/L
为了进一步研究不同温度下缓蚀剂在碳钢表面的作用特征,由平衡常数K求得吸附自由能 ΔGm,见公式(5):
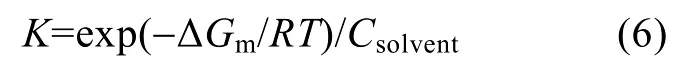
式中:Csolvent为溶剂水的浓度,为55.5 mol/L。将K带入公式(5),求得作用自由能 ΔGm为-1.9×10-5J/mol。缓蚀剂分子在不同温度下的作用自由能ΔGm均小于0说明不同温度下缓蚀剂分子在碳钢表面的吸附是自发过程。根据热力学可知,当︱ΔGm︱< 40 kJ/mol时,吸附过程以物理作用为主; 当︱ΔGm︱> 40 kJ/mol时,则以化学作用为主[19,20]。缓蚀剂不同温度下在碳钢表面的自由能︱ΔGm︱小于 20kJ/mol,因此缓蚀剂分子在碳钢电极表面的作用过程主要为物理作用。
3 结论
通过失重测试和动电位极化测试,对壳聚糖在1 mol/L的 HCl中对碳钢的缓蚀性能及机理进行探究。
(1)失重测试表明:不同温度下,缓蚀剂的添加使得碳钢的腐蚀程度明显减轻,碳钢的失重量和腐蚀速率随缓蚀剂质量浓度的增大而减小,缓蚀剂的缓蚀效率随质量浓度的增大而增大,虽然温度的增加使得腐蚀增加,但缓蚀效率未受其影响。
(2)动电位极化测试表明:缓蚀剂加入后,自腐蚀电流密度Jc显著变小,壳聚糖是抑制阴极为主的混合型缓蚀剂,并未改变阴极和阳极的反应机制。
[1]Azhar M,Mernari B,Traisnel M,et al.Corrosion inhibition of mild steel by the new class of inhibitors [2,5-bis(n -pyrid yl)-1,3,4-thiadiazoles]in acidic media[J].Corros Sci,2001,43(12):2229-2238.
[2]Bouklah M,Hammouti B,Aouniti A,et al.Thiophene derivatives as effective inhi bitors for the corrosion of steel in 0.5 M H2SO4[J].Prog Org Coat,2004,49:225-228.
[3]Quraishi M A,Sardar R,Jama D.Nat urally occurring products as corrosion inhibitors[J].Bull Electrochem,2004,20:171-178.
[4]雷鸿毅.高浓度盐酸对钢铁的腐蚀机理[J].腐蚀与防护技术,1992,2(4):8-11.
[5]Sykes J M.25 Years of Progress in Electroc hemical Methods[J].Br Corr J,1990,25:175-183.
[6]霍宇凝,刘珊,陆柱,等.聚天冬氨酸对碳酸钙阻垢性能的研究[J].工业水处理,2004,24(2):46-48.
[7]潘献辉.盐酸中 BMPT对不锈钢缓蚀性能的探讨[J].腐蚀与防护,1999,20(4):156-159.
[8]李爱魁,李国敏,郭兴蓬,等.缓蚀剂在 N80钢上吸附行为研究[J].电化学,2003,9(3):314-319.
[9]张万友,陈月芳,李洵,等.复配型绿色植物缓蚀剂对盐酸溶液中 A3钢的缓蚀作用[J].华北电力技术,2002,1:9-11.
[10]Fu J S.Analysis of corrosion of bottom reboiler of regeneration tower of gas pesul furization unit[J].Petrochemical Corros Prot,1999,16(1):6-7.
[11]周欣,杨怀玉,蔡铎昌,等.低碳钢在富含 H2S乙醇胺溶液中的腐蚀及缓蚀抑制[J].中国腐蚀与防护学报,2005,25(2):79-83.
[12]肖纪美.腐蚀总论——材料的腐蚀及其控制方法[M].北京:化学工业出版社,1994:71-73.
[13]Fontana M G.Corrosion Engineering[M].Singapore:McGraw-Hill,1986:26-30.
[14]Riggs J O L.Corrosion inhibitors[M].Houston:TX Press,1973:151.
[15]Sinko J.Challenges of chromate inhibitor pigments replacement in organic coatings[J].Prog Org Coat,2001,42:267-282.
[16]Manahan S E.Environmental chemistry[M].Boca Raton:CRC Press 1996:36-41.
[17]魏宝明.金属腐蚀理论及应用[M].北京:化学化工出版社,1995:46-47.
[18]张天胜.缓蚀剂[M].北京:化学工业出版社,2002:32-34.
[19]曹楚南.混合电位下的法拉第导纳[J].中国腐蚀与防护学报[J],1993,13,91-100.
[20]曹楚南.腐蚀电化学[M].北京:化学工业出版社,1994:146-148.

