扁穗冰草转录因子基因的克隆和表达特性的分析
张 楠,朱维宁,苏君艺,张林生
(西北农林科技大学生命科学学院 旱区作物逆境生物学国家重点实验室,陕西 杨凌 712100)
植物在受到干旱、寒冷、盐碱等非生物胁迫时体内会被诱导产生多种转录因子,这些转录因子直接结合或间接作用于基因启动子区域,调控一系列相关基因的表达,进而对植物体产生保护效应[1-2]。自从Paz-Ares等[3]首次克隆了玉米(Zeamays)的转录因子基因C1 以来,已有多种调控干旱、盐渍、低温等相关基因表达的转录因子基因被分离克隆。在拟南芥(Arabidopsisthaliana)中,已经有超过50个家族至少1 700个编码转录因子的基因被克隆出来[4-8],其中一部分基因是与干旱胁迫相关[9-10]。例如:bZIP家族的AREB/ABF基因可以对干旱产生响应[11],NAC基因家族的转录因子ANAC019、ANAC055和ANAC072则被干旱、高盐和ABA诱导表达[12],而AP2/ERF基因家族的DREB1亚家族转录因子通常被低温诱导[13]。大量研究表明,转录因子在植物对干旱、低温、盐碱、高温等胁迫响应时启动自身体内自我保护系统方面有着重要的作用[14-17]。
扁穗冰草(Agropyroncristatum)是分布于干旱、半干旱及高寒地区的多年生牧草。扁穗冰草具有较强的抗旱、抗寒性,可作为干旱地区水土保持和绿化植物,生态价值较高[18-19]。目前,转录因子在整个冰草属中的研究鲜见报道,本研究对已报道的一些禾本科植物的转录因子基因序列进行比对分析,根据核酸序列的保守区域设计引物,采用RT-PCR技术、半定量RT-PCR技术来研究扁穗冰草遇寒冷及干旱胁迫时的相关基因表达趋势,以期为深入研究转录因子在逆境胁迫下的细胞信号应答及作用机理提供理论基础。
1 材料与方法
1.1供试材料 扁穗冰草种子由西北农林科技大学生命科学学院中心实验室提供。
1.2试剂 RNA提取试剂Trizol、逆转录试剂盒,购自大连宝生物(TaKaRa)公司;pGEM-T Easy Vector 购自Promega公司;DNA分子Marker、凝胶回收试剂盒等购自北京天根公司;Taq DNA 聚合酶(2×taqmix)购自沃尔森公司,其他试剂均为分析纯。
1.3RT-PCR克隆目的基因及半定量RT-PCR
1.3.1冷胁迫 扁穗冰草种子在恒温培养箱内25 ℃蛭石培养,称重法控制含水量,至地上部分高约20 cm时,分别置于4 ℃ 12 h、4 ℃ 24 h、4 ℃ 36 h、4 ℃ 60 h,后恢复至25 ℃12 h,采集各胁迫时期的冰草叶片。
1.3.2干旱胁迫 扁穗冰草种子在恒温培养箱内25 ℃蛭石培养,称重法控制含水量,至地上部分高约20 cm时,自然干旱至含水量为20%,然后分别在第1天、第3天、第5天、第7天及复水1 d时,采集各胁迫时期冰草叶片。
1.3.3RNA提取及半定量RT-PCR 参照Trizol 试剂的操作说明提取各胁迫处理时期的扁穗冰草叶片RNA,以提取的RNA为模板,使用逆转录试剂盒(Takara)反转录合成cDNA第一链。RT产物于-20 ℃下保存。利用DNAMAN 对已报道在GenBank中的禾本科植物的cbf,dreb,myb转录因子进行比对,针对其保守区,使用Primer Premier 5.0设计3对引物(引物由上海生工合成)。选用扁穗冰草肌动蛋白基因ACβ-actin(GenBank登录号:JN007031)作为内标基因。通过预试验探索确定半定量试验条件(表1)。PCR扩增产物经琼脂糖凝胶电泳分析和回收纯化后的目的产物与pGEM-T Easy Vector 连接,转化至大肠杆菌感受态细胞JM109中,经蓝白斑筛选及菌落PCR鉴定后,送至上海桑尼公司测序。将目的片段在NCBI网站上进行nBlast并分析。

表1 半定量RT-PCR中基因名称、引物序列、PCR程序及扩增片段长度
2 结果与分析
2.1扁穗冰草转录因子cDNA的克隆与测序 将提取的扁穗冰草总RNA反转录后,用设计的引物进行RT-PCR扩增,3个扩增片段大小与预期大小一致(图1)。因此,初步认定是扁穗冰草中的目的基因片段,将其分别命名为ACcbf,ACdreb,ACmyb,扩增产物经过回收,连接转化并克隆测序。序列分别为548,862,319 bp, 测序结果如图2所示。将这3个序列上传GenBank,登录号分别为:JF957078,JF957079,JF957080。3个基因片段在NCBI 网站上的nBlast结果表明,各基因片段的序列与相应同源基因序列的相似度基本都能达到90%以上(表2),因此,认为得到的序列是目的基因。
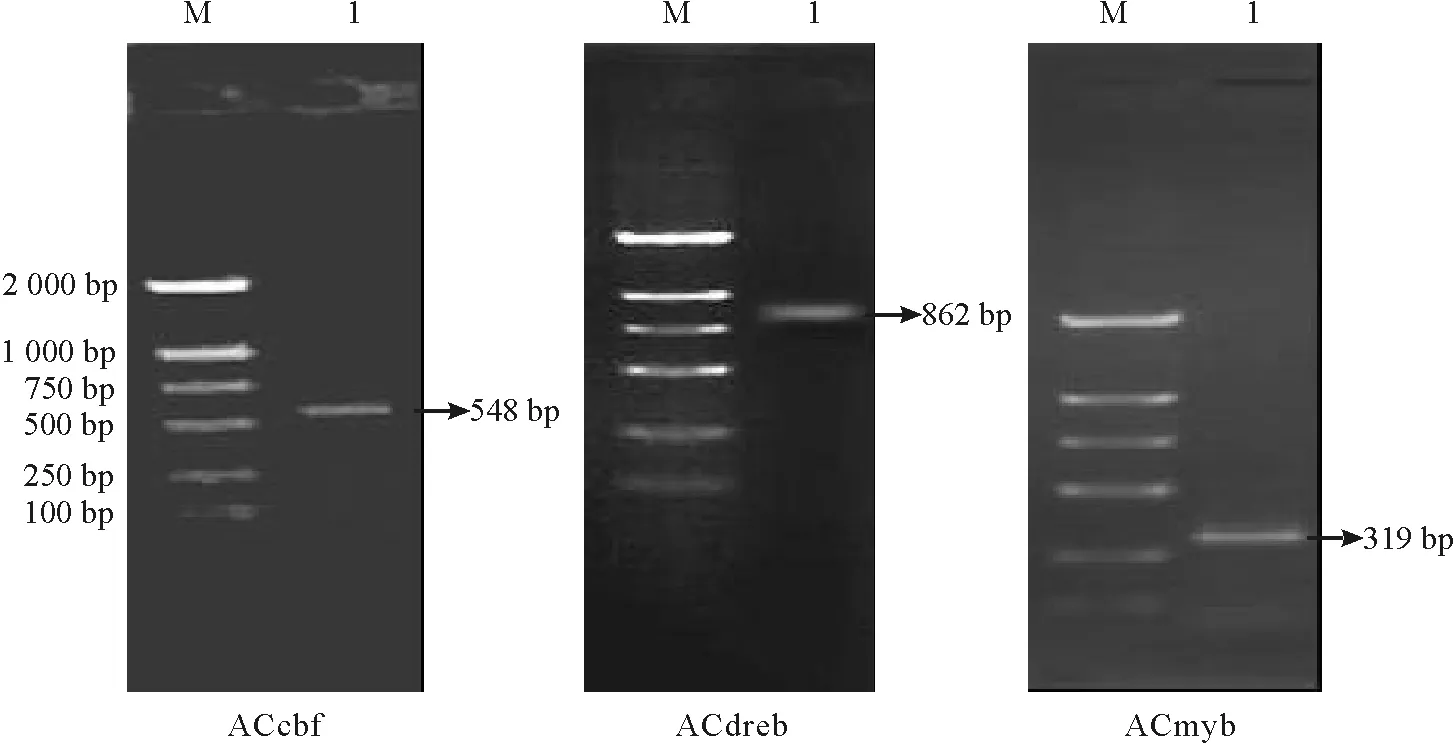
图1 目的基因片段扩增琼脂糖凝胶电泳图
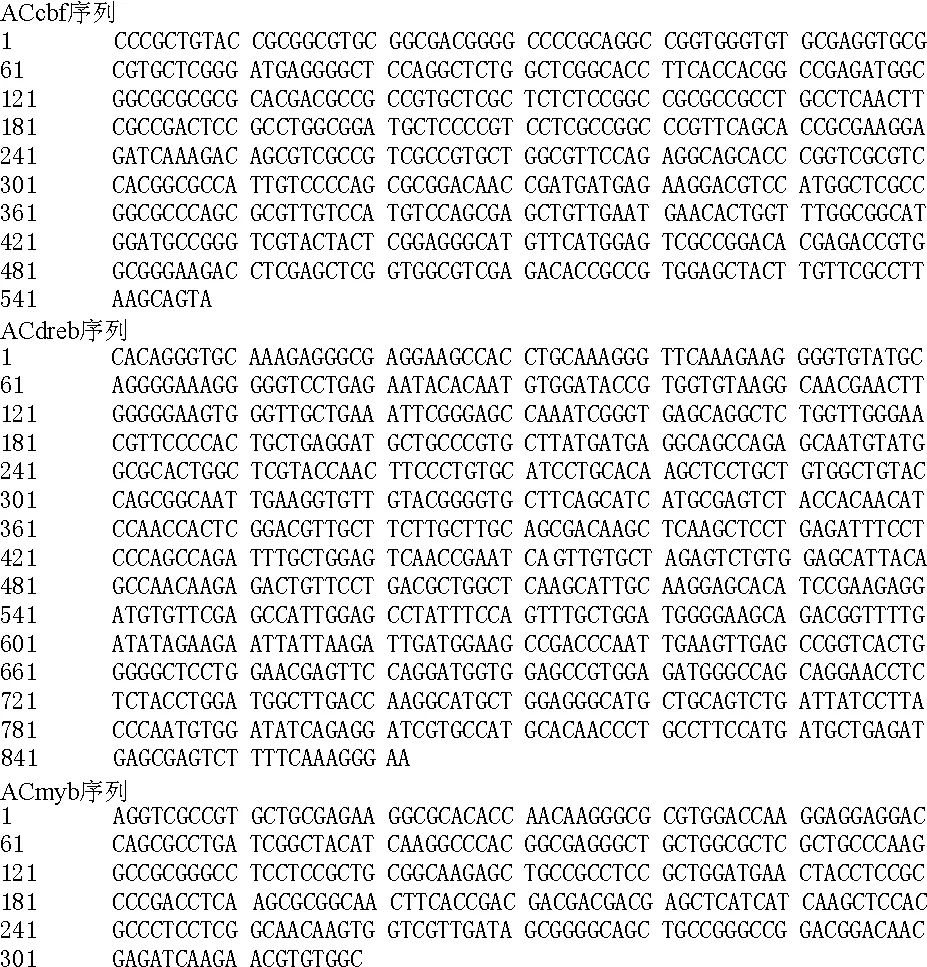
图2 扁穗冰草中ACcbf,ACdreb,ACmyb基因序列
2.2不同冷胁迫程度下扁穗冰草转录因子表达的半定量RT-PCR分析 不同冷胁迫程度下各基因的半定量RT-PCR结果表明(图3),ACcbf基因随冷胁迫程度的增强表达量增加,恢复到室温后,表达量开始降低。ACdreb与ACcbf基因的表达趋势基本一致,这说明两者对低温胁迫能够产生响应。而ACmyb基因在胁迫前后表达量变化不大,说明该基因对温度变化不敏感。
2.3不同干旱胁迫程度下扁穗冰草转录因子表达的半定量RT-PCR分析 不同干旱胁迫程度下各基因的半定量RT-PCR结果表明(图4),ACcbf 基因在胁迫前未表达,胁迫后表达量增加,而在复水1 d后,表达量降低,说明该基因对干旱胁迫能产生响应。但由于整体表达量较低,认为该基因对于干旱只有一定程度的响应,不敏感。ACdreb基因在胁迫后表达量增加,复水1 d后,表达量降低,说明该基因是受到干旱胁迫调控的。而ACmyb基因出现了和前两个基因一样的趋势,复水后仍然比对照组中表达量高,推测该基因是一种干旱应答转录因子基因,并且其表达有一定的延续性。
综合低温和干旱两种胁迫下的结果,认为ACcbf基因是一种低温敏感基因,同时对干旱胁迫产生一定的响应,但不明显。ACdreb基因是一种对低温和干旱胁迫都能够产生应答的基因,推测这是该基因对干旱和寒冷都能导致的植物脱水所产生的响应。ACmyb基因对干旱胁迫能产生响应,对低温胁迫不敏感。
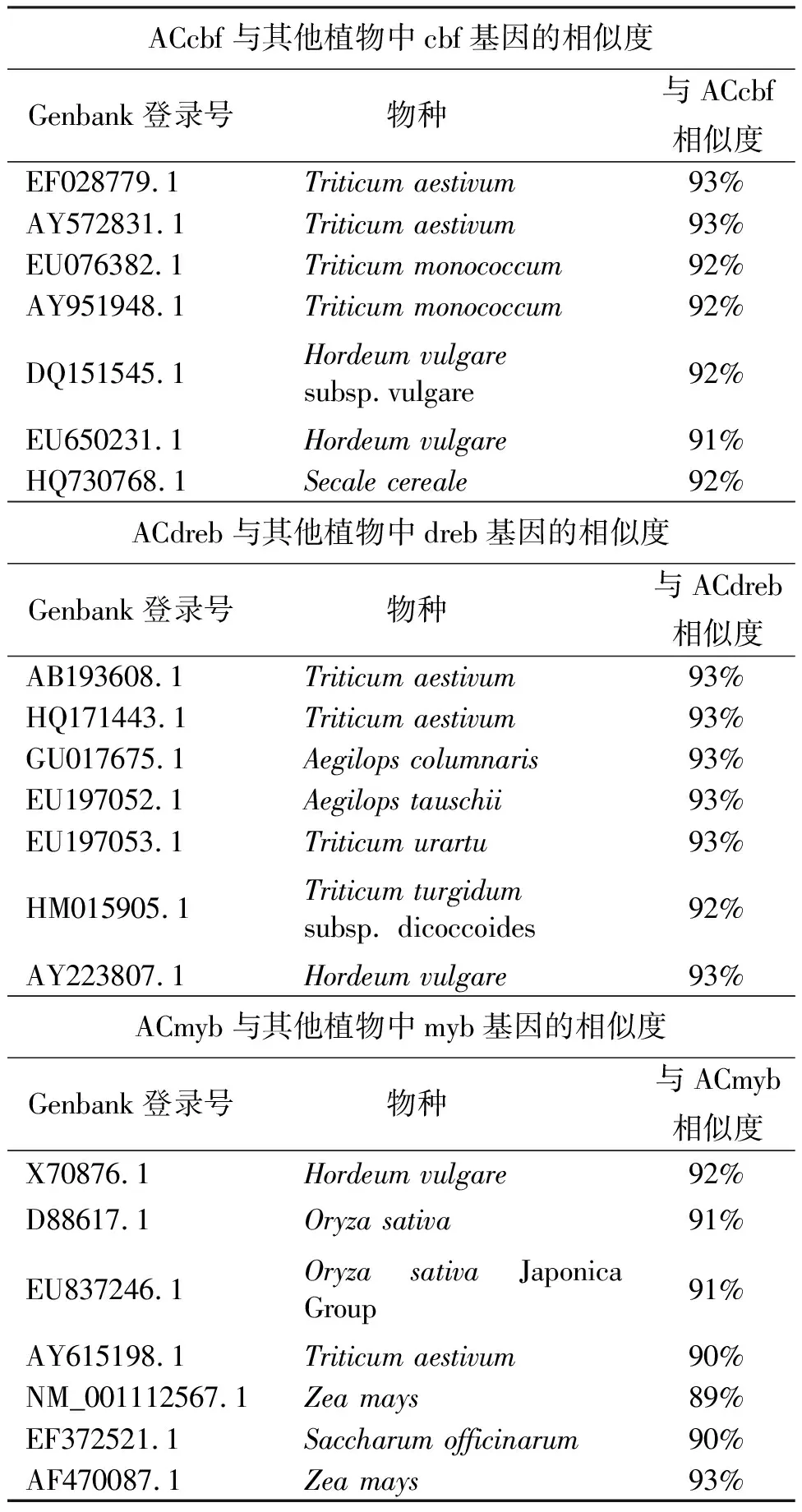
表2 ACcbf,ACdreb,ACmyb与其他植物中同源基因的相似度
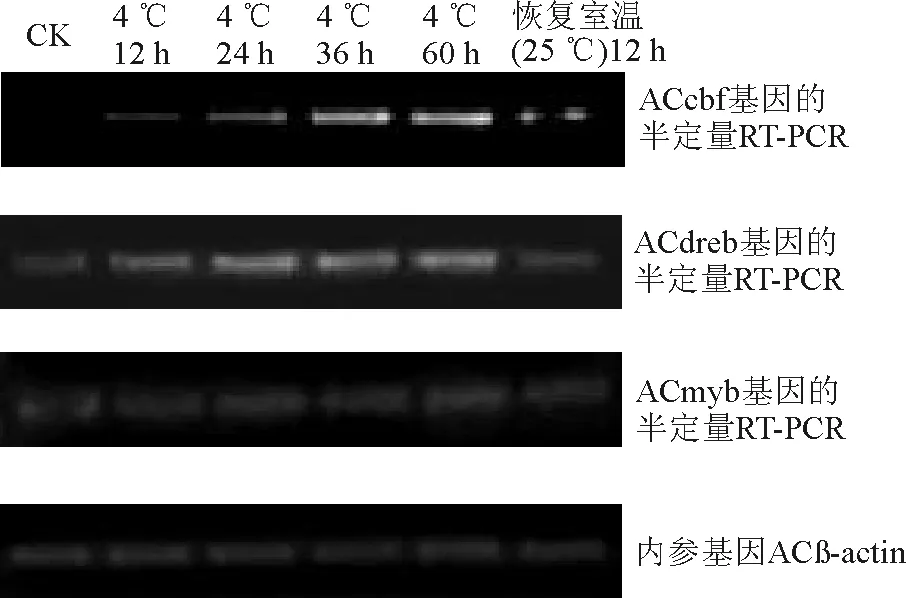
图3 不同冷胁迫程度下扁穗冰草转录因子半定量RT-PCR
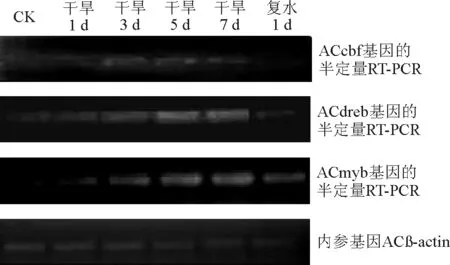
图4 不同干旱胁迫程度下扁穗冰草转录因子半定量RT-PCR
3 讨论
本研究首次在扁穗冰草中克隆出3个不同的转录因子基因片段并对这3个基因在冷胁迫和干旱胁迫下的表达进行研究,试验结果发现各基因的表达与逆境胁迫程度成正相关,这与已报道的研究结论基本一致[20-23]。由于各种逆境之间的交叉效应对于研究的影响和植物抗逆信号转导的复杂性,不能简单地判断某一基因对于特定逆境胁迫能产生特异的响应。例如,干旱、寒冷、盐碱都能导致植物脱水,因此,在冷胁迫及干旱胁迫下出现同样的表达趋势是正常的。这为试验结果的分析带来了难度。为了进一步研究该基因的表达调控模式,下一步还须通过RACE技术克隆这3个基因的全长序列,寻找其CDS并进行转基因等功能研究,以明确其表达调控模式。
目前对转录因子调控表达的研究主要侧重于对单一逆境条件的调控, 对其在不同信号途径相互作用过程中的调控机制还没有深入的研究。在转基因试验中也出现了很多大田研究和实验室研究不吻合的结果[24]。因此,欲将转录因子应用于作物的转基因或者遗传育种,对于这类基因表达过程的信号转导以及转录、翻译的调控还需要进一步的研究。本研究对扁穗冰草中的转录因子进行了初步探索,为设计相应的核酸探针、深入分析这类基因的转录及表达机制进而应用于作物遗传育种提供参考。
[1]Nakashima K,Ito Y,Yamaguchi-Shinozaki K.Transcriptional regulatory networks in response to abiotic stresses inArabidopsisand grasses[J]. Plant Physiology,2009,149:88-95.
[2]Shou H X,Bordallo P,Fan J B,etal. Expression of an active tobacco mitogen-activated protein kinase kinase kinase enhances freezing tolerance in transgenic maize[J]. Proceedings of the National Academy of Sciences of the USA,2004,101(9):3298-3303.
[3]Paz-Ares J,Ghosal D,Wienand U,etal.The regulatory C1 locus ofZeamaysencodes a protein with homology to myb oncogene products and with structural similarities to transcriptional activators[J].European Molecular Biology Organization Journal,1987,6:3553-3558.
[4]Yang S J,Vanderbeld B,Wan J X,etal. Narrowing down the targets:Towards successful genetic engineering of drought-tolerant crops[J].Molecular Plant,2010,3(3):469-490.
[5]Palaniswamy S K,James S,Sun H,etal.AGRIS and AtRegNet.A platform to link cis-regulatory elements and transcription factors into regulatory networks[J].Plant Physiology,2006,140:818-829.
[7]Guo A Y,Chen X,Gao G,etal.PlantTFDB:A comprehensive plant transcription factor database[J].Nucleic Acids Research,2008,36:D966-D969.
[8]Xiong Y,Liu T,Tian C,etal.Transcription factors in rice:A genome-wide comparative analysis between monocots and eudicots[J].Plant Molecular Biology,2005,59:191-203.
[9]Bartels D,Sunkar R.Drought and salt tolerance in plants[J].Critical Reviews in Plant Sciences,2005,24:23-58.
[10]Umezawa T,Fujita M,Fujita Y,etal.Engineering drought tolerance in plants:Discovering and tailoring genes to unlock the future[J].Current Opinion Biotechnology,2006,17(2):113-22.
[11]Oh S J,Song S I,Kim Y S,etal.ArabidopsisCBF3/DREB1A and ABF3 in transgenic rice increased tolerance to abiotic stress without stunting growth[J].Plant Physiology,2005,138:341-351.
[12]Tran L S,Nakashima K,Sakuma Y,etal.Isolation and functional analysis ofArabidopsisstress-inducible NAC transcription factors that bind to a drought-responsive cis-element in the early responsive to dehydration stress 1 promoter[J].Plant Cell,2004,16:2481-2498.
[13]Liu Q,Kasuga M,Sakuma Y,etal.Two transcription factors,DREB1 and DREB2,with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought and low-temperature-responsive gene expression,respectively,inArabidopsis[J].Plant Cell,1998,10:1391-1406.
[14]Qin F,Sakuma Y,Li J,etal.Cloning and functional analysis of a novel DREB1/CBF transcription factor involved in cold-responsive gene expression inZeamaysL.[J].Plant & Cell Physiology,2004,45(8):1042-1052.
[15]才华,朱延明,柏锡,等.野生大豆DREB基因cDNA的克隆与分析[J].草业科学,2009,26(8):17-23.
[16]Sakamoto H,Maruyama K,Sakuma Y,etal.ArabidopsisCys2/His2-type zinc-finger proteins function as transcription repressors under drought,cold,and high-salinity stress conditions[J].Plant Physiology,2004,136(1):2734-2746.
[17]刘艳香,董宽虎.转录因子CBF及其抗寒作用机制[J].草业科学,2009,26(5):86-94.
[18]宿俊吉,柴守诚,刘伟华,等.普通小麦SSR和EST-SSR引物对冰草通用性的比较分析[J].西北植物学报,2007,27(7):1311-1316.
[19]徐春波,米福贵,王勇.影响冰草成熟胚组织培养再生体系频率的因素[J].草业学报,2009,18(1):80-85.
[20]Gilmour S J,Fowler S G,Thomashow M F.Arabidopsistranscriptional activators CBF1,CBF2,and CBF3 have matching functional activities[J].Plant Molecular Biology,2004,54(5):767-781.
[21]Chen M,Wang Q Y,Cheng X G,etal.GmDREB2,a soybean DRE-binding transcription factor,conferred drought and high-salt tolerance in transgenic plants[J].Biochemical and Biophysical Research Communications,2007,353(2):299-305.
[22]Agarwal P,Agarwal P K,Nair S,etal.Stress-inducible DREB2A transcription factor fromPennisetumglaucumis a phosphoprotein and its phosphorylation negatively regulates its DNA-binding activity[J].Molecular Genetics and Genomics,2007,277(2):189-198.
[23]Chen B J,Wang Y,Hu Y L,etal.Cloning and characterization of a drought-inducible MYB gene fromBoeacrassifolia[J].Plant Science,2005,168(2):493-500.
[24]Yang S,Vanderbeld B,Wan J,etal.Narrowing down the targets:Towards successful genetic engineering of drought-tolerant crops[J].Molecular Plant,2010,3(3):469-490.

