三江白猪GH基因多态性分析及对仔猪初生重的影响
金甲正,符亚原,黄大鹏,张虎
(黑龙江八一农垦大学动物科技学院,大庆163319)
猪生长激素(porcine Growth hormone,pGH)是由猪脑垂体前叶嗜酸性细胞合成分泌的单链多肽类激素。Thomsen用原位杂交法和辐射杂种板将pGH基因座定位在12号染色体短臂1区1带[1]。Yerle等人用高分辨率G带染色体原位杂交将pGH基因定位于12 p1.2-p1.5区域上[2]。pGH基因的全基因序列首先由Vizer等人确定[3],该基因全长2 231 bp,由5个外显子和4个内含子组成。近年来,国内外的科研工作者已经对pGH基因的结构做了大量的工作,但pGH基因研究的主要工作仍集中在多态位点的寻找,且研究的区域主要集中在5'端至外显子3起始处[4-6],而且在三江白猪种群中的多态性研究尚未见报道。本试验采用PCR-RFLP技术检测三江白猪群体中pGH基因第2外显子的多态性,为今后研究瘦肉型猪种的基因型特征与生长性能的关系提供理论依据。
1 材料与方法
1.1 试验材料
样品来源于黑龙江省大庆市三江白猪原种猪场,健康仔猪共121头。取尾组织洗净置于灭菌的EP管中,-70℃保存备用。
1.2 试验方法
1.2.1 基因组DNA提取
取1 g左右的组织剪碎放入1.5mL的EP管中,加入2.5mL裂解液和5μL蛋白酶K,置于50℃水浴消化过夜。12 000 rpm,离心10min,取上清液,用等体积的混合酚和氯仿各抽提一次,用等体积的异丙醇沉淀DNA,再用70%的乙醇洗脱2次,最后用核酸真空干燥器烘干,加入150μL TE(pH=8.0)溶解过夜,-20℃保存。
1.2.2 引物及PCR
参照 GenBank中公布的 pGH基因序列(EU 684 437),用Primer 5.0软件设计PCR引物,由上海生工生物工程技术服务有限公司合成。上游引物:5'-GGAAGGAGAAGGGACAGGG-3';下游引物:5'-TGGCAAATAGGCTGGACAA-3'。
PCR反应体系:10×Buffer 3.00μL;dNTP 2.00μL;上游引物 0.50μL;下游引物0.50μL;模板DNA 1.00μL;DNA Taq酶0.25μL;加水至25.00μL。PCR反应条件:94℃预变性5min;94℃变性30 s,56℃,退火30 s,72℃延伸30 s,共35个循环;72℃延伸10 min。取2μL PCR产物进行琼脂糖凝胶电泳,并在60-250 CE型凝胶成像系统上观察扩增效果和照相。
1.2.3 酶切体系及反应条件
酶切反应体系:PCR产物1μL,buffer 2μL,BSA 0.2μL,DdeⅠ酶0.5μL,加水至20μL。酶切反应条件:在SHP-250型恒温生化培养箱中37℃反应4 h。取5μL酶切产物采用2%的琼脂糖凝胶,在200 V条件下进行电泳检测,并在60-250 CE型凝胶成像系统上观察酶切效果、多态性和照相。
1.3 数据统计方法
1.3.1 群体等位基因和基因型频率
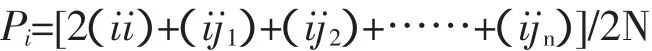
Pi为第i个等位基因的频率;i纯合复等位基因;j1、j2、……jn为与i共显的第1个到第n个等位基因。
Pij=(ij)/N
Pij为基因型频率;ij为基因型个体;N为群体总数。
1.3.2 群体基因平衡状态的检验
基因平衡的检测:根据基因平衡定律,即哈代-温伯格定律检测基因平衡。在一个无穷大的或者足够大的,且完全随机交配的群体内,如果没有其他因素干扰时,则基因频率和基因型频率保持稳定不变。遗传平衡检验的卡方检验公式为:

Oi为实际观察值;Ei为理论值;n为等位基因数。
1.3.3 三江白猪GH基因多态位点对生产性能的影响分析
利用SAS软件包(Version 9.0)统计软件中的GLM程序进行单因素方差分析,分析突变位点基因型对初生重的影响。统计分析模型为:

式中,Yijk表示各性状表型值,μ表示总体平均值,Gj为第j种基因型效应,bij为初生重的回归系数,X为初生重,Eijk为随机误差效应。
2 结果与分析
2.1 pGH基因外显子2的PCR扩增结果
扩增产物用1%的琼脂糖凝胶电泳,在凝胶成像系统上可观察到电泳图谱(如图1)。结果显示,与DL-2 000 DNA Marker比对,目的片段(183 bp)与扩增片段大小一致且特异性良好。

图1 pGH-PCR扩增产物电泳图谱Fig.1 Electrophoretic pattern of PCR products of pGH gene
2.2 pGH基因外显子2的PCR-RFLP结果
酶切产物用2%的琼脂糖凝胶电泳进行多态性分析,结果显示,DdeⅠ酶切后产生3种基因型(如图2)。M泳道是DNA Marker-DL2 000;泳道1、2为AA型,片段大小为140 bp,43 bp;泳道3、4为BB型,片段大小为183 bp,43 bp;泳道5为AB型,片段大小为183 bp,140 bp,43 bp。
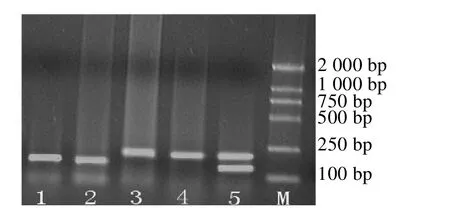
图2 三江白猪GH基DdeⅠ酶切电泳图谱Fig.2 The pattern of PCR-Dde I-RFLP of the second extron of pGH gene
2.3 数据统计分析
2.3.1 pGH基因外显子2 DdeⅠ多态位点的基因频率和基因型频率
根据上述的基因频率和基因型频率计算公式,计算结果见表1。

表1 pGH外显子2 DdeⅠ多态位点的基因型频率和等位基因频率Table 1 Genotypes distribution and alleles frequency of PCR-DdeⅠ-RFLP
经卡方检验表明,三江白猪GH基因外显子2 DdeⅠ酶切多态位点的x2值为1.61,显示此多态位点在三江白猪群体内分布差异不显著(P>0.05),处于哈代-温伯格平衡状态。
2.3.2 三江白猪GH基因DdeⅠ多态位点对初生重的影响
采用一般线性模型分析三江白猪GH基因外显子2的DdeⅠ酶切多态位点对初生重的影响(见表2)。

表2 pGH外显子2 DdeⅠ酶切多态位点对仔猪初生重的影响Table 2 The effectof PCR-DdeⅠ-RFLP polymorphism to the birth weight
由表2可知,AB基因型的仔猪初生重显著高于AA、BB基因型的仔猪(P<0.05),而AA基因型和BB基因型的仔猪之间差异不显著(P>0.05)。
3 讨论
生长激素的生物学功能主要是促进肌肉的生长、核酸和蛋白质的合成、脂肪的分解、提高机体免疫力等。有相关研究表明,生长激素可以直接刺激葡萄糖进入肌肉细胞中,加速蛋白质的合成,增加肌肉重量以及蛋白质的沉积,使能量由脂肪组织向肌肉组织中转移。Skarp Hedinesson等研究认为,生长激素能够使蛋白质合成速度加快而不影响蛋白质降解[7]。Matteri等证实,生长激素能够提高氨基酸合成蛋白质的速度,并且能降低氨基酸的氧化分解的速度[8]。在生长激素作用下,蛋白质周转代谢总量减少,合成量大于降解量,从而提高了蛋白质的沉积量。
试验结果显示,酶切后检测到一处酶切突变位点,产生等位基因A(183 bp,43 bp)和B(143 bp,43 bp),其中等位基因A的基因频率为0.55,等位基因B的基因频率为0.45,在三江白猪群体中,A表现为优势基因;产生三种基因型,基因型频率的大小依次为AB型(0.44),AA型(0.33),BB型(0.23),其中优势基因型为AB。对于三江白猪GH基因外显子2 DdeⅠ酶切多态位点,AB型的仔猪初生重要略高于AA型和BB型的仔猪(P<0.05),而AA型和BB型的仔猪之间没有显著性的差异(P>0.05)。WANG Wen-Jun等[9]分析了南昌白猪和大约克夏猪pGH基因的不同基因型对仔猪初生重的影响,结果表明对仔猪初生重有一定的影响,但未达到显著水平(P>0.05)。刘海锋等[10]用PCR-RFLP技术分析了约克夏和长白猪pGH基因不同基因型与生长性状的关系,得到各种基因型均对70日龄重、120日龄重、70~120日龄日增重、70~120日龄料肉比等9个生产性状无显著影响;这些与本研究的结果不尽一致,这可能与研究的猪群品种不同有关,也可能与研究的多态位点不同有关。颜瑛等[11]对5个藏猪群体的ApaⅠ多态位点的检测结果表明:除理塘藏猪,A等位基因在藏猪中表现为优势基因,其频率大于0.6。黄大鹏等[12]对三江白猪H-FABP基因HaeⅢ酶切位点的多态性检测表明:DD基因型同dd基因型和Dd基因型有显著的差异。这些与本试验的研究结果基本一致。
4 小结
通过PCR-RFLP方法研究分析了三江白猪GH基因外显子2 DdeⅠ酶切位点不同基因型对仔猪初生重的影响,AB型仔猪初生重略高于AA型和BB型的仔猪,这体现出了基因的杂合效应。但仍需加大样本量进一步分析验证试验结果。
[1]Thomsen P D,Fredholm M,Christensen K,et al.Assignment of the prince growth hormone gene on chromosome 12[J].Cytogenetics and Cell Genetics,1990,54:92-94.
[2]Yerle M,Lahbib-Mansais Y,Thomsen P D,et al.Localization of the porcine growth hormone gene to chromosome 12 pl.2-1.5[J].Animal Genetics,1993,24(2):129-131.
[3]Vize PD,Wells JR E.Isolation and characterization of porcine growth hormone gene[J].Genetics,1987,55:339-344.
[4]宋成义,经荣斌,陶勇,等.猪GH基因部分突变位点对生产性能的影响[J].遗传,2001,23(5):427-430.
[5]Cheng WTK,Lee C H,Hung C M,et al.Growth hormone gene polymorphisms and growth performance traits in Duroc,Landrace and Tao Yuan Pig[J].Theriogenology,2000,54(8):1225-1237.
[6]马海明,柳小春,施启顺,等.猪肌细胞生成素基因3'端侧翼序列PCR-RFLP分析[J].农业生物技术学报,2005,13(4):493-496.
[7]王磊.牦牛生长激素基因克隆、原核表达及特性分析[D].兰州:甘肃农业大学,2009.
[8]Matteri RL,Becker BA,Carroll JA,et al.Suppression of somatotrop H function induced by growth hormone treatment in neonatal pigs [J].Domestic Animal Endocrinology,1997,14(2):109-112.
[9]WANG Wen-Jun,CHEN Ke-Fei,REN Jun,et al.Relationship of growth hormone(GH2)genotypes with some production performances in pig[J].Acta Genetica Sinica,2002,29(2):111-114.
[10]刘海峰,帅素容,邢晋祎,等.pGH基因全序列ApaⅠ酶切位点多态性与生产性能的相关分析[J].西华师范大学学报:自然科学版,2003,24(3):80-84.
[11]颜瑛,任军,丁能水,等.GH基因在5个藏猪群体中的遗传多态性分析[J].江西畜牧兽医杂志,2007(6):14-16.
[12]黄大鹏,李祥辉,陈建华.三江白猪H-FABP基因多态性及其对生长性能的研究[J].黑龙江八一农垦大学学报,2008(2):43-46.

