复方五味子醇提液对糖尿病肾病的治疗作用及机制
刘 苗 张勉之 谭小月 袁沙沙
糖尿病肾病(diabetic nephropathy,DN)是糖尿病的严重微血管病变并发症之一,是导致终末期肾病(end-stage renal disease,ESRD)的主要病因[1]。DN主要病理特征为肾小球肥大,肾小球和肾小管基底膜(glomerular basement membrane,GBM)增厚,细胞外基质进行性积聚,肾小球、小管间质的纤维化。对其治疗目前主要应用血管紧张素转换酶抑制剂、血管紧张素受体拮抗剂及降血糖药以延缓其进展,尚缺乏针对性抑制或逆转纤维化的特异性治疗措施[2]。五味子可以抗炎、抗氧化、清除氧自由基、增加周围组织对葡萄糖的摄取,川芎、牡蛎均有抗氧化、清除氧自由基的作用,且三者有效成分大部分为脂溶性。本研究以五味子为主药,辅以川芎、牡蛎合成复方五味子醇提液(SRC),通过构建以链脲佐菌素(streptozotocin,STZ)诱导的C57BL/6小鼠DN模型,旨在探讨SRC对DN的治疗作用及其机制。
1 材料与方法
1.1 实验动物及分组 雄性清洁级C57BL/6小鼠24只,6~7周龄,体质量20~25 g,购自南开大学生命科学院实验动物中心[3]。随机分为正常对照组(对照组,6只)、DN模型组(模型组,9只)和SRC治疗组(治疗组,9只)共3组。
1.2 试剂与药物制备 STZ为美国Sigma公司出品,用0.1 mol/L pH值为4.5的灭菌枸橼酸-枸橼酸钠溶液配置成质量浓度为12.5 g/L的溶液;SRC由五味子、川芎、牡蛎组成,与90%乙醇加热回流3 h,提取2次,合并提取液,静置过滤,减压回收乙醇浓缩成浸膏,-20℃保存[4];所用抗体均由美国Santa Cruz公司生产。
1.3 动物模型构建 小鼠自由供给水和食物,适应性喂养1周后,禁食15 h。模型组与治疗组予STZ溶液125 mg/kg腹腔注射,对照组予等体积枸橼酸-枸橼酸钠缓冲液;24 h后等量重复注射;1周后测晨起血糖,若≥16.7 mmol/L,且2周后尿白蛋白排泄率(UAER)增加,则纳入实验。治疗组每只用SRC 0.3 mL/d[相当五味子生药量5 g/(kg·d)]灌胃,模型组、对照组予等体积自来水灌胃。每天16:00给药1次,连续给药7周。因血糖未达标或死亡原因剔除部分小鼠,至实验终点时,模型组剩余小鼠5只,治疗组剩余6只。
1.4 标本收集与处理 试验结束前采用电子天平称体质量,经剪尾取血后采用氧化酶法用血糖仪测定血糖(BS);代谢笼收集18 h尿,高效液相色谱法[5]测定尿白蛋白浓度并计算UAER=尿量(mL)×尿白蛋白浓度(mg/L)/18;采用戊巴比妥钠腹腔注射麻醉小鼠,摘取左肾,切取部分于中性福尔马林中固定24 h后脱水、包埋、切片(3 μm),余部分左肾立即置于液氮中,后置于-80℃冰箱保存供Western blotting检测用;摘取右肾于电子天平称其质量。
1.5 肾组织形态学观察 3 μm石蜡切片常规脱蜡至水,行Masson、天狼星红(Sirius Red)染色,光镜下观察肾组织形态学改变。
1.6 α-平滑肌肌动蛋白(α-SMA)、纤黏蛋白(FN)表达 采用免疫组化法检测。用3 μm石蜡切片常规脱蜡至水,用新鲜配制的3%过氧化氢室温孵育10 min以消除内源性过氧化物酶;微波抗原修复20 min,牛血清白蛋白室温封闭1 h,依次加一抗(小鼠α-SMA、FN多克隆抗体,湿盒内4℃过夜),生物素标记二抗工作液及辣根酶标记的链霉素卵白素工作液,室温下AEC显色,苏木素轻度复染,自来水冲洗,脱水、透明、封片。光镜下观察α-SMA、FN的表达。
1.7 E-钙黏蛋白(E-cadherin)、α-SMA、纤溶酶原活化抑制因子-1(PAI-1)蛋白的表达 采用Western blotting检测。取-80℃保存的各组肾组织,匀浆、离心后,蛋白定量、配样,100℃、8 min变形后上样,经10%SDS-PAGE电泳分离,将目的蛋白转移至硝酸纤维素膜上,脱脂奶粉封闭,TBST冲洗后加小鼠E-cadherin、α-SMA、羊PAI-1及β-actin的一抗,4℃孵育过夜,TBST液冲洗,加标记辣根过氧化物酶的二抗孵育,洗膜后ECL显色。以β-actin为内参,检测E-cadherin、α-SMA、PAI-1蛋白的表达。1.8 统计学方法 用SPSS 17.0统计软件处理,数据用均数±标准差(±s)表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 模型组与治疗组较对照组BS明显升高,差异有统计学意义(P<0.01),治疗组与模型组BS差异无统计学意义;模型组与治疗组体质量均低于对照组,差异有统计学意义(P<0.01),治疗组与模型组体质量差异无统计学意义;模型组右肾质量和UAER明显高于对照组和治疗组,治疗组UAER高于对照组(P<0.05或P<0.01),见表1。
表1 各组BS、体质量、右肾质量和UAER比较(±s)

表1 各组BS、体质量、右肾质量和UAER比较(±s)
**P<0.01
组别对照组(1)模型组(2)治疗组(3)F P(1)∶(2)(1)∶(3)(2)∶(3)n656 BS(mmol/L)6.07±0.40 26.55±3.65 26.08±6.68 20.548**<0.001 0.001 0.889体质量(g)26.97±0.84 17.56±1.27 19.35±2.70 23.446**0.001 0.002 0.266右肾质量(g)0.132±0.008 0.165±0.018 0.145±0.012 11.642**0.002 0.125 0.024 UAER(μg/h)11.724±0.534 69.459±3.695 29.423±1.884 450.307**<0.001<0.001<0.001
2.2 肾组织形态学变化 Masson染色可见模型组部分肾小管管腔扩张、部分肾小管萎缩(图1A箭头所示),间质区纤维性物质沉积(蓝色),治疗组纤维沉积明显减少;Sirius Red染色可见模型组间质区大量胶原沉积,治疗组较模型组胶原沉积明显减少,见图1B。
2.3 Western blotting结果 模型组PAI-1表达高于对照组和治疗组,差异有统计学意义(P<0.05),对照组与治疗组差异无统计学意义;模型组E-cad⁃herin表达低于对照组和治疗组,治疗组低于对照组,差异均有统计学意义(P<0.05或P<0.01);模型组α-SMA表达高于对照组和治疗组,治疗组高于对照组,差异有统计学意义(P<0.05或P<0.01),见图2、表2。
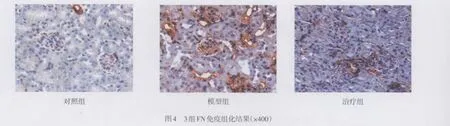
2.4 免疫组化结果 对照组和治疗组均仅见正常血管表达α-SMA,模型组可见肾小球系膜区及小管间质区α-SMA表达明显增加,见图3;对照组可见肾小管基底膜及肾小球FN呈线性表达,肾间质无阳性表达,模型组肾小球、肾小管周围间质和肾小球系膜区FN表达增加,治疗组较模型组FN表达明显减少,见图4。

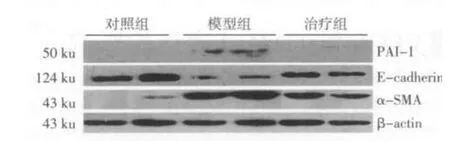
图2 3组PAI-1、E-caherin、α-SMA蛋白表达变化
表2 各组PAI-1、E-cadherin、α-SMA与β-actin蛋白印迹条带光密度比值比较 (±s)
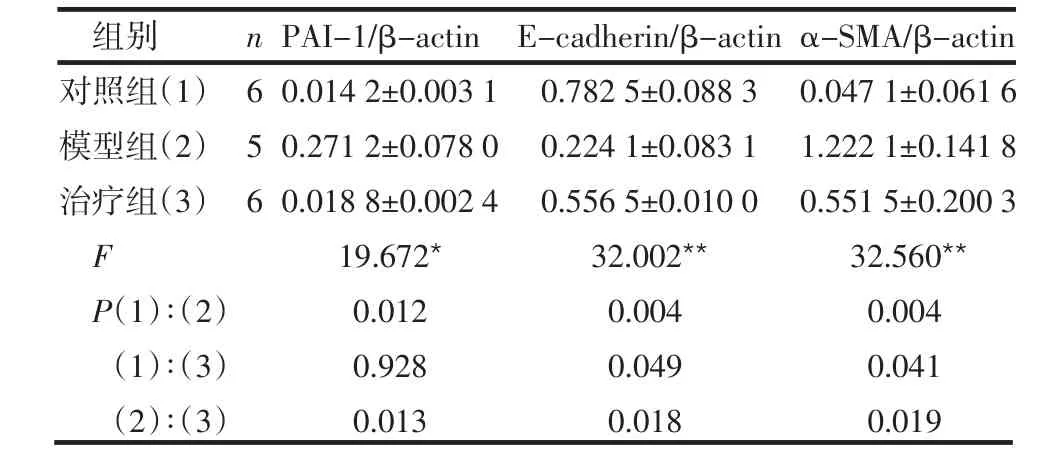
表2 各组PAI-1、E-cadherin、α-SMA与β-actin蛋白印迹条带光密度比值比较 (±s)
*P<0.05,**P<0.01
组别对照组(1)模型组(2)治疗组(3)F P(1)∶(2)(1)∶(3)(2)∶(3)656 0.014 2±0.003 1 0.271 2±0.078 0 0.018 8±0.002 4 19.672*0.012 0.928 0.013 0.782 5±0.088 3 0.224 1±0.083 1 0.556 5±0.010 0 32.002**0.004 0.049 0.018 0.047 1±0.061 6 1.222 1±0.141 8 0.551 5±0.200 3 32.560**0.004 0.041 0.019 n PAI-1/β-actin E-cadherin/β-actin α-SMA/β-actin

3 讨论
DN是导致ESRD的一大主因,虽然利用现代治疗手段可以较好的控制血糖和血压,但临床上仍有很多患者相继出现进展性的肾脏损害[6]。因此,探索可以阻止DN进展的新的治疗措施极为重要。
蛋白尿不仅是糖尿病肾脏病变的反映,而且在其病变的进展过程中也起着重要的作用。Kralik等[7]研究表明,尿蛋白与糖尿病肾小球损伤互为因果,且大量尿蛋白也可导致肾小管损伤。尿蛋白对肾固有细胞的直接刺激可产生多种细胞因子如血管紧张素受体Ⅱ、内皮素-1及肿瘤坏死因子-α等,导致细胞外基质(ECM)堆积。SRC可以显著降低UAER,从而抑制因其引起的肾脏损害。
ECM是DN的另一标志性特征,ECM的过量堆积引起肾小球、肾小管间质的纤维化。肌成纤维细胞(myofibroblast,MF)是ECM的主要来源,α-SMA是MF的标志蛋白,而FN是ECM的主要蛋白之一。肾间质纤维化主要病理表现为肾间质ECM累积、肾小管萎缩、肾间质MF增多等。目前认为,肾间质MF主要来源为骨髓干细胞、肾小管上皮细胞-间充质转化(EMT)和肾间质局部成纤维细胞活化。研究发现,在慢性肾间质纤维化疾病中通过EMT转化而来的MF约占肾间质新增MF的36%左右[8]。所以,EMT可能是导致肾间质纤维化的重要机制。
本研究结果显示模型组上皮细胞标志蛋白E-cadherin低于对照组,经7周治疗后,E-cadherin显著上调;模型组MF标志蛋白α-SMA高于对照组和治疗组。治疗组小管间质区α-SMA、FN表达较模型组明显减少;Masson及Sirius Red染色可见治疗组纤维性沉积明显少于模型组,表明SRC可通过阻抑小管上皮细胞向MF转化而减少间质ECM的合成,最终抑制小管间质纤维化。
PAI-1可抑制纤溶酶原的活化,降低ECM的降解,促进组织ECM的积聚。研究发现,在肾小球纤维化区域也可检测出PAI-1表达增高[9]。本研究结果显示治疗组PAI-1表达低于模型组,且与对照组比较差异无统计学意义,表明该药可抑制PAI-1表达并增加ECM的降解,从而改善DN。
综上,SRC可减少尿白蛋白排泄率,抑制小管间质纤维化,从而显著改善C57BL/6小鼠的DN,阻抑EMT及抑制PAI-1蛋白表达是其作用机制。
[1]Chow FY,Nikolic-Paterson DJ,Atkins RC,et al.Macrophages in streptozotocin-induced diabetic nephropathy:potential role in renal fibrosis[J].Nephrol Dial Transplant,2004,19(12):2987-2996.
[2]Zeisberg EM,Potenta SE,Sugimoto H,et al.Fibroblasts in kidney fibrosis emerge via endothelial-to-mesenchymal transition[J].J Am Soc Nephrol,2008,19(12):2282-2287.
[3]Qi Z,Fujita H,Jin J,et al.Characterization of susceptibility of in⁃bred mouse strains to diabetic nephropathy[J].Diabetes,2005,54 (9):2628-2637.
[4]Huang F,Xu L,Ganggang S,et al.Antioxidant isolated from schisan⁃dra propinqua(Wall.)Baill[J].Biol Res,2009,42(3):351-356.
[5]Osicka TM,Comper WD.Characterization of immunochemically nonreactiveurinaryalbumin [J].ClinicalChemistry,2004,50(12): 2286-2291.
[6]Svensson M,Sundkvist G,Arnqvist HJ,et al.Signs of nephropathy may occur early in young adults with diabetes despite modern diabe⁃tes management:results from the nationwide population-based Dia⁃betes Incidence Study in Sweden(DISS)[J].Diabetes Care,2003,26 (10):2903-2909.
[7]Kralik PM,Long Y,Song Y,et al.Diabetic albuminuria is due to a small fraction of nephrons distinguished by albumin-stained tubules and glomerular adhesions[J].Am J Pathol,2009,175(2):500-509.
[8]Iwano M,Plieth D,Danoff TM,et al.Evidence that fibroblasts de⁃rive from epithelium during renal interstitial fibrosis[J].J Clin In⁃vest,2002,110(3):341-350.
[9]Yang C,Patel K,Harding P,et al.Regulation of TGF-β1/MAPK-me⁃diated PAI-1 gene expression by the actin cytoskeleton in human mesangial cells[J].Exp Cell Res,2007,313(6):1240-1250.

