CaMKⅡ在收缩促进骨骼肌细胞GLUT4转位中的作用*
于俊娜 牛文彦
骨骼肌是摄取葡萄糖维持血糖稳态的重要器官,胰岛素和骨骼肌收缩以不同的信号机制促进胞浆中的葡萄糖转运子4(glucose transporter 4,GLUT4)转位到细胞膜上增加葡萄糖摄取量[1]。氨乙酰胆碱(Carbachol,Cch)是乙酰胆碱的稳定类似物,可去极化骨骼肌细胞膜,造成收缩[2]。在培养的小鼠C2C12骨骼肌细胞中使用Cch可模拟运动的作用[3]。Ca2+通过许多钙敏感激酶进行信号传导。本研究通过测定C2C12小鼠骨骼肌细胞膜上的GLUT4myc的水平和钙-钙调素依赖型蛋白激酶Ⅱ(CaMKⅡ)的磷酸化水平,探讨CaMKⅡ在收缩的骨骼肌细胞中促进GLUT4myc转位的作用。
1 材料与方法
1.1 材料 C2C12 GLUT4myc骨骼肌细胞株由本实验室建立,Hanks液、DMEM(天润善达公司),胎牛血清(以色列Bioind公司),马血清(美国Gibco公司),Blasticidin-HCl(德国Calbio⁃chem公司),抗myc抗体(美国Sigma公司),偶联辣根过氧化物酶(HRP)的山羊抗兔抗体(美国Jackson Immuno Research公司),抗磷酸化CaMKⅡ抗体(美国Cell Signaling公司),偶联HRP的山羊抗兔抗体、驴抗鼠IgM抗体(美国Jack son Immu⁃noResearch公司),增强化学发光底物检测试剂盒(美国Milli⁃pore公司)。KN93、KN62(加拿大Calbiochem公司)。
1.2 方法
1.2.1 细胞培养 用含10%胎牛血清的DMEM高糖培养基,在37℃,体积分数为0.05的CO2条件下培养C2C12 GLUT4myc成肌细胞,将成肌细胞接种到培养板中,用含5%马血清的DMEM高糖培养基诱导分化为多核肌管,每2 d换液,于第5天用于实验。将培养板中的细胞无血清培养4 h后随机分为对照组和Cch组,分别加入无血清培养基或100 μmol/L的Cch孵育10 min。各组分为抑制剂亚组和对照亚组,分别用于测定细胞膜上GLUT4myc的水平及检测CaMKⅡ的磷酸化。
1.2.2 酶联免疫吸附法(ELISA)测定细胞膜上GLUT4myc的水平 抑制剂亚组加入10 μmol/L抑制剂KN93或KN62于处理前30 min预孵育细胞。每亚组设3个平行复孔。处理细胞后,多聚甲醛固定,甘氨酸淬灭,5%(V/V)的脱脂牛奶封闭后,用抗myc抗体室温孵育1 h;用偶联过氧化物酶HRP的山羊抗兔IgG室温孵育1 h;加入底物邻苯二胺溶液,反应约20 min后终止,用酶标仪测定上清液492 nm的吸光度值,重复4次。
1.2.3 Western blotting法检测CaMK II的磷酸化 抑制剂亚组将10 μmol/L的KN93提前30 min加入细胞预孵育。处理细胞后,裂解细胞,65℃加热15 min,体积分数为0.075的SDS-PAGE电泳,免疫印迹检测CaMKⅡ的磷酸化,一抗用CaMKⅡ磷酸化抗体,二抗用偶联HRP的山羊抗兔抗体,以Actinin1作为内参,增强化学发光底物试剂盒检测,曝光,重复4次。结果用Image J软件处理。
1.3 统计学方法 采用SPSS 11.5统计软件包进行统计学分析。所有实验数据均以均数±标准差(±s)表示,用单因素方差分析比较3组均数间的差异,3组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞表面GLUT4myc水平的比较 Cch使细胞膜上GLUT4myc的水平显著增加(P<0.01)。CaMKⅡ抑制剂KN93和KN62不影响对照组细胞膜上GLUT4myc的水平(P>0.05),但抑制Cch组中对照亚组细胞膜上GLUT4myc的表达(P<0.05或P<0.01),见表1、2。
2.2 KN93对CaMKⅡ磷酸化的影响 Cch可增加CaMKⅡ的磷酸化,KN93不影响对照组CaMKⅡ的磷酸化水平,但可以抑制Cch刺激的CaMKⅡ磷酸化(P<0.01),见表3、图1。
表1 KN93对各组中细胞表面GLUT4myc水平的影响(n=12,±s)
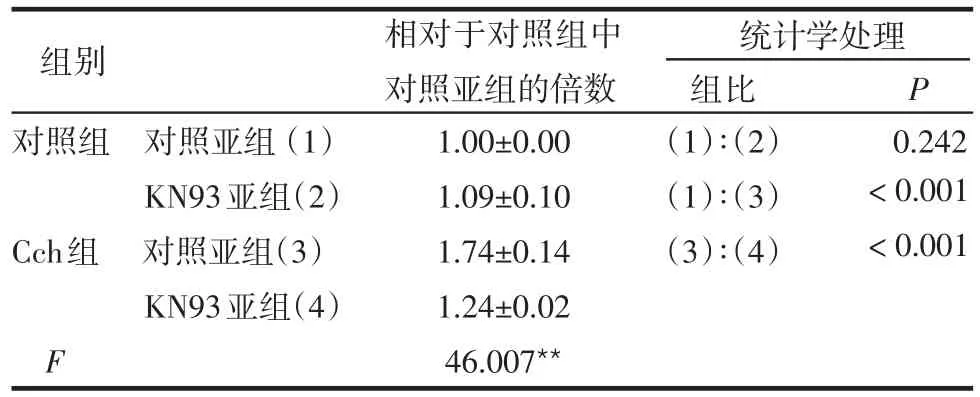
表1 KN93对各组中细胞表面GLUT4myc水平的影响(n=12,±s)
**P<0.01
组别 相对于对照组中对照亚组的倍数统计学处理组比 P对照组 对照亚组(1)KN93亚组(2)Cch组 对照亚组(3)KN93亚组(4)F 1.00±0.00 1.09±0.10 1.74±0.14 1.24±0.02 46.007**(1)∶(2)(1)∶(3)(3)∶(4)0.242<0.001<0.001
表2 KN62对各组中细胞表面GLUT4myc水平的影响(n=12,±s)
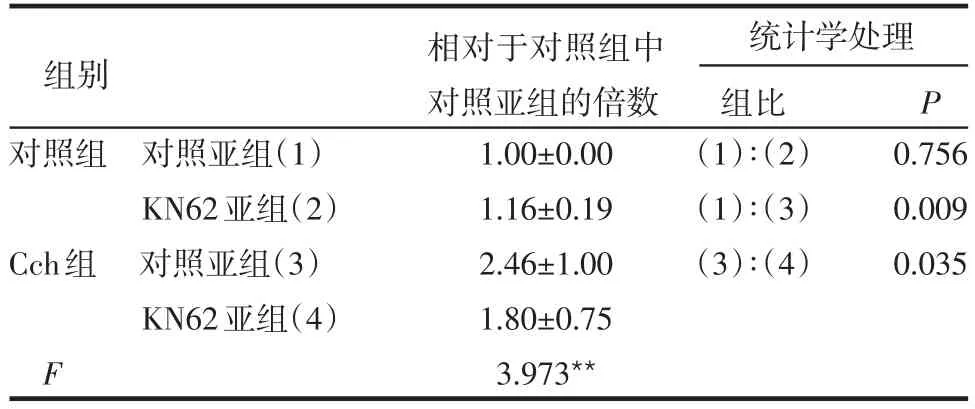
表2 KN62对各组中细胞表面GLUT4myc水平的影响(n=12,±s)
**P<0.05
组别 相对于对照组中对照亚组的倍数统计学处理组比 P对照组 对照亚组(1)KN62亚组(2)Cch组 对照亚组(3)KN62亚组(4)F 1.00±0.00 1.16±0.19 2.46±1.00 1.80±0.75 3.973**(1)∶(2)(1)∶(3)(3)∶(4)0.756 0.009 0.035
表3 CaMKⅡ磷酸化水平倍数的比较(n=4,±s)

表3 CaMKⅡ磷酸化水平倍数的比较(n=4,±s)
*P<0.05
组别 相对于对照组中对照亚组的倍数统计学处理组比 P对照组 对照亚组(1)KN93亚组(2)Cch组 对照亚组(3)KN93亚组(4)F 1.00±0.00 1.19±0.41 2.98±1.54 1.27±0.18 5.24*(1)∶(2)(1)∶(3)(3)∶(4)0.750 0.004 0.007

图1 KN93对C2C12GLUT4myc骨骼肌CaMKⅡ磷酸化的影响
3 讨论
胰岛素刺激GLUT4从胞浆的储存囊泡(GLUT4囊泡)转位到细胞膜上转运葡萄糖进入细胞,从而促进骨骼肌摄取葡萄糖。运动时肌肉收缩是另一个重要的生理性刺激,促进GLUT4转位到细胞膜[4]。本研究采用Cch孵育C2C12骨骼肌细胞,模拟运动的作用,通过测定C2C12 GLUT4myc小鼠骨骼肌细胞膜上GLUT4myc的水平和CaMKⅡ的磷酸化,探讨CaMKⅡ在收缩刺激骨骼肌细胞GLUT4myc转位机制中的作用。
Cch通过激活乙酰胆碱受体和继发的Na+的流入,诱导间接去极化,动作电位改变二氢吡啶受体的构象,开放肌浆网Ca2+释放通道,将Ca2+释放入胞浆,Ca2+浓度升高从而触发收缩[5]。笔者的前期工作显示Cch能快速升高骨骼肌细胞胞浆Ca2+浓度[3]。肌肉收缩导致细胞GLUT4转位的信号机制还不明确,但可以确定的是Ca2+信号和腺苷一磷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是收缩促进骨骼肌摄取葡萄糖的两个重要的信号机制[6-7]。
C2C12骨骼肌细胞表达CaMKⅡ,本研究显示Cch显著增加细胞膜上的GLUT4myc水平和CaMKⅡ的磷酸化水平,表明Cch促进GLUT4myc转位并激活CaMKⅡ。抑制CaMKⅡ的磷酸化可抑制Cch增加的细胞膜上GLUT4myc水平,提示CaMKⅡ介导收缩促进GLUT4myc转位的作用。GLUT4处于由胞浆向胞膜外排并由胞膜内吞进入胞浆的动态平衡中,降低GLUT4的内吞或加快GLUT4的外排均可导致细胞膜上的GLUT4数量增加。胰岛素促进骨骼肌葡萄糖摄取主要通过增加GLUT4外排。另外胞浆Ca2+浓度升高,可促进大鼠骨骼肌L6细胞中GLUT4的外排,并抑制其内吞,增加骨骼肌葡萄糖的摄取,亦由CaMKⅡ介导。而收缩如何调节GLUT4的运输,CaMKⅡ在其中的作用如何则有待进一步研究。
糖尿病患者存在胰岛素分泌障碍和作用缺陷,而收缩可促进骨骼肌摄取葡萄糖,具有胰岛素替代作用,运动对血糖调节发挥重要作用。因此研究阐明运动/肌肉收缩调节GLUT4转位和葡萄糖摄取的机制有助于改善胰岛素抵抗、预防和治疗糖尿病。
[1]Lauritzen HP,Galbo H,Toyoda T,et al.Kinetics of contraction-in⁃duced GLUT4 translocation in skeletal muscle fibers from living mice[J].Diabetes,2010,59(9):2134-2144.
[2]Wright DC,Hucker KA,Holloszy JO,et al.Ca2+and AMPK both me⁃diate stimulation of glucose transport by muscle contractions[J].Dia⁃betes,2004,53(2):330-335.
[3]Niu W,Bilan PJ,Ishikura S,et al.Contraction-related stimuli regu⁃late GLUT4 traffic in C2C12-GLUT4myc skeletal muscle cells[J]. Am J Physiol Endocrinol Metab,2010,298(5):E1058-1071.
[4]Sakamoto K,Arnolds DE,Ekberg I,et al.Exercise regulates Akt and glycogen synthase kinase-3 activities in human skeletal muscle[J]. Biochem Biophys Res Commun,2004,319(2):419-425.
[5]Rudolf R,Mongillo M,Magalhães PJ,et al.In vivo monitoring of Ca (2+)uptake into mitochondria of mouse skeletal muscle during con⁃traction[J].J Cell Biol,2004,166(4):527-536.
[6]Wright DC,Geiger PC,Holloszy JO,et al.Contraction-and hypox⁃ia-stimulated glucose transport is mediated by a Ca2+-dependent mechanism in slow-twitch rat soleus muscle[J].Am J Physiol Endo⁃crinol Metab,2005,288(6):E1062-1066.
[7]Taylor EB,Goodyear LJ.Targeting skeletal muscle AMP-activated protein kinase to treat type 2 diabetes[J].Curr Diab Rep,2007,7(6): 399-401.

