正畸微种植体周围炎对骨结合界面影响的研究
胡赟 郑雷蕾 唐甜 赵志河 宋锦璘 邓锋
(1.重庆医科大学附属口腔医院 口腔预防与儿童牙病科;
2.正畸科,重庆 400015;3.四川大学华西口腔医院 正畸科,成都 610041)
正畸微种植体周围炎对骨结合界面影响的研究
胡赟1郑雷蕾2唐甜3赵志河3宋锦璘2邓锋2
(1.重庆医科大学附属口腔医院 口腔预防与儿童牙病科;
2.正畸科,重庆 400015;3.四川大学华西口腔医院 正畸科,成都 610041)
目的 研究微种植体周围炎对微种植体-骨界面的组织学改变,同时对龈沟液相关细胞因子进行检测,从而探讨微种植体周围炎的发生机制。方法 健康雄性Beagle纯种犬4只,采用自身对照,随机选定实验动物一侧为对照组,一侧为实验组,每侧植入4枚微种植体。实验组种植体颈部结扎丝线,诱导微种植体周围炎。在植入后第1、2、3、4周分别处死动物,处死前收集种植体周围龈沟液(PISF),酶联免疫吸附试验(ELISA)检测肿瘤坏死因子-α(TNF-α)含量,收集标本做硬组织切片观察。结果 根据植入后时间的延长,实验组微种植体颈部表现明显的进展性破坏:植入1周微种植体颈部聚集大量炎性细胞,但并没有破坏皮质骨;植入2周微种植体颈部皮质骨已经出现少量角形吸收;植入3周表现骨吸收进一步向纵深发展;植入4周表现骨吸收已经至第二螺纹,充满大量胶原纤维。植入后1、2、3、4周,实验组与对照组PISF和TNF-α相比均有显著性差异(P<0.05),实验组高于对照组;实验组植入后4周PISF和TNF-α显著高于其余各阶段(P<0.05)。结论 微种植体周围炎首先破坏结合界面颈部,并沿界面进一步纵深发展。无论是健康或者炎症的微种植体周围都有TNF-α表现,炎症的发生可能是造成TNF-α含量上调的始动因素,炎症的发生进一步加剧了TNF-α表达的上调。
微种植体; 微种植体周围炎; 肿瘤坏死因子-α; 种植体周围龈沟液
微种植体应用于正畸临床在近年来取得了极大的发展。早期对于微种植体的研究主要集中在种植体的骨组织界面,并且取得了突出的成果。近年来,对于微种植体与口腔黏膜上皮的软组织界面的研究正逐渐引起众多学者的重视。
种植体与自然牙齿在结构上有着本质的区别,种植体表面没有牙骨质和牙周膜纤维,与口腔黏膜上皮的附着也不同于自然牙的结合上皮,因而其生物屏障作用就显得相对薄弱,容易被细菌及其他炎症因子侵入组织内环境而引起炎症。微种植体周围炎(peri-implantitis)是指种植体周围组织由于受到细菌等致病原的侵袭而引起的组织炎症反应。微种植体周围炎往往会导致微种植体-骨界面的丧失、骨组织吸收、微种植体松动,是导致微种植体失败的主要原因之一。本研究通过建立Beagle犬的微种植体周围炎的动物模型,研究微种植体周围炎对微种植体-骨界面的组织学改变,对龈沟液相关细胞因子进行检测,从而探讨微种植体周围炎的发生机制,以期为微种植体广泛应用于临床奠定基础。
1 材料和方法
1.1 实验动物
选用健康雄性Beagle纯种犬4只(由四川大学华西实验动物中心提供),体重13~14 kg,年龄为18个月。要求牙体、牙列完整,无龋坏及牙周病,咬合关系正常。根据预计观察的时间,将犬分别编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ号,分为1、2、3、4周组。所有Beagle犬均采用笼中特殊饲养的方法,定时、定量摄食,自由饮水。适应性饲养1周后,进行实验[1]。
1.2 主要实验材料及试剂
Aarhus microcrew自攻型纯钛微种植钉(直径1.6mm,螺纹长度6.0mm,穿龈部分长度2.5mm,Medicon公司,德国);速眠新Ⅱ(长春农牧大学兽医研究所产);Eppendorf离心管(Boster公司,中国);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒(Immunotech公司,法国),硬组织切片机(Leica公司,德国);光学显微镜(Nikon公司,日本)。
1.3 植入过程
在Beagle犬后肢臀部肌肉注射麻醉药速眠新Ⅱ(0.04mL·kg-1)麻醉后,四肢固定于犬固定床,绷带张口固定,消毒铺巾。种植手术由同一术者行常规操作完成。含肾上腺素2%利多卡因浸润注射术区口腔前庭沟底,以减少术区出血和保证麻醉深度。在下颌双侧前磨牙区域用探针暴露颊侧骨质,低速引导钻(钻速800 r·min-1)钻开皮质骨,持续用冷生理盐水冲洗降温;用就位器将微种植体植入到位。采用同体对照,随机选定实验动物一侧为对照组,另一侧为实验组,每侧植入4枚微种植体。实验组种植体颈部结扎丝线,诱导微种植体周围炎产生。
手术后,所有实验犬均摄入半流质饲料,从而避免硬质食物对微种植体的撞击,定期对种植体动度和种植体周围牙龈进行检查,同时定期对种植区进行X线摄片。
1.4 种植体周围龈沟液(peri-implant sulcular fluid,PISF)的收集
在植入后第1、2、3、4周分别处死第Ⅰ、Ⅱ、Ⅲ、Ⅳ号动物,处死前收集PISF。将滤纸剪裁成条状(2mm×10mm),放置于1.5mL的EP离心管中,用精密电子天平(上海天平仪器厂)定量后备用。收集龈沟液前除尽收集部位的菌斑,隔湿后用气枪轻轻吹干种植体表面,1min后,将滤纸条插入种植体与软组织间隙,当有阻力时停止插入,停留30 s后,取出纸签,放回离心管中,立即称重。前后重量之差即为PISF的量,以龈沟液的密度为1 g·mL-1计算PISF的体积。然后加入200μL样本稀释液置于-70℃冰箱保存待检。每枚微种植体收集颊、舌、近、远中向4个位点的龈沟液[2]。
1.5 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)法检测TNF-α
将龈沟液标本在室温下自然解冻后,低温离心10min(4℃,10 000 r·min-1),取上清液。将100μL TNF-α标准液、质控液及样本加入含抗TNF-α单克隆抗体的96板孔中,留出第1孔作空白对照,再加入100μL TNF-α单克隆抗体和碱性磷酸酶于各孔,底物空白孔除外,振荡培养2 h(18~25℃,350 r·min-1)。洗涤后,加入200μL底物到所有的孔中,振荡培养30min(24℃,350 r·min-1)。加入50μL终止液,用405 nm的波长检测吸光度值,计算龈沟液中TNF-α的含量。
1.6 组织学观察
观察期毕处死实验动物,离体取得包含微种植体、黏膜和颌骨的标本,固定于10%甲醛溶液1周。用涡轮机将标本修整成10mm×10mm×6mm组织块,要求每个组织块包含1枚种植钉和其周围至少4mm的骨质和被覆骨黏膜。将组织块用甲基丙烯酸甲酯包埋,在硬组织切片机上进行切片,然后行甲苯胺蓝染色。
1.7 统计学分析
用SPSS 10.0软件对实验结果进行统计学分析,实验数据均以±s表示,样本均数的比较采用单向方差分析。
2 结果
2.1 临床观察
植入微种植体均保持稳定,未见松动脱落,实验组微种植体周围黏膜组织肿胀,围绕种植体颈部,探诊有出血。对照组微种植体周围黏膜颜色正常,未见红肿,无探针出血(图1)。
2.2 组织学观察
根据植入后时间的延长,实验组微种植体颈部表现明显的进展性破坏(图2):植入1周微种植体颈部聚集大量炎性细胞,但并没有破坏皮质骨;植入2周微种植体颈部皮质骨已经出现少量角形吸收;植入3周表现骨吸收进一步向纵深发展;植入4周表现骨吸收已经达至第二螺纹,其中充满大量的胶原纤维(图2)。
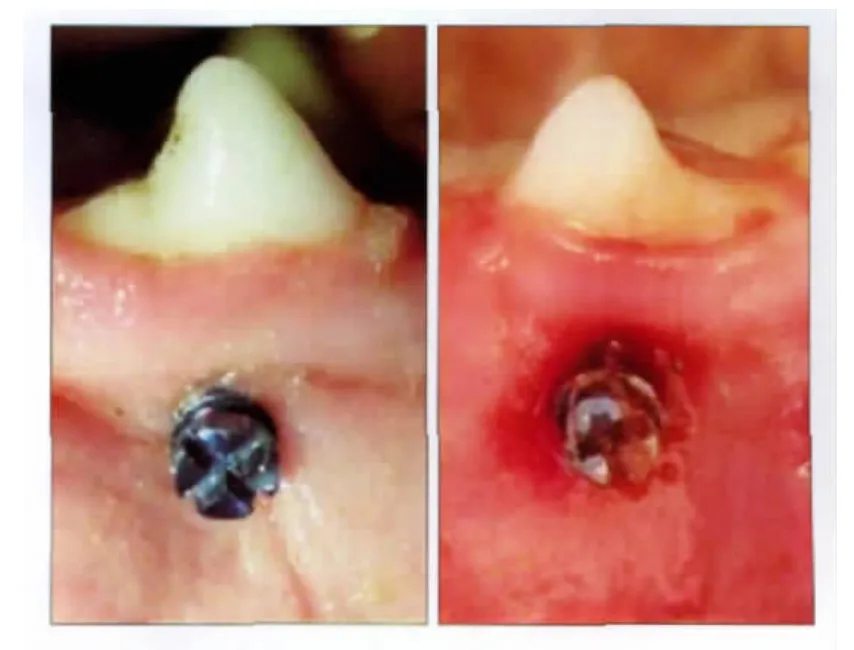
图1 微种植体植入情况Fig 1 Microscrew implantation
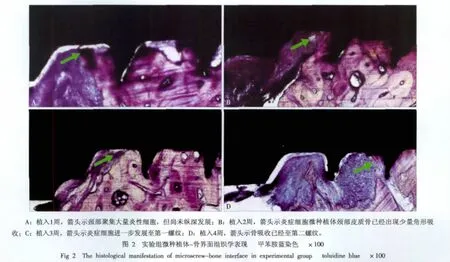
2.3 PISF检测结果
植入后1、2、3、4周,实验组与对照组相比均有显著性差异(P<0.05),实验组PISF量高于对照组;对照组在植入各阶段PISF量没有显著性差异(P>0.05);实验组各阶段PISF量两两比较:实验组植入后4周PISF显著高于其余各阶段(P<0.05),而植入后2周与3周比较,实验组PISF量没有显著性差异(P>0.05),见图3。
2.4 TNF-α检测结果
植入后1、2、3、4周,实验组与对照组相比均有显著性差异(P<0.05),实验组TNF-α量高于对照组;对照组在植入各阶段TNF-α量没有显著性差异(P>0.05);实验组各阶段TNF-α量两两比较:实验组植入后4周显著高于其余各阶段(P<0.05),而植入后2周与3周比较,实验组TNF-α量没有显著性差异(P>0.05),见表1。
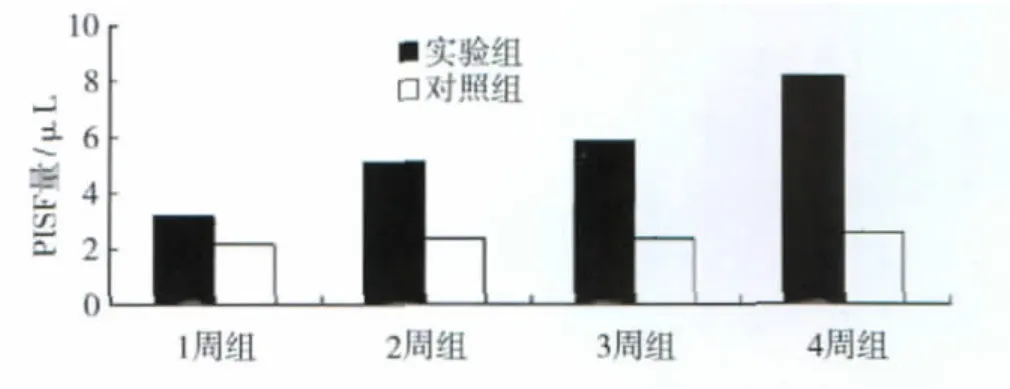
图3 微种植体植入后实验组与对照组各阶段PISF量Fig 3 Detection results of PISF between experimental group and control group after microscrew implantation
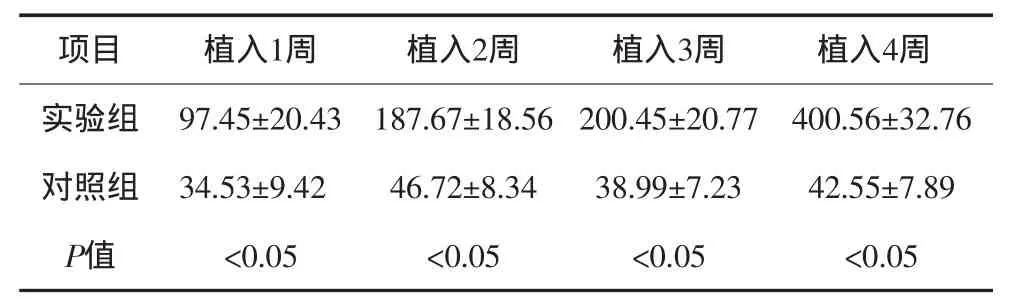
表1 微种植体植入后实验组与对照组各阶段TNF-α检测结果Tab 1 Detection results of TNF-α between experimental group and control group after m icroscrew im plantation ng·m L-1
3 讨论
3.1 微种植体颈部“生物封闭”
微种植体贯穿口腔黏膜组织,其一端进入组织内环境,另一端在口腔这个外环境是有菌的环境,如果没有一种封闭屏障存在,微生物则侵入组织内,形成感染。天然牙颈部的生物封闭是由结合上皮、上皮下结缔组织、游离龈纤维束、牙槽嵴纤维束的连接作用完成的。因此种植体在贯穿口腔黏膜组织这一区域与软组织间能否有一种“生物封闭”,对种植体周组织健康和种植体长期稳固性至关重要。
本实验发现:微种植体周围炎组在植入后随着时间的延长,其颈部表现明显的进展性破坏:植入1周微种植体颈部聚集大量炎性细胞,但并没有破坏皮质骨;植入2周微种植体颈部皮质骨已经出现少量角形吸收;植入3周表现骨吸收进一步向纵深发展;植入4周表现骨吸收已经至第二螺纹,充满大量胶原纤维。这说明微种植体对骨界面的破坏可能最先破坏“生物封闭”,随后进一步纵深发展,引起微种植体的松动甚至脱落。有学者观察到种植体颈部存在类同天然牙颈部的基板和半桥粒结构,培养的上皮细胞可在钛、羟磷灰石等材料表面形成基板和半桥粒形式的黏附。这种类同天然牙颈部的“生物封闭”机制的存在,对种植体的成功性予以理论支持[3-4]。种植手术后,血液及组织渗出液与种植体接触,很快吞噬成纤维细胞与种植体表面接触,并分泌细胞外基质附着在种植体表面,术后1周就有上皮附着发生,在术后3周就可形成“生物封闭”。一些因素可破坏建立起的“生物封闭”,病理过程与牙周病机制相同。
3.2 PISF与微种植体周围炎的关系
龈沟液是一种炎性渗出液,它的产生与龈下菌斑的性质和比例密切相关。牙龈炎症时龈沟内含有的菌斑微生物产生一定量的大分子产物,这些产物在细胞与基底膜间扩散,聚集于基底膜,从而产生了持续的渗透梯度,形成了龈沟液的流动。与自然牙一样,种植体周围也存在龈沟。PISF是指种植体周围渗出的液体。本研究发现:实验组在植入各阶段PISF量高于对照组,这表示微种植体周围PISF量的增加是由于种植体周围炎症的发生而发生,这一结果与牙周病学的研究相似[5]。研究还发现:实验组植入后4周PISF和TNF-α显著高于其余各阶段,同时组织学研究也显示骨界面的破坏在实验组呈进行性发展,在4周时破坏最明显。这提示PISF量更多的是反映了种植体周围骨组织的变化,与Last等[6]和徐淑兰等[7]的研究结果一致。
3.3 细胞因子TNF-α参与微种植体周围炎的机制
本实验结果表明:微种植体周围组织无论是健康还是有炎症,其PISF中均有TNF-α的表达,微种植体周围炎的TNF-α的表达高于无炎症者。PISF来源于血浆和组织液的渗出,推测微种植体周围组织健康者的TNF-α可能是血浆中渗出所致[8-9]。微种植体周围炎组TNF-α表达水平高于健康组,说明炎症的发生可能是造成TNF-α含量上调的始动因素,炎症的发生进一步加剧了TNF-α表达的上调。文献[10-11]报道:细胞因子可以通过旁分泌、自分泌调节免疫细胞,促进破骨细胞的活性,参与炎症过程,导致组织破坏。徐淑兰等[7]研究犬实验性种植体周围炎龈沟液渗出的几种炎性细胞因子浓度的变化与骨吸收的关系发现:丝线结扎4周时龈沟液细胞因子的浓度明显增高,骨性界面的骨组织出现明显吸收。这与本研究结果一致,结合实验进行的含微种植体的硬组织切片观察,说明实验性微种植体炎进展到4周时,骨吸收最明显。
微种植体周围炎是正畸微种植体脱落的重要原因,涉及到口腔微生物学、种植学、正畸学、生物力学等多种交叉领域,如何进一步明确微种植体周围炎的发生机制和优化微种植体植入设计方案尚需进一步探讨。
[1] Schwarz F,Herren M,Sager M,et al.Comparison of naturally occurring and ligature induced peri-implantitis bone defects in humans and dogs[J].Clin Oral Implants Res,2007,18(4):161-170.
[2] Kaklamanos EG,Tsalikis L.A review on peri-implant crevicular fluid assays potential in monitoring and predicting peri-implant tissue responses[J].J Int Acad Periodontol,2002,4(2):49-59.
[3] Mankoo T.Contemporary implant concepts in aesthetic dentistry—Part 1:Biologic width[J].Pract Proced Aesthet Dent,2003,15(8):609-616.
[4] Hermann JS,Schoolfield JD,Nummikoski PV,et al.Crestal bone changes around titanium implants:A methodologic study comparing linear radiographic with histometric measurements[J]. Int J Oral Maxillofac Implants,2001,16(4):475-485.
[5] Niimi A,Ueda M.Crevicular fluid in the osseointegrated implant sulcus:A pilot study[J].Int J Oral Maxillofac Implants,1995,10(4):434-436.
[6] Last KS,Cawood JI,Howell RA,et al.Monitoring of Tübingen endosseous dental implants by glycosaminoglycans analysis of gingival crevicular fluid[J].Int J Oral Maxillofac Implants,1991, 6(1):42-49.
[7] 徐淑兰,张开宜,许曼波,等.实验性种植体周围炎龈沟液炎症细胞因子浓度的检测及其对界面骨吸收影响的研究[J].中国口腔种植学杂志,2002,7(3):108-110.
XU Shu-lan,ZHANG Kai-yi,XU Man-bo,et al.The effect of cytokines in gingival crevicular fluid on absorbition of bone interface in experimental peri-implantitis[J].Chin J Oral Implant, 2002,7(3):108-110.
[8] Panagakos FS,Aboyoussef H,Dondero R,et al.Detection and measurement of inflammatory cytokines in implant crevicular fluid:A pilot study[J].Int J Oral Maxillofac Implants,1996,11(6):794-799.
[9] Curtis DA,Kao R,Plesh O,et al.Crevicular fluid analysis around two failing denta implants:A clinical report[J].J Prosthodont,1997,6(3):210-214.
[10] Salcetti JM,Moriarty JD,Cooper LF,et al.The clinical,microbial,and host response characteristics of the failing implant[J].Int J Oral Maxillofac Implants,1997,12(1):32-42.
[11] Perala DG,Chapman RJ,Gelfand JA,et al.Relative production of IL-1 beta and TNF alpha by mononuclear cells after exposure to dental implants[J].J Periodontol,1992,63(5):426-430.
(本文编辑 汤亚玲)
Influence of the peri-im p lantitis to the m icroscrew-bone interface
HU Yun1,ZHENG Lei-lei2,TANG Tian3,ZHAO Zhi-he3,SONG Jin-lin2,DENG Feng2.(1.Dept.of Preventive and Pediatric Dentistry,The Affiliated Stomatology Hospital,Chongqing Medical University,Chongqing400015,China;2.Dept.of Orthodontics,The Affiliated Stomatology Hospital,Chongqing Medical University,Chongqing400015,China;3.Dept.of Orthodontics,West China College of Stomatology,Sichuan University,Chengdu610041,China)
ObjectiveTo study the histological change of microscrew-bone interface,detect the relative cytokine of gingival crevicular fluid,and explore the impossible mechanism of peri-implantitis.MethodsFour male Beagles were collected.Random ly select one side of animals jaw as the experimental group to induce the peri-implantitis, and another side as the controll group.Four microscrews were implanted on each side.In the 1st,2nd,3rd,4th weeks after implantation,collect peri-implant sulcular fluid(PISF)and detect tumor necrosis factor-α(TNF-α)levels before sacrificed,and the harvest tissue were observed in histological ways.Results According to the extension of time after implantation,the experimental group showed visible progress of interface destruction:1st week after implantation showed large numbers inflammatory cells collected at the neck but did not undermine the cortical bone;2nd week after implantation,cortical bone were observed angular absorption;Bone resorption continued to develop and at the 4th week,bone resorption were enlarged to the second thread of microscrew and the interface was filled with a large number of collagen fibers.ConclusionThe destruction of interface began at the neck of microscrew,and the further development was along the interface in depth. Both microscrews with peri-implantitis and the healthy controls showed the presence of TNF-α.Inflammation accumulation might trigger the up-regulation of TNF-α level,and the onset of inflammation would enhance the up-trend.
microscrew; peri-implantitis; tumor necrosis factor-α; peri-implant sulcular fluid
R 783.5
A
10.3969/j.issn.1000-1182.2011.01.005
1000-1182(2011)01-0017-04
2009-12-30;
2010-03-10
国家自然科学基金资助项目(81000463和10902075);高等学校博士学科点专项科研基金新教师类基金资助项目(200955031-20006)
胡赟(1979—),男,四川人,主治医师,博士
郑雷蕾,Tel:15086986968

