1株产α-半乳糖苷酶乳球菌的分离鉴定及酶学特性
周晶辉,胡超,刘晓柱,彭珍子,张学文
(湖南农业大学 生物科学技术学院,湖南 长沙 410128)
α-半乳糖苷酶(α-galactosidase, EC3.2.1.22)能够特异性水解α-半乳糖苷结构的碳水化合物[1-2]。α-半乳糖苷酶作为酶制剂添加到豆类饲料中,可以降解半乳糖苷寡糖类抗营养因子,有效减少肠道疾病的发生[3-5]。目前,普通α-半乳糖苷酶制剂难于满足饲料用酶制剂对耐热性和耐酸性的特殊要求,因此,研发饲用型α-半乳糖苷酶具有很好的市场前景。
笔者以湖南湘西地区富含豆粕的土壤为材料,筛选获得1株产α-半乳糖苷酶的细菌,经显微观察及基于16S rDNA的序列分析,初步判定细菌种属,并结合液体发酵培养对其酶学特性进行了初步研究。
1 材料与方法
1.1 材 料
采集湘西某豆腐店周围富含豆粕下脚料的土壤样品,封存于无菌塑料袋中,4 ℃保存,用于制备土壤悬液。初筛培养基[6]:酵母提取物5 g,胰化蛋白胨 10 g,氯化钠 10 g,琼脂粉 15 g,蒸馏水1 000 mL,调pH值为7.0,121℃灭菌20 min。复筛培养基:酵母提取物5 g,胰化蛋白胨 10 g,氯化钠 5 g,棉籽糖 2.5 g, 调pH值为7.0, 121 ℃灭菌20 min。
1.2 方 法
1.2.1 菌株筛选
土壤样品制成 10-4、10-5、10-6梯度的土壤菌悬液,分别涂布于初筛培养基(90 mm平板添加50 μL 2 mg/mL X-α-gal),37 ℃培养48 h,筛选呈蓝色的菌落[7]。复筛结合液体发酵培养,选择酶活较高的菌株,划线纯化,显微镜检查纯度,得菌株纯培养物。
1.2.2 纯化菌株显微形态及基于16S rDNA的分子鉴定
纯化菌株革兰氏染色,显微形态观察,采用CTAB/NaCl方法[8]提取细菌全基因组DNA,以细菌16S rDNA通用上游引物 5′-AGAGTTTGATCCTG GCTCAG-3′和下游引物5′-ACGGTTACCTTGTTAC GACTT-3′扩增纯化菌株16S rDNA基因片段,测序由上海生工生物工程技术服务有限公司完成。根据测序结果,用Blast程序与GenBank上已经登录的菌株16S rDNA序列进行比对,分析比对结果。
1.2.3 标准曲线的制作及酶活的测定
以不同浓度的对硝基酚为底物,在OD405nm处进行测定并绘制标准曲线[9]。采用对硝基酚-α-D-吡喃半乳糖(P-PNG)法[10-12]对菌株分泌的α-半乳糖苷酶的酶活进行测定。酶活单位定义为:在pH 4.0、37 ℃条件下,每分钟分解底物生成1 μmol对硝基酚所需要的酶量为1个α-半乳糖苷酶酶活单位。
1.2.4 pH和温度对α-半乳糖苷酶活性的影响
采用磷酸氢二钠-柠檬酸缓冲体系配制pH分别为2.6、3.0、3.6、4.0、4.4、5.2、5.6、6.0、6.6、7.2、8.0的缓冲液,测定酶活力,以酶活力最高者定为100%,以相对酶活力对所对应的pH值作图;将酶液与最适宜pH值的磷酸氢二钠-柠檬酸缓冲液分别在20、25、30、35、40、50、55、60、65、70、75、80 ℃水浴1 h,测定酶活力,得到酶液在不同反应温度下的酶活力,以酶活力最高者定为100%,以相对酶活力对温度作图。
1.2.5 细菌酶基因表达调控分析
收集不同浓度棉籽糖诱导下的发酵液上清 1 mL,各取200 μL分别置于酶标板的加样孔中,加入20 μL 2 mg/mL 的X-α-gal溶液,同时以液体发酵培养基作为空白对照,37 ℃温浴12 h后, 置于4℃冰箱充分显色,观察不同浓度棉籽糖诱导下显色情况。
1.2.6 葡萄糖和棉籽糖浓度对菌株产α-半乳糖苷酶的影响
挑取单菌落接种于不同浓度的葡萄糖和棉籽糖的液体培养基中,葡萄糖及棉籽糖的浓度分别设置为10、20、30、40,50 μmol/mL,37 ℃振荡培养48 h,在最适pH值和温度的条件下,分析葡萄糖和棉籽糖浓度对菌株产α-半乳糖苷酶的活性影响。
2 结果与分析
2.1 菌株的筛选及显微形态鉴定
通过添加 X-α-gal显色底物的筛选培养基培养,结合液体发酵培养基筛选,得到了1株产α-半乳糖苷酶细菌,肉眼观察细菌菌落边缘规则,微隆起,表面湿润,用革兰氏染色,分离菌株在显微镜下观察,结果,分离菌株呈现紫色,为革兰氏阳性细菌,细胞为球形。
2.2 细菌的16S rDNA克隆测序与菌种鉴定
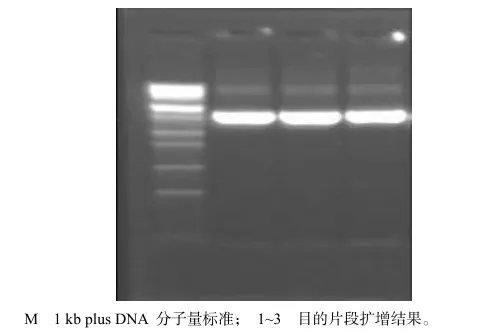
图1 分离菌株16S rDNA PCR扩增结果Fig.1 16S rDNA PCR product of screened strain
在分离细菌基因组DNA后,以16S rDNA的通用引物进行该基因的PCR扩增,重复的扩增都得到了大小确定的分子(图1),扩增分子克隆到T-载体并测序,序列用BLAST程序与GenBank中已经登录的16S rDNA进行核苷酸序列同源性比较,发现其与乳球菌16S rDNA同源性达98%,可以判定分离细菌为乳球菌属细菌。
2.3 粗酶活测定结果
以不同浓度的对硝基酚在405 nm处吸光度平均值为x轴,以对硝基酚的浓度为y轴绘制标准曲线(图2),用Excel办公软件作图,得公式y=53.314x+ 0.212 8,其中R2=0.996 8。
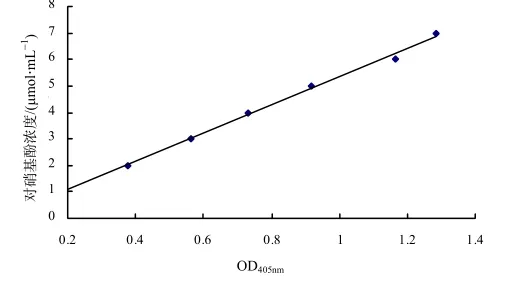
图2 对硝基酚OD405的标准曲线Fig.2 Standard curve of p-nitrophenol
取摇瓶发酵上清液 1 mL加入pH 4.0磷酸氢二钠-柠檬酸缓冲液2 mL中,37 ℃预热5 min后与1 mL10 mmol/L的PNPG底物反应10 min,用6 mL 0.2 mol/L NaCO3终止反应,分光光度计测定405 nm处吸光度值,同时设置对照管,测得吸光度值为1.160,计算得发酵上清液酶活为6.21 U/mL。
2.4 pH及温度对分离菌株分泌α-半乳糖苷酶活性的影响
图3分析表明, pH约5.5时,所分离菌株分泌的α-半乳糖苷酶表现相对较高的酶活力;图4表明在较低的温度(20~40 ℃)范围内,相对酶活力随着温度的升高而增加,随着温度的升高,酶活力逐渐下降,其最适宜温度为45 ℃左右。
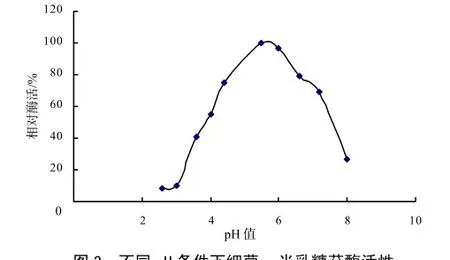
图3 不同pH条件下细菌α-半乳糖苷酶活性Fig.3 α-galactosidase activity of bacterium under different pH condition
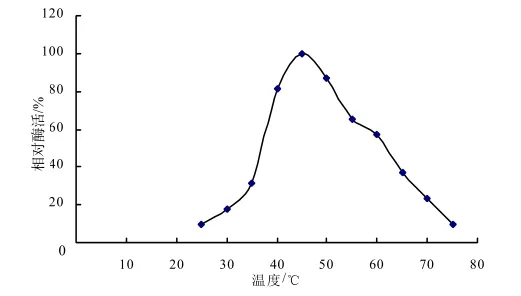
图4 不同温度条件下细菌α-半乳糖苷酶活性Fig.4 α-galactosidase activity of bacterium under different temperature condition
2.5 棉籽糖诱导下的酶与底物作用的显色反应
通过以棉籽糖作底物和X-α-gal显色的酶活性观察,进行酶表达诱导的分析。上清液显色反应结果表明,分离菌株分泌的α-半乳糖苷酶为胞外酶,能够使X-α-gal分解产生蓝色沉淀,从显色反应的程度来看,低浓度的D-棉籽糖对酶的分泌有诱导作用,当棉籽糖的浓度为30 μmol/mL时,诱导效果最佳,显色反应较为明显。
2.6 棉籽糖和葡萄糖对菌株分泌α-半乳糖苷酶的影响
根据显色反应建立起酶活力的分析方法后,以不同浓度棉籽糖和葡萄糖分别对摇瓶发酵菌进行处理,分析图5可知,分离菌株产α-半乳糖苷酶受到棉籽糖的诱导和葡萄糖的抑制作用,当棉籽糖的浓度约为30 μmol/mL时,诱导效果最佳,酶活性达到最高,随着棉籽糖浓度的增加,其对α-半乳糖苷酶的诱导合成作用已不明显;在较低葡萄糖浓度(0~20 μmol/mL)下,分离菌株合成α-半乳糖苷酶,随着葡萄糖的浓度增加而呈现上升趋势,随着葡萄糖浓度不断升高,菌株合成α-半乳糖苷酶受到葡萄糖的抑制,酶活力逐渐下降。
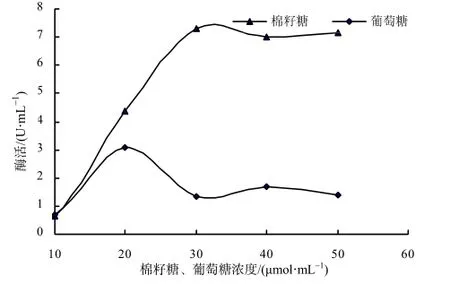
图5 不同棉籽糖和葡萄糖浓度下细菌产酶的活性Fig.5 α-galactosidase activity of bacterium under different concentrations of raffinose and glucose
3 讨 论
微生物合成的α-半乳糖苷酶为诱导型酶,高浓度的葡萄糖对其合成具有抑制作用[10],且不同种类的微生物合成α-半乳糖苷酶需要不同的诱导物。本研究结果表明,分离菌株合成α-半乳糖苷酶受棉籽糖的诱导,可能是α-半乳糖苷酶的合成受到相关操纵子的调控,各个基因独立发挥作用,棉籽糖作为酶的作用底物时起诱导作用进而提高菌体生长量及酶的合成量;合成受到葡萄糖的抑制,可能是分离菌株存在葡萄糖效应引起的,当培养基中有葡萄糖存在时,菌株会优先利用葡萄糖,葡萄糖的某种分解代谢物能降低生物体内 cAMP的水平,影响RNA聚合酶与启动子结合,以至转录作用不能进行,抑制了产酶基因的表达,酶的合成处于本底表达水平。但葡萄糖在0~20 μmol/mL时对酶的产生具有正向作用,可能是低浓度葡萄糖有利于细菌的生长,因而整体促进了酶的产生。
对霉菌(青霉)、植物(咖啡豆)[13-14]等α-半乳糖苷酶的研究已取得重要进展,诸多α-半乳糖苷酶基因已经被克隆[15-16]。由于细菌来源的α-半乳糖苷酶为单肽酶,活性发挥不需要糖基化,结构也更为简单,更利于操作,因此,借助于基因工程技术手段获得酶活高、耐热、耐酸性强的α-半乳糖苷酶成为研究热点。本研究已分离和鉴定出产α-半乳糖苷酶细菌,将以这一菌株为出发菌株,进行酶基因克隆和改造。
[1] Gregg Wallis L F,Richard Easton L,Karen Jolly,et a1.Galactofuranoic-oligoman nose N-linked glycans of α- galactosidase A fromAspergillus niger[J].Eur J Biochem,2001,268: 4134-4143.
[2] Naumoff D G.Phylogenetic analysis of α-galactosidases of the GH27 family [J].Molecular Biology,2004,38: 388-399.
[3] Donkoron,Henrjkssona,Vasiuevict,et a1.Probiotic strains as starter cultures improve angiotensin-converting enzyme inhibitory activity in soy yoghurt [J].Journal of Food Science,2005,70: 375-381.
[4] Kamaly K M.Bifidobacteria fermentation of soybean milk [J].Food Research International,1997,30: 675-682.
[5] Schiffmann R,Kopp J B,Austin H A,et a1.Enzyme replacement therapy in fabry disease: A randomized controlled trial [J].JAMA,200l,285:2743-2749.
[6] 刘彩琴,何国庆,陈启和.一株产α-半乳糖苷酶菌的分离与选育[J].食品与发酵工业,2006,32(11):32-35.
[7] GossrauR LoidaZ.Histochemical dectetion of α- galactosidase with 5-bromo-4-chloro-3-indolyl-α-D-galctoside [J].Acta Histochem,1989,85: 213.
[8] 刘晓侠,林建平,岑沛霖.微生物基因组DNA提取方法的比较与改进[J].嘉兴学院学报,2007,19(3): 48-50.
[9] 许尧新,姚晓红,许少春,等.两种测定程序对饲用α-半乳糖苷酶活性检测的结果比较[J].浙江农业学报,2004,16(6): 349-353.
[10] Lokuge M A,Mathew C D.Kinetic studies of extracellular alpha-galactosidase fromCitrobacter freundii[J].J of the Nation Science Foundation Sri Lanka,2001,29: 3-4.
[11] Sripuan T,Aoki K.Purification and characterization of thermostable alpha-galactosidase fromGanoderma lucidum[J].Bioscience Biotecnology and Biochemistry,2003,67 (7): 1485-1491.
[12] Liu Caiquin,Ruan Hui,Shen Huafeng,et al.Optimization of the fermentation medium for α- galactosidase production fromAspergillus foetidusZU-G1 using response surface methodology [J].Journal of Food Science,2007,72(4): 120-125.
[13] Fridjonsson O,Mattes R.Prodution of recombinant αgalactosidases inThermus thermophilus[J].Applied and Environmental Microbiology,2001,67(9): 4192-4198.
[14] Boucher I,Vadeboncoeur C,Moineau S.Characterization of genes involved in the metabolism of α-galactosidases byLactococcus raffinolactis[J].Applied and Environmental Microbiology,2003,69(7): 4049-4056.
[15] De Vries R P,Van Den Broeck H C,Dekkers E,et a1.Differential expression of three α-galactosidases genes and single β-galactosidase gene fromAspergillus niger[J].Applied and Enviromental Microbiology,1999,65(6): 2453-2460.
[16] Ademark P,de vries R P,Hagglund P,et al.Cloning and characterization ofAspergillus nigergenes encoding an α-galactosidases and β-mannosidase involved in galactomannan degradation [J].European Journal of Biochemistry,2001,268: 2982-2990.
英文编辑:易来宾
——全棉籽的加工与利用

