锌离子浓度对滴水观音生长和生理特性的影响
夏红霞,朱启红
(重庆文理学院,重庆 永川 402168)
植物修复技术是一种新兴的绿色生物技术,在不破坏土壤生态环境、保持土壤结构和微生物活性的情况下,经植物根系直接将大量的重金属元素吸收,通过收获植物地上部分来修复被污染的土壤[1]。利用植物来修复环境,具有基建和运行费用低、技术含量低、维护管理方便、耐冲击等优点,在世界范围内得到迅速发展[2-4],尤其适合于广大农村、中小城市的生活污水处理。湿地植物作为人工湿地生态修复工程中最明显的生物特征,在湿地净化污水中发挥着重要的作用,而且还具有生态美学和经济价值[5]。本研究拟用滴水观音处理含锌废水,探索滴水观音对锌的耐受性机理,以期为滴水观音处理重金属废水提供依据。
1 材料和方法
1.1 供试材料
滴水观音,购于永川某花卉苗圃中心。选取采集到的滴水观音大小均一的地下茎培养于Hoagland营养液中,进行纯化。待植株长出新叶后,用于水培盆栽试验。
1.2 试验设计
将纯化后长势基本相同的植株样品进行不同的锌水平处理。营养液中锌以ZnSO4·7H2O加入(分析纯)。锌处理液质量浓度为含Zn2+0(CK),5,10,50,100,200,400 mg/L。植株每天光照 12 h,保持24 h连续通气,每3 d换1次营养液。处理期间每天观察植物的长势和症状表现,第15天测定滴水观音叶片叶绿素、丙二醛、超氧自由基(O2-·)指标,21 d后收获。每处理重复3次。
1.3 样品分析与测定方法
叶绿素采用丙酮-乙醇混合液提取,分光光度法测定。丙二醛(MDA)的测定参考林植芳等[6]的硫代巴比妥酸(TBA)法和赵世杰[7]的方法进行。超氧自由基(O2-·)利用羟胺氧化、分光光度法测定。
2 结果与分析
2.1 锌对植株株高、生长状况和鲜质量的影响
在Zn2+胁迫下,滴水观音生长与对照相比有明显变化。低质量浓度Zn2+处理中,滴水观音植株株高、鲜质量都有所增高。高质量浓度Zn2+处理下,植株则出现明显的重金属毒害症状,具体表现为:植株新展开的叶片变小变窄,叶片黄化、边缘卷曲,植株矮小,茎节短小。特别是Zn2+质量浓度大于50 mg/L的处理,植株个体矮小,下部叶片完全黄化卷曲,试验结束之后的一段时间,叶片几乎全部失绿,叶脉间呈透明状,有些植株开始萎蔫,从茎中部开始变黄、变褐,甚至干枯死亡。在试验后期,400 mg/L处理的植株根须已有褐化,根毛稀少,部分植株根须已腐烂。这与在水稻[8]、小白菜[9]上的研究结果一致。
锌对植物生长产生抑制的原因很多,可能是Zn2+进入植物体后,大多会积累在根的生长部位,主要破坏细胞核内染色体和核仁[10]。随着植株体内Zn2+含量的增加,对染色体和核仁的破坏加重,这是抑制根伸长的主要原因。
2.2 锌对滴水观音叶绿素含量的影响
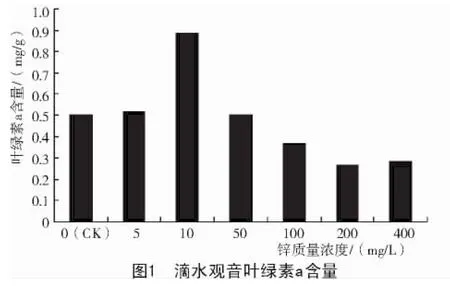
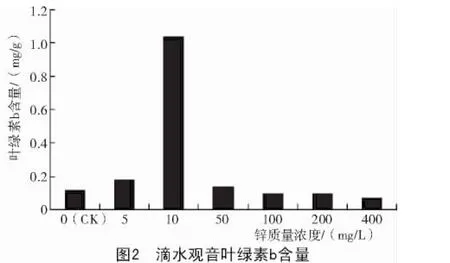
从图1、图2可以看出,Zn2+质量浓度对滴水观音叶片叶绿素含量影响较大。锌质量浓度在5~10 mg/L时,滴水观音叶绿素a、叶绿素b与对照相比均增加。但当锌质量浓度继续增加时,滴水观音叶绿素a、叶绿素b含量却快速下降。
2.3 锌对滴水观音丙二醛含量的影响
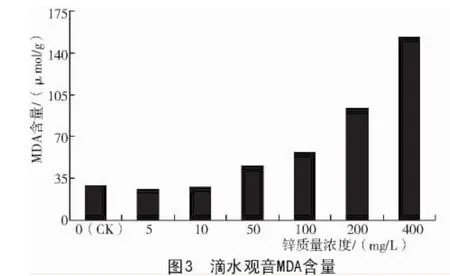
由图3可知,Zn2+质量浓度为5,10 mg/L时,滴水观音叶片丙二醛含量比对照略低,其含量分别为对照的91.54%,95.93%。但Zn2+质量浓度继续增加时,叶片丙二醛含量急剧增加,与对照相比,其含量分别增加了58.92%,97.60%,225.51%,430.97%。
2.4 锌对滴水观音超氧自由基含量的影响
从图4可以看出,Zn2+对滴水观音叶片中超氧自由基(O2-·)含量的影响比较明显。Zn2+质量浓度为 5,10 mg/L时,超氧自由基(O2-·)含量分别比对照增加70.31%,155.50%。Zn2+质量浓度为 50,100,200,400 mg/L 时,超氧自由基(O2-·)含量分别比对照增加669.88%,802.35%,968.87%,1008.75%。

3 结论与讨论
3.1 锌对滴水观音叶绿素含量的影响
植物的光合作用对于有机物合成、太阳能蓄积和环境保护等都有很大的作用[11]。光合色素在植物光合作用中起着决定性作用,其中叶绿素含量高低在很大程度上反映了植物的生长状况和叶片的光合能力,而且叶绿素含量与叶片光合速率密切相关[12-13]。本试验结果显示,低浓度Zn2+可促进滴水观音叶绿素的合成,提高植物的光合作用;高浓度Zn2+则起抑制作用。
严重玲等[14]认为,叶绿素含量的多少是衡量叶片衰老的重要指标。叶绿素a是反应中心复合体的主要组成成分,其中处于特殊状态反应中心的叶绿素a分子是执行能量转化的光合色素;而叶绿素b则是捕光色素蛋白复合体的重要组成部分,主要作用在于捕获和传递光能[14]。在本试验中,低质量浓度Zn2+使滴水观音叶片中叶绿素a和叶绿素b的含量有所增加,在Zn2+质量浓度为10 mg/L时达到一个最大值。当Zn2+质量浓度高于10 mg/L时,滴水观音叶片中叶绿素含量则迅速降低,这主要是因为Zn2+质量浓度增大,抑制了滴水观音叶绿素的合成。这与孙健等[15]用Cd,Pb,Cu,Zn,As等几种重金属处理玉米的结果一致。胡金朝等[16]研究也表明,重金属胁迫能显著降低植物叶绿素含量,并呈现出极显著的负相关性。有研究认为,重金属胁迫会引起细胞膜结构发生改变,叶绿体的完整结构遭到破坏,导致叶绿素含量减少[17];但也可能是金属离子的积累抑制了Chl酸酯还原酶和氨基-r-戊酮酸的合成,从而影响了Chl的生物合成[18];或是金属离子与这些酶的疏基结合[19],改变了酶的构象而使酶失活,继而导致Chl含量下降,使叶片捕光色素蛋白复合体合成受到很大的影响。
3.2 锌对滴水观音丙二醛含量的影响
植物体内的活性氧与细胞内的成分具有很强的反应能力,能够直接或间接启动膜脂过氧化作用。植物在逆境下遭受伤害与活性氧积累诱发的膜脂过氧化作用密切相关,丙二醛(MDA)是膜脂过氧化最重要的产物之一[20-21],因此,通过测定丙二醛的含量就可以了解膜脂过氧化的程度,可间接表示膜系统的受损程度及滴水观音的抗逆性。本试验中,Zn2+质量浓度为5,10 mg/L时,植株叶片MDA含量基本与对照持平,表明低质量浓度Zn2+对滴水观音叶片中MDA含量影响并不明显。Zn2+质量浓度高于50 mg/L时,滴水观音叶片中MDA含量与对照相比会迅速增加,表明高质量浓度Zn2+对滴水观音叶片活性氧积累及膜脂过氧化的加剧作用比低质量浓度Zn2+更为严重,这与王晶等[22]对番茄的研究结论相反。
3.3 锌对超氧自由基(O2-·)含量的影响
植物中超氧自由基含量过高,会破坏植物细胞膜的结构和功能。因此,植物中超氧自由基含量的高低能正确反应植物受氧化的强弱。本试验中,Zn2+对滴水观音组织具有强大的胁迫作用,它能干扰滴水观音细胞中活性氧产生与清除之间的平衡,导致细胞遭受氧化胁迫。在正常条件下,滴水观音细胞中产生的活性氧与其清除系统保持平衡,而当Zn2+胁迫作用于植株,产生的活性氧超出了活性氧清除系统的能力时,就会引起活性氧累积产生氧化伤害。其中,超氧自由基(O2-·)是活性氧的一种。Zn2+质量浓度的处理水平决定了反应的类型,低质量浓度时诱导防御基因表达,高浓度时则启动细胞死亡。同时,超氧自由基(O2-·)引发膜脂破坏产生的丙二醛(MDA),对膜和许多生物功能分子均有破坏作用,能破坏蛋白质和酶的结构,其含量可以表示过氧化程度和膜系统伤害程度,通常被作为逆境生理指标。本研究结果表明,随着Zn2+质量浓度的增加,Zn2+胁迫作用加剧,滴水观音体内产生较多的O2-·,其积累引发膜脂过氧化和膜伤害程度加剧,使MDA含量随之增大。
综上所述,Zn2+对植物的伤害机制是十分复杂的,Zn2+胁迫下滴水观音叶片中叶绿素、丙二醛、超氧自由基都受到不同程度的影响。低质量浓度Zn2+胁迫下,叶绿素含量有一定的增加,丙二醛含量基本与对照持平,超氧自由基含量有所增加,但变化不太明显。因而,低质量浓度Zn2+能促进滴水观音的光合作用,一定程度上促进滴水观音的生长。高质量浓度Zn2+则使植株叶绿素含量迅速降低,丙二醛含量迅速增加,超氧自由基含量继续增高且变化十分明显。这与大多数Zn2+质量浓度对植物胁迫试验结论基本相同。
[1]戴媛,谭晓荣,冷进松.超富集植物修复重金属污染的机制与影响因素[J].河南农业科学,2007(4):10-13.
[2]阳承胜,蓝崇钰,束文圣.重金属在宽叶香蒲人工湿地系统中的分布与积累[J].水处理技术,2002,28(2):101-104.
[3]Baldantoni D,Alfrani A,Tommasi P D,et al.Assessment of macro and microelement accumulation capability of two aquatic plants[J].Environ Pollution,2004,130:149-156.
[4]Panich-pat T,Pokethitiyook P,Kruatrachue M,et al.Removal of lead fromcontaminated soils byThypha angustifolia[J].Water Air Soil Pollut,2004,155:159-171.
[5]马文丽,王转花.铅胁迫对乌麦及普通小麦抗氧化酶的影响[J].山西农业科学,2004,32(2):8-12.
[6]林植芳,李双顺,林桂珠.水稻叶片衰老与SOD活性及膜脂过氧化的关系[J].植物学报,1984,26(6):605-615.
[7]赵世杰.植物生理学实验指导[M].北京:中国农业科技出版社,2002.
[8]周晓红,王国祥,冯冰冰.光照对菹草(Potamogeton cripus)幼苗生长发育和光合荧光特性的影响 [J].生态环境,2008,17(4):1342-1347.
[9]于方明,仇荣亮,汤叶涛,等.Cd对小白菜生长及氮素代谢的影响研究[J].环境科学,2008,29(2):506-511.
[10]何俊瑜,任艳芳,朱诚,等.镉胁迫对镉敏感水稻突变体活性氧代谢及抗氧化酶活性的影响 [J].生态环境,2008,17(3):1004-1008.
[11]罗广华,王爱国,邵从本,等.高浓度氧对种子萌发和幼苗生长的伤害[J].植物生理学报,1987,13(2):161-167.
[12]余叔文,汤章城.植物生理学与分子生物学[M].2版.北京:科学出版社,1998.
[13]李强.环境因子对沉水植物生长发育的影响机制[D].南京:南京师范大学,2007.
[14]严重玲,李瑞智,钟章成.模拟酸雨对绿豆、玉米生理生态特性的影响[J].应用生态学报,1995,6(增刊):124-131.
[15]孙健,铁柏清,钱湛,等.复合重金属胁迫对玉米和高粱成苗过程的影响[J].山地农业生物学报,2005,24(6):514-521.
[16]胡金朝,施国新,王学,等.Cd对槐叶苹的生理影响及外源La,Ca 的 缓 解 效 应 比 较 [J].广 西 植 物 ,2005,25(2):156-160.
[17]徐勤松,施国新,杜开和,等.Cd2+处理对菹草叶片保护酶活性和细胞超微结构的毒害影响 [J].水生生物学报,2003,27(6):584-589.
[18]Stobart AK,GriffthsWT,Ameen Bukhari I,et al.The effects of Cd2+on the biosynthesis of chlorophyll in leaves of barley[J].Physiologia Plantarum,1985,63:293-298.
[19]Somashekaraiah B V,Padmajaes K,Prasad A R K.Phytotoxieity of cadmiumions on germination seedlings of mung bean(Phaseolus vulgarize):Involvement of lipid peroxides in chlorophyll degradation[J].Physiologia Plantarum,1992,85:85-89.
[20]张玉霞,李志刚,张玉玲,等.缺磷胁迫对大豆膜脂过氧化及保护酶活性的影响 [J].土壤肥料科学,2004,20(4):196-208.
[21]张黛静,姜丽娜,邵云,等.铬胁迫下三种基因型小麦萌发和抗氧化酶差异的研究 [J].华北农学报,2009,24(6):69-73.
[22]王晶,韩晓日,战秀梅,等.低磷胁迫对番茄叶片膜脂过氧化及保护酶活性的影响[J].植物营养与肥料学报,2005,11(6):851-854.

