吉林地区奶牛乳房炎病原菌分离鉴定与药敏试验
尹柏双,王洪斌,高 利
(1.吉林农业科技学院动物医学学院,吉林吉林 132101;2.东北农业大学动物医学学院,黑龙江哈尔滨 150030)
奶牛乳房炎是奶牛最常见、防治最难的疾病之一。它导致奶牛的乳腺功能减退,乳汁分泌减少,奶质下降,严重者丧失泌乳功能,是引起奶牛淘汰的主要原因之一,给奶牛业造成了巨大的经济损失,也危害了人类健康。据统计,世界范围内奶牛乳房炎的发病率高达50%左右[1]。
虽然抗生素及磺胺类等药物在乳房炎治疗中取得了满意的效果,但由于各区域气候环境等因素的不同导致引起奶牛乳房炎的病原菌有所差异,以及长期使用抗生素产生的耐药性,给奶牛乳房炎的治疗带来困难。因此,及时准确地掌握引起区域内奶牛乳房炎病原菌的种类及耐药性情况是有效治疗该地区奶牛乳房炎的关键。
本试验调查了吉林地区部分奶牛场及散养户奶牛乳房炎的发病情况,对主要病原菌进行了分离鉴定和药物敏感性试验,为该地区奶牛乳房炎的防治提供科学、合理的依据。
1 材料与方法
1.1 试剂 培养基材料:营养肉汤、普通琼脂和高盐甘露醇琼脂均购自北京奥博星生物技术责任有限公司;麦康凯琼脂(含结晶紫)、伊红美蓝琼脂购自杭州天和微生物试剂有限公司;营养琼脂购自北京三药科技开发公司。微量发酵管和药敏纸片购自上海伊华医学科技有限公司。鱼腥草注射液(河南官渡兽药制造有限公司);链霉素、青霉素、红霉素、左氟沙星、氧氟沙星、克林霉素、环丙沙星等(吉林农业科技学院提供)。
1.2 乳样 乳房炎奶样160份,采自吉林周边地区奶牛场及部分散养户饲养的发生临床型乳房炎而未经抗生素药物治疗的病牛。
1.3 培养基的制备 普通琼脂培养基、兔鲜血琼脂培养基、伊红美蓝琼脂培养基、甘露醇高盐琼脂培养基、营养肉汤、麦康凯琼脂培养基、改良爱德华培养基等,按教材中方法配制。
1.4 乳样采集 采样前先用温水清洗采样乳头,再用75%酒精棉消毒乳头,在每次清洗或消毒乳头后均用消毒纸巾擦干。弃去采样奶牛的头3把奶,然后采集奶汁10~15 m L挤入已做好标记灭菌瓶中,4℃保存,24 h内进行培养鉴定。
1.5 细菌分离与培养 将奶样摇匀,无菌条件下分别接种于普通琼脂培养基和血液琼脂培养基,置于37℃恒温箱培养,观察菌落形态,涂片,染色后,镜检。根据菌体形态、溶血情况及染色特性初步判定细菌类属[2]。并将其进一步纯化培养,将符合链球菌形态特征的菌株接种于改良爱德华培养基;符合葡萄球菌形态特征的菌株接种于血琼脂平板;符合革兰阴性杆菌形态的菌株接种于麦康凯琼脂培养基。
1.6 生化鉴定 根据菌落形态和镜检结果,将杆菌接种至肉汤培养基培养24 h,分别进行吲哚、V-P、M.R.、硫化氢、枸橼酸盐、过氧化氢酶、糖发酵等试验鉴定[2]。球菌在普通营养琼脂和血液琼脂平板形成圆形、金黄色、灰白色或柠檬色菌落,且接触酶试验、凝固酶试验阳性的细菌,即鉴定为金黄色葡萄球菌;镜检形态符合链球菌特性,且接触酶试验阴性细菌,即鉴定为链球菌属细菌。若细菌CAMP试验阳性,不水解七叶苷和马尿酸钠,即鉴定为无乳链球菌;若细菌CAMP试验阴性,不水解七叶苷和马尿酸钠,即鉴定为停乳链球菌;若细菌CAMP试验阴性,水解七叶苷和马尿酸钠,即鉴定为乳房链球菌[3]。
1.7 药敏试验 采用药敏纸片琼脂扩散法[4],分别取经鉴定的各培养基上的菌落,作密集划线分别接种于相应培养基上,夹取抗菌药物纸片,分别贴于平板上,置37℃恒温培养24 h后取出,测量抑菌圈直径,根据抑菌圈的大小,判定药物的敏感性[5]。
2 结果与分析
2.1 细菌分离结果 从160份样品中分离出224株细菌,经分离培养、染色镜检、生化鉴定等试验,判定感染病原菌的类型。结果表明,金黄色葡萄球菌、无乳链球菌、停乳链球菌是引起本地区奶牛乳房炎的主要病原菌,占总发病率的82.70%。其他菌共计41株,占18.30%。在160份样品中只含1种优势菌的样品 173份,既单一菌感染的病例占77.23%;含2种及 2种以上菌种的样品51份,既混合感染的病例占22.77%。

表1 乳样中细菌检测结果
2.2 药敏试验结果 选用环丙沙星、克林霉素、氧氟沙星、青霉素、鱼腥草注射液等11种药物进行了药敏试验。结果表明,各种菌对同一药物的敏感性多不同,但同一种菌的不同菌株对药物的敏感程度相似,应用环丙沙星、左氟沙星、氧氟沙星、头孢曲松钠、庆大霉素和鱼腥草注射液引起该地区奶牛乳房炎的病原菌对其均有较好的抑制作用,该地区奶牛乳房炎的病原菌对青霉素、红霉素、克林霉素、链霉素等有广泛的耐药性(表2)。
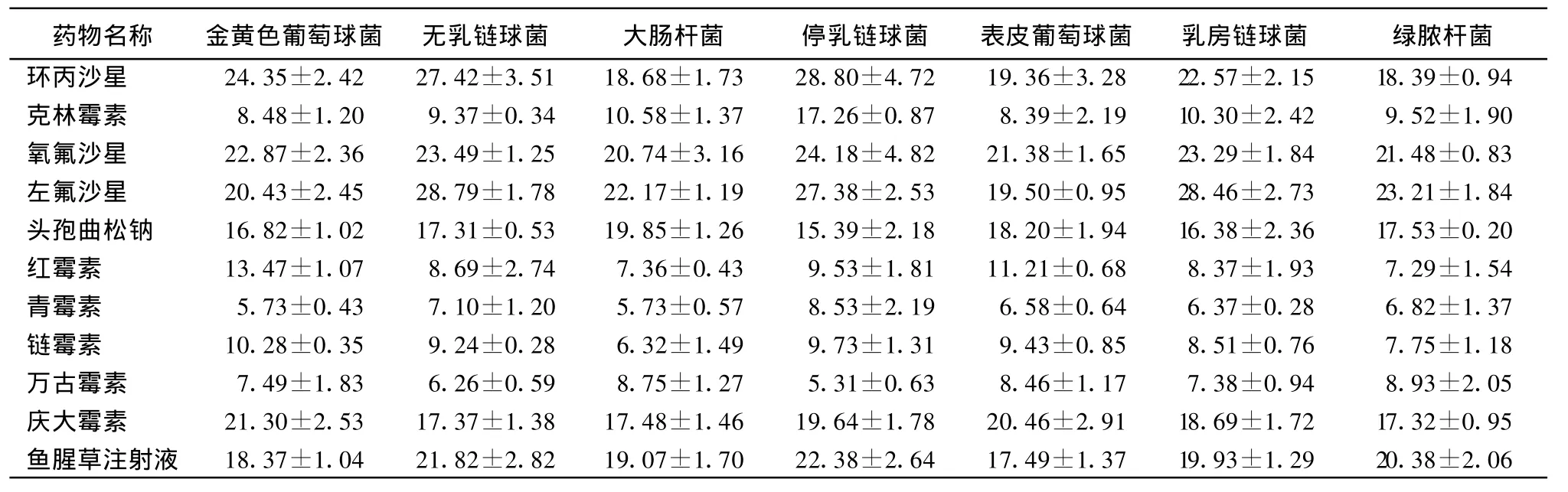
表2 11种药物对7种病原菌的平均抑菌直径(平均值±标准误)
3 讨论
奶牛乳房炎是危害奶牛养殖业最严重的疾病之一,奶牛乳房炎发病数量一直居高不下,产生的经济损失在所有奶牛疾病中居于首位。引起奶牛乳房炎的病原微生物种类繁多,有真菌、细菌、病毒等,但95%以上都是由细菌引起的[6],各地区地理环境及饲养因素的不同导致引起奶牛乳房炎病原菌的种类略有差异。该研究结果表明,导致该地区奶牛乳房炎的病原菌种类主要有表皮葡萄球菌、乳房链球菌、绿脓杆菌、大肠杆菌、停乳链球菌、无乳链球菌与金黄色葡萄球菌。引起致病菌感染病畜的原因主要有两方面:一方面,是由环境因素引起的,如病原菌通过牛体、泥土、粪便等传播感染牛只,通过该途径感染的病菌主要有表皮葡萄球菌、乳房链球菌、绿脓杆菌、大肠杆菌等;另一方面,是通过挤奶过程感染,如经擦洗乳房用的毛巾、水等接触传播,通过该途径感染的病菌多为传染性病原菌,如无乳链球菌与金黄色葡萄球菌。因此,保持牛舍内外清洁、牛体的卫生、避免挤奶过程中的交叉感染,是预防奶牛乳房炎的重要措施。
药敏试验结果表明,该地区奶牛乳房炎主要病原菌对青霉素、红霉素、克林霉素、链霉素等兽医临床常用抗生素产生了较强的耐药性。环丙沙星、左氟沙星、氧氟沙星、头孢曲松钠、庆大霉素和鱼腥草注射液对该地区奶牛乳房炎主要病原菌均有较好的抑制作用,可以选用这6种抗菌药物作为治疗本地区奶牛乳房炎的候选药物。不同地区奶牛乳房炎病原菌对抗生素的敏感性呈现较大差异[7]。纯中药制剂可以有效地治疗奶牛乳房炎,解决了抗生素累积的问题[8],因此,本次试验中选用了鱼腥草注射液作为本地区奶牛乳房炎治疗的药物,结果表明,鱼腥草注射液对这7种菌产生了很好的抑制作用,因此该药物可以作为本地区奶牛乳房炎治疗的首选药物。
[1] 周利青.奶牛乳房炎的研究进展[J].畜牧兽医科技信息,2005,5:8-9.
[2] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:132-134.
[3] 魏小娟,蒲万霞,周绪正,等.兰州地区奶牛乳房炎病原茵的分离鉴定及药敏试验[J].动物医学进展,2007,28(8):113-114.
[4] 陈坤永,翁良树,吴慕贞,等.深圳地区奶牛临床型乳房炎病原菌分离鉴定与药敏试验[J].中国兽医科技,1999,29(9):36-38.
[5] 邱立,张耀相,杨增岐.奶牛乳房炎病原菌的分离与鉴定[J].黑龙江畜牧兽医,2006(2):63-64.
[6] GILBERT FB,FROMAGEAU A,LAMOUREUX J,et a l.Evaluation of tandem repeats for MLVA typing of Strep tococcusuberis isolated from bovine mastitis[J].BMC Vet Res,2006,2:33.
[7] 王桂琴,吴聪明,宋丽华,等.奶牛乳房炎大肠杆菌的血清型及耐药调查研究[J].中国兽医杂志,2006,42(12):19-20.
[8] 代敏,王雄清,王红宁,等.绵阳市奶牛乳房炎病原菌的分离鉴定及耐药性分析[J].中国兽医杂志,2007,43(3):33-34.

