牛c-myc基因的克隆及其在皮肤成纤维细胞中的表达
肖佳佳,张凤凤,熊显荣,张涌
西北农林科技大学动物医学院,杨凌 712100
c-myc基因是细胞进化过程中高度保守的基因之一。c-myc基因最初是从鸡病毒v-myc基因的同源物中分离出来的,由3个外显子及2个内含子组成,第 1个外显子不编码,只起调节作用,只有外显子2和3与v-myc相对应。在不同动物中,c-myc基因的第 1外显子差异较大,其他则高度保守。c-myc基因编码的相关蛋白,是一个由439个氨基酸组成的蛋白质,分为C端 (C-terminal)、中间部分和N端 (N-terminal)。C端140个氨基酸是DNA结合和形成杂合体的结构域,包含碱性螺旋-环-螺旋以及亮氨酸拉链结构 (Basic helix-loop-leucine zipper,BHLH-LZ) 及与Max的结合区。N端143个氨基酸是转录激活功能域,包含2个myc家族特有的高保守序列。中间部分包含1个非特异性DNA结合区和1个核定位信号 (Nuclear localiaztino singal,NLS),前者的功能是协助碱性区寻找DNA特异结合位点;后者是 c-myc蛋白进入核内所必需的结构,负责将c-myc蛋白转入并定位于核内[1-3]。
2006年,Yamanaka等[4]首次开创性地利用反转录病毒分别将4个转录因子 (Oct-3/4、Sox2、KLF4和 c-Myc) 一起导入小鼠胚胎成纤维细胞和成体成纤维细胞,并都成功得到小鼠iPS细胞。2007年,Takahashi等[5]又用同样的转录因子组合导入成人的成纤维细胞,得到人的iPS细胞。这些细胞与ES细胞在形态、增殖、表面抗原、基因表达和体内外分化等方面基本一致。2008年,Dubois等[6]的研究证明,造血干细胞的功能特别依赖c-Myc因子。胚胎干细胞的自我更新能力有赖于白血病抑制因子 LIF的存在。LIF结合其相识受体后,活化转录因子STAT3,后者激活 c-myc的表达。STAT3或 c-myc突变体等位基因 (T58A) 的结构性表达,即使移除LIF,也能维持ES细胞的自我更新和多能性状态;反之,抑制c-myc即使存在LIF也诱发ES细胞分化,这证明c-myc对于抑制ES细胞分化并保持其自我更新的能力具有关键性作用[7]。这些研究表明,c-myc基因在诱导成体细胞转变为 iPS细胞,并抑制其分化,使其维持自我更新和多能性状态方面起着重要作用。
本研究拟从胎牛原始生殖嵴获得 c-myc基因,构建 c-myc基因真核表达质粒,并在脂质体介导下转染胎儿成纤维细胞,并观察记录其表达情况,为进一步诱导牛的iPS提供基础。
1 材料与方法
1.1 材料与试剂
40日龄的秦川牛胎儿由杨凌科元克隆股份有限公司提供。载体pIRES2-AcGFP1-Nuc、牛皮肤成纤维细胞,菌株 JM109均为本实验室保存。LA Taq酶、pMD19-T Vector、T4 DNA连接酶购自TaKaRa公司,DNA凝胶回收试剂盒购自AXGEN公司;各种限制性内切酶购自NEB公司;小量质粒提取试剂盒购自上海生工生物技术有限公司;无内毒素质粒大量提取试剂盒购自康为公司;多种 DNA marker购自Transgen公司。
细胞培养相关试剂:基本培养基 (DMEM)、胎牛血清、胰蛋白酶、L-谷氨酰胺、丙酮酸钠、非必需氨基酸、青霉素、链霉素均购自Gibico公司;Trizol试剂购自 Invitrogen公司;FuGENE HD转染试剂(Roche) 及其他试剂购自 Sigma等公司。引物由上海生工生物技术有限公司合成;基因测序工作由华大基因 (北京) 公司完成。
1.2 方法
1.2.1 牛c-myc基因的克隆
根据已发表牛c-myc基因mRNA序列 (GenBank Accession No. BC113343),设计合成1对引物,上游引物 Mycs:5′-TCGGCTAGC ATGCCCCTCAAC GTCAG-3′ (下划线处为NheⅠ酶切位点),下游引物Myca:5′-GCAGAATTC GGCGCAAGAGTTCCGTAT C-3′ (下划线处为EcoRⅠ酶切位点),由上海生工生物技术有限公司合成。
采集40日龄牛胎儿原始生殖嵴,用Trizol试剂从原始生殖细胞 (Primodial genital cells,PGC) 中提取总mRNA,经反转录得到cDNA,以Mycs和Myca为引物进行PCR反应。反应条件为:94 ℃预变性5 min;94 ℃变性45 s,60 ℃退火30 s,72 ℃延伸90 s,35个循环;72 ℃再延伸10 min。预期PCR产物长度应为1 335 bp。
1.2.2 pMD19-T载体克隆与测序
PCR产物经快速回收,回收产物 (目的片段)和pMD19-T载体在T4 DNA连接酶作用下于16 ℃连接。将连接产物转化感受态菌 JM109,菌液与IPTG和X-gal按比例混匀后涂布于含100 µg/mL氨苄青霉素的 LB平皿上筛选,挑取大小均匀的白斑摇菌,按照质粒抽提试剂盒说明书小量提取质粒,经EcoRⅠ与NheⅠ双酶切鉴定,将获得的阳性克隆质粒 (命名为 pMD19-T-c-myc,简写为 pTM) 送华大基因 (北京) 公司测序。用NCBI在线工具Blast对所克隆c-myc基因序列与GenBank中的序列进行同源性比较分析。
1.2.3 pRM的构建与鉴定

图1 pIRES2-AcGFP1-Nuc质粒结构示意图Fig. 1 Structure of the recombinant plasmid pIRES2-AcGFP1-Nuc.
将载体质粒pIRES2-AcGFP1-Nuc (图1) 和测序正确的质粒pTM用内切酶NheⅠ和EcoRⅠ双酶切,琼脂糖凝胶电泳,回收载体质粒 pIRES2-AcGFP1-Nuc和c-myc基因的DNA片段,T4 DNA连接酶连接过夜,连接产物转化大肠杆菌 JM109,经含卡那霉素 (60 µg/mL) 的LB平皿培养筛选克隆、提取质粒后,用NheⅠ和EcoRⅠ双酶切鉴定,再送华大基因 (北京) 公司测序。测序正确的菌株于37 ℃扩增摇菌 100 mL,提取重组表达载体阳性质粒(pIRES2-AcGFP1-Nuc-c-Myc,简写为 pRM),测定其核酸浓度,备用。
1.2.4 重组质粒pRM导入牛皮肤成纤维细胞
转染前2 d,将牛皮肤成纤维细胞接种至6 cm培养皿,培养液为含10%新生牛血清,不含青霉素、链霉素的高糖DMEM。当细胞汇片达80%~90%时,严格按照 FuGENE HD转染试剂说明书的方法将重组质粒pRM导入牛皮肤成纤维细胞。转染12 h后换为含 10%新生牛血清,青霉素、链霉素各100 U/mL的高糖DMEM。
1.2.5 RT-PCR检测牛c-myc基因表达
转染12 h后荧光显微镜观察上述转染的牛皮肤成纤维细胞,24 h后用Trizol试剂提取总RNA,再反转录成cDNA第一链,以此为模板,用下列引物进行PCR扩增:Forward (myc):5′-ATGCCCCTCAA CGTCAG-3′,Reverse (myc):5′-GGCGCAAGAGTTC CGTATC-3′。反应条件为:94 ℃预变性5 min;94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸90 s,30个循环;72 ℃延伸10 min。扩增产物经1%琼脂糖凝胶电泳,用凝胶成像系统观察结果。
1.2.6 Western blotting检测牛皮肤成纤维细胞c-myc蛋白表达
转染24 h后,用预冷的PBS洗涤2次,加入细胞裂解液 (150 mmol/L NaCl,10 mmol/L Tris-HCl (pH 7.4),5 mmol/L EDTA,1% Triton X-100,1 mmol/L PMSF),冰浴上裂解细胞 30 min,15 000 r/min 离心10 min,收获上清液。将上述细胞裂解后得到的上清加入 5× SDS-PAGE上样缓冲液,100 ℃煮沸10 min。13 000×g 离心10 min,取12 µL上清点样,12%聚丙烯酰胺凝胶电泳。以湿转印法将蛋白转到硝酸纤维素膜上,再加入用 TBST配制的5%脱脂奶粉,室温平稳摇动2 h。用TBST洗膜3次,每次10 min。加入一抗 (按1∶1 000比例用 TBST稀释,液体覆盖膜的全部),4 ℃放置12 h以上。弃一抗,用TBST洗膜10 min重复4次。加入辣根过氧化物酶偶联的二抗 (按 1∶2 000比例用TBST稀释),室温平稳摇动2 h。弃二抗,用TBST洗膜10 min重复4次。洗膜后用化学发光法显色5 min,保鲜膜包裹硝酸纤维素膜,固定在暗盒内,压X光胶片,曝光,显影,定影。用预染蛋白marker判定目的蛋白的相对分子质量。
2 结果
2.1 牛c-myc基因的克隆与测序
用40日龄牛胎儿PGC克隆牛c-myc基因编码序列,预期PCR产物长度应为1 335 bp。采用扩增复杂二级结构模板专用的LA Taq聚合酶进行PCR扩增,得到预期长度的扩增片段。所得扩增片段测序后,与已发表的牛 c-myc基因序列 (GenBank Accession No. BC113343) 进行同源性比较分析,核苷酸序列没有发生突变,证明所克隆片段为牛c-myc基因编码序列。
2.2 真核表达载体的构建
pTM和pIRES2-AcGFP1-Nuc 载体分别经过双酶切,胶回收,连接,转化JM109感受态细菌构建的重组质粒再经NheⅠ和EcoRⅠ双酶切和1%琼脂糖凝胶电泳,获得大小为1 329 bp的片段,与预期结果相符 (图2)。鉴定正确的质粒命名为pRM。
2.3 牛c-myc在皮肤成纤维细胞中的表达
重组质粒pRM转染12 h后,在荧光显微镜下观测 GFP的表达情况 (图 3)。结果表明质粒 pRM已转染到牛成纤维细胞内并表达。转染24 h后的细胞用Trizol试剂提取总RNA,再反转录成cDNA第一链,以此为模板用引物 Forward (myc) 和Reverse (myc) 扩增后,进行1%琼脂糖凝胶电泳,获得了大小为1 317 bp的目的条带 (图4),与预期结果相符。

图2 pRM质粒的酶切鉴定Fig. 2 Identification of pRM by enzyme digestion. M: trans15K DNA marker; 1: intact pRM; 2: pRM digested with Nhe I and EcoR I.
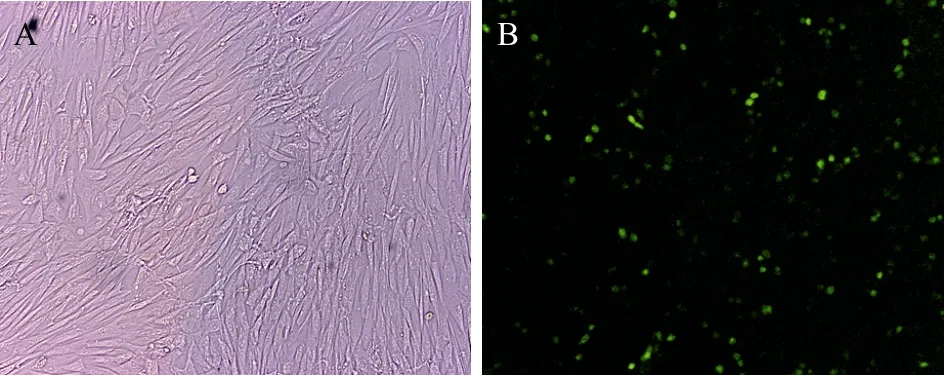
图3 重组质粒转染成纤维细胞Fig. 3 The fibroblasts transfected with pRM. (A) The cells transfected with pRM under microscope (100×). (B) The cells transfected with pRM under fluorescent microscope (100×).

图4 转染细胞中c-myc基因的表达检测Fig. 4 Expression detection of c-myc gene in pRM-transfected fibroblast cells. M: DL2000 DNA marker; 1: pRM-transfected fibroblast cells.
2.4 c-myc蛋白在成纤维细胞中的表达
将转染细胞和未转染的细胞用胰酶消化,预冷的PBS洗涤2次,加入细胞裂解液,冰浴上裂解细胞30 min,经离心收获上清,进行12%聚丙烯酰胺凝胶电泳后转膜,抗体孵育,曝光,显影,定影。结果如图 5所示:转染的成纤维细胞样品出现了约49 kDa的特异性条带,阴性对照组则未出现此反应条带,与预期结果相符。

图5 c-myc蛋白的Western blotting检测Fig. 5 Western blotting detection of c-Myc protein. M: prestained protein marker; 1: pRM-transfected fibroblast cells; 2: non-transfected fibroblast cells.
3 讨论
由于牛 c-myc基因编码序列 G、C含量达到59%,所以本研究采用了能够很好地扩增复杂二级结构模板的LA Taq聚合酶,并以胎牛原始生殖嵴为材料提取总RNA,再以反转录的cDNA为模板,进行PCR扩增,将得到的产物与已发表的牛c-myc基因序列 (GenBank Accesion No. BC113343) 进行同源性分析,结果显示得到的产物并未发生位点突变。本研究利用牛 c-myc基因的编码序列成功构建了重组真核表达载体pRM。该载体在转染牛皮肤成纤维细胞之后能正确表达c-Myc蛋白。
c-myc对细胞具有双重作用,既可刺激细胞增殖,也可促进细胞凋亡[8]。在细胞增殖的过程中,c-myc可使细胞由G0期进入G1期,从而由静止期向DNA的合成转变。c-myc也能促进细胞凋亡,其细胞凋亡作用依赖于 c-myc蛋白的表达水平[9]。本研究在操作过程中发现重组质粒 pRM 转染牛皮肤成纤维细胞48 h之后部分阳性细胞呈现凋亡趋势,可能是因为在其他因子不足的情况下c-myc的异常表达导致了皮肤成纤维细胞的衰老和凋亡。外源性c-myc转录因子与其他因子组合,可以将哺乳动物体细胞诱导为 iPS细胞,但到目前为止,将体细胞核重编程为iPS细胞的分子机理以及c-myc转录因子在此过程中起何具体作用仍不是很清楚。2007年,Yamanaka[10]提出了一个关于iPS细胞诱导过程中外源转录因子如何起作用的模型,他认为Oct4促使细胞向ES细胞方向发展,在Sox2的共同作用下,调控细胞一系列基因的表达,使细胞获得多能性状态,c-myc起到打开染色体结构,促进细胞增殖的作用,但同时c-myc还导致细胞的衰老和凋亡,而Klf4则阻断了细胞衰老和凋亡的过程。近年来,在 iPS细胞的研究过程中,人们曾尝试除了经典的四因子组合之外,用减少某些因子的方法,看能否诱导得到iPS细胞。Huangfu等[11]仅用Oct4、Sox2两个因子和一种组蛋白乙酰基转移酶抑制物——丙戊酸(Valproic acid,VPA) 成功得到iPS细胞。Kim等[12]用Oct4分别与Klf4或c-Myc组合,以二因子成功诱导小鼠神经干细胞转变为iPS细胞。Kim等[13]又尝试仅以 Oct4的外源性表达来诱导小鼠神经干细胞,成功得到 iPS细胞,值得注意的是:小鼠神经干细胞本身就高水平表达Klf4和c-Myc因子。虽然这些研究都成功得到 iPS细胞,但重编程的效率却随着转录因子数目的减少而降低。
总之,本研究成功地从胎牛原始生殖嵴中克隆出牛 c-myc基因编码序列,其核苷酸序列和对应的氨基酸序列与发表的牛 c-myc基因序列完全一致,为进一步研究 c-myc基因功能以及下一步特定因子诱导牛体细胞转变为牛iPS细胞的研究奠定了基础。
[1] Garte SJ. The c-myc oncogene in tumor progression. Crit Rev Oncogenesis, 1993, 4(4): 435−449.
[2] Lüscher B, Eisenman RN. New light on Myc and Myb Part I Myc. Genes Dev, 1990, 4: 2025−2035.
[3] Schwinkendorf D, Gallant P. The conserved Myc box 2 and Myc box 3 regions are important, but not essential for Myc function in vivo. Gene, 2009, 436(1/2): 90−100.
[4] Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 2006, 126(4): 663−676.
[5] Takahashi K, Tanabe K, Ohnuki M, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell, 2007, 131(5): 861−872.
[6] Dubois NC, Adolphe C, Ehninger A, et al. Placental rescue reveals a sole requirement for c-Myc in embryonic erythroblast survival and hematopoietic stem cell function. Development, 2008, 135: 2455−2465.
[7] Zhang QH, Xie FP, Zhang Z. Advance in studies of MYC. J Med Res, 2010, 39(2): 109−112.张庆华, 谢丰培, 张众. MYC的研究进展. 医学研究杂志, 2010, 39(2): 109−112.
[8] Pelengaris S, Khan M. The many faces of c-MYC. Arch Biochem Biophy, 2003, 416(2): 129−136.
[9] de Nigris F, Sica V, Hermann J, et al. c-myc oncoprotein: cell circle-related events and new therapeutic challenges in cancer and cardiovascular diseases. Cell Cycle, 2003, 2(4): 325−328.
[10] Yamanaka S. Strategies and new developments in the generation of patient-specific pluripotent stem cells. Cell Stem Cell, 2007, 1(1): 39−49.
[11] Huangfu D, Osafune K, Maehr R, et al. Induction of pluripotent stem cells from primary human fibroblasts with only Oct4 and Sox2. Nat Biotechnol, 2008, 26(11): 1269−1275.
[12] Kim JB, Zaehres H, Wu GM, et al. Pluripotent stem cells induced from adult neural stem cells by reprogramming with two factors. Nature, 2008, 454(7204): 646−650.
[13] Kim JB, Sebastiano V, Wu GM, et al. Oct4-induced pluripotency in adult neural stem cells. Cell, 2009, 136(3): 411−419.

