人类博卡病毒HBoV1基因组克隆及启动子活性分析
李京京,孙彬,欧阳锦凤,陈莹,韩虎,刘凯于,李毅
1 华中师范大学生命科学学院,武汉 430079
2 湖北师范学院生命科学学院,黄石 435002
呼吸道病毒是引发婴幼儿呼吸道疾病的主要病原体,目前仍有许多新病毒被不断发现。2005年,Allander等[1]采用随机 PCR扩增及生物信息学分析,从下呼吸道感染患儿标本中检测到一种新的病毒,命名为人博卡病毒 (Human bocavirus,HBoV)。随后,许多国家相继报道发现HBoV感染,且在患有肠胃炎的小儿粪便中也鉴定出人博卡病毒[2]。HBoV主要感染 2岁以下婴幼儿,临床症状主要表现为咳嗽、发热常伴有重症哮喘[3],伴随其他呼吸道病毒共感染[4-5]。基因组序列分析表明,该病毒与牛细小病毒 (BPV) 及犬微小病毒 (MVC) 在系统发育上接近,将其归属于细小病毒亚科博卡病毒属。最近,在胃肠道疾病患者的粪便中又发现了 3种不同基因型的人博卡病毒 HBoV2、HBoV3和HBoV4[6-8],证明博卡病毒不仅是小儿呼吸道感染的病原体,还会引发包括成人的病毒性肠胃炎疾病。
HBoV为单链、线状 DNA病毒,全长约5 200 nt,由位于基因组左端的唯一启动子启动基因转录[9],该特征与红细胞病毒属、貂阿留申病毒属的许多病毒相同,如人细小病毒B19基因组由唯一启动子 P6调控 12种转录子合成[10-12]。2个主要开放阅读框 (ORF) 分别编码非结构蛋白 NS1和衣壳蛋白VP1/VP2,一个次要ORF编码NP1,其功能未知。由于博卡病毒属其他2个成员基因组两端都具有ITR序列,该结构对病毒DNA复制起着重要作用[13],推测博卡病毒也具有ITR序列,但目前还未得到相关序列。Dijkman等首次报道,在HBoV1感染的假分层人气管上皮细胞中检测到 6个转录产物,且通过real-time PCR检测到病毒复制[9]。随后,Chen等报道了更完整的HBoV1转录图谱,转录子(Transcripts) 均由位于基因组左端的P3启动子启动转录,转录图谱特征与博卡病毒属其他 2位成员类似[14]。细小病毒的敏感宿主细胞范围相对狭窄,如B19只能在极少的几个细胞系中复制,且效力很低。目前还未有人博卡病毒感染性克隆及其敏感细胞系的报道,成为对该病毒感染机制研究的瓶颈。本实验从呼吸道疾病患儿痰液中鉴定出人博卡病毒,并构建了病毒基因组克隆 (缺少 ITR),基因序列分析表明为HBoV1型。构建了病毒启动子活性检测重组载体,转染多种哺乳动物细胞,实验证明HBoV1启动子在所试哺乳动物细胞中具有很高活性,为进一步研究 HBoV1的转录、翻译等分子机制提供重要平台。
1 材料与方法
1.1 菌株、质粒及细胞
大肠杆菌菌株DH10B、质粒pBluescript SKⅡ、pGL3-Basic、pEGFP-N1由本实验室保存;人胚肾上皮细胞293T/293GP2P6、人肺成纤维细胞WI-38AV、人肺癌细胞A-549、兔肾细胞RK13、猪鼻甲骨黏膜成纤维细胞PT、HeLa细胞由本实验室保存。
1.2 主要试剂
限制性内切酶 (EcoRⅠ、SalⅠ、XbaⅠ、HindⅢ、BglⅡ、NcoⅠ)、Taq DNA 聚合酶、T4 DNA聚合酶、DNA 连接酶均购自 TaKaRa公司;DNA片段胶回收试剂盒购自博大泰克公司;DNA marker、高纯度质粒小提中量试剂盒购自天根 (Tiangen) 生物技术公司;TA Cloning试剂盒、转染试剂Lipofectamine Reagent购自Invitrogen公司;荧光素酶检测试剂盒Luciferase Assay System购自Promega公司;QIAmp DNA Mini Kit购自Qiagen公司。DMEM购自Gibico公司;胎牛血清购自Hyclone公司。
1.3 样品处理及病毒DNA提取
本实验 941例痰液样品均采自湖北省妇幼保健院具有呼吸道感染症状的患儿。在痰样中加入 5倍体积的生理盐水,去除唾液,然后加入等体积化痰剂 (含0.1% DTT) 混匀,37 ℃水浴30 min后1 500 r/min离心10 min,取上清。取200 µL提取病毒DNA,剩余上清−70 ℃保存。QIAmp DNA Mini Kit提取病毒基因组DNA,操作按照说明书进行。
1.4 PCR检测
根据 GenBank上已公布的人博卡病毒基因组序列 DQ000496[1]设计引物 (Forward: 5′-TATCGT CTTGCACTGCTTCG-3′; Reverse: 5′-AGAGTAGGC GTGATCATGTAA-3′),以提取的痰样病毒DNA为模板,扩增保守区 NP1基因,引物合成由北京奥科生物公司完成。反应条件:94 ℃预变性3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min ,共35个循环;72 ℃延伸10 min。PCR产物经0.8%琼脂糖凝胶电泳检测。
1.5 HBoV1基因组克隆的构建
取一管已鉴定为HBoV阳性的痰样DNA为模板,根据 DQ000496基因组测序结果,结合pBluescript SKⅡ载体的酶切位点,对基因组分 3段扩增:a段 (1 408 bp)、b段 (2 893bp) 和c段(997 bp),引物见表1。利用琼脂糖凝胶DNA回收试剂盒回收3段PCR产物。先将a和c段与T载体连接,转化DH10B感受态细胞,挑取克隆并鉴定,b段PCR扩增产物通过HindⅢ和EcoRⅠ酶切位点插入pBluescript SKⅡ载体,再将a和c段分别通过SalⅠ/HindⅢ、EcoRⅠ/XbaⅠ酶切位点插入上述质粒中,构建HBoV1基因组克隆,酶切鉴定重组质粒。

表1 构建HBoV1基因组克隆所用引物Table 1 Primers used for construction of a full-length genome clone of HBoV1
1.6 HBoV1基因组测序及序列分析
将已连T载体的a、c段及插入pBluescript SKⅡ载体的 b段分别测序,测序工作由北京奥科生物公司完成,采用 Phrap拼接基因组测序片段。采用Sequin完成序列注释和测序提交文件的生成,测序后拼装的基因组命名为WHL-1。利用DNAStar软件对已测 HBoV1基因组序列和推导的氨基酸序列进行分析。
1.7 HBoV1启动子重组载体的构建
根据 GU139423序列设计启动子上下游引物,分别引入 BglⅡ、HindⅢ酶切位点:上游引物:5′-GAAGATCTGCCGGCAGACATATTC-3′,下游引物:5′-CCCAAGCTTAGTAGACTCACCACAAGCG T-3′。以 WHL-1质粒为模板进行 PCR扩增,反应条件:94 ℃预变性3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min ,共30个循环;72 ℃延伸10 min。PCR产物经0.8%琼脂糖凝胶电泳检测。利用琼脂糖凝胶DNA回收试剂盒回收 PCR产物。重组载体pGL3-Basic-pBoV的构建:分别用限制性内切酶BglⅡ和HindⅢ对回收片段和pGL3-Basic载体质粒进行双酶切,酶切回收产物16 ℃连接过夜,转化大肠杆菌DH10B感受态细胞,挑取阳性克隆摇菌,酶切鉴定后测序。重组载体pGL3-pBoV-EGFP的构建:以pEGFP-N1质粒为模板扩增EGFP基因片段,通过酶切连接将EGFP基因替换pGL3-Basic-pBoV载体上的荧光素酶基因 (luc+),酶切鉴定后测序。阳性对照重组载体 pGL3-Basic-pCMV的构建:以pEGFP-N1质粒为模板扩增 CMV启动子区,插入pGL3-Basic载体上的BglⅡ和HindⅢ酶切位点之间,酶切鉴定后测序。
1.8 HBoV1启动子活性检测
1.8.1 荧光显微镜检测GFP的表达
将试验细胞 (293T/293GP2P6、WI-38AV、A-549、RK13、PT、HeLa) 接种在24孔板中,37 ℃、5% CO2培养箱中过夜培养。在细胞长至 80%时,用PBS洗2遍细胞,加入无血清培养基,同时按1∶2 (µg∶µL)的比例将质粒pGL3-pBoV-EGFP与转染试剂Lipofectamine混合 (每孔加入1 µg质粒和2 µL转染试剂)。室温放置30 min后将混合物加入清洗过的细胞中,在37 ℃、5% CO2培养箱中培养4 h,用含 10%小牛血清的 DMEM 更换培养基继续培养,以pEGFP-N1质粒转染各种细胞为阳性对照。24 h后荧光显微镜观察。
1.8.2 荧光素酶报告基因活性测定
将试验细胞 (293T、WI-38AV、A-549、HeLa)按 1×104个细胞/孔的量接种在 96孔板中,质粒pGL3-Basic-pBoV转染细胞按照上述操作方法进行。以 pGL3-Basic-pCMV质粒转染各种细胞为阳性对照。培养24 h后吸弃细胞培养基,用PBS洗1次,加入裂解液20 µL/孔,室温摇动15 min。按照荧光素酶检测试剂盒 (Luciferase Assay System) 的操作说明书,每孔加入100 µL LAR反应液,混匀后加入96孔检测板,设定微孔板式发光仪 (Centro LB 960)延迟2 s,发光仪测读10 s,测读萤火虫荧光素酶发光值。转染试验重复3次,数据采用Origin6.0软件进行统计学分析。
2 结果与分析
2.1 HBoV1阳性样本的PCR检测
PCR扩增产物表现为单一特异条带,分子量约为600 bp,与预期结果相符 (图1)。PCR产物回收后连T载体测序,利用NCBI网站的Blast工具对测序结果进行比对分析表明为HBoV NP1基因,该基因在博卡病毒属中非常保守,成为博卡病毒鉴定常用目标基因。941例痰液样本检测到33例HBoV阳性扩增产物,阳性率为3.51% (33/941)。33例阳性患者临床诊断为肺炎或支气管肺炎,且大多为 1岁以下患儿 (24例),占整个患者阳性样的72.7%;为人类博卡病毒的易感人群。
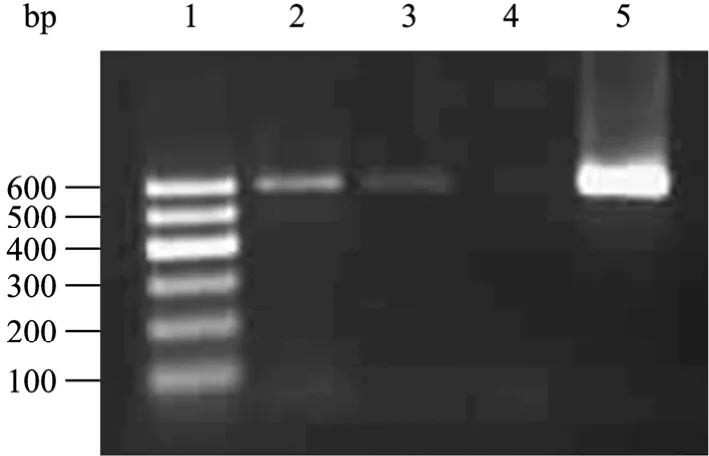
图1 HBoV1 NP基因的PCR产物鉴定Fig. 1 PCR products of HBoV1. 1: DNA marker I; 2,3,5: positive samples; 4: negative sample.
2.2 HBoV1基因组克隆的构建
以HBoV阳性样本DNA为模板,利用PCR方法分 3段扩增病毒基因组,通过琼脂糖凝胶电泳得到与预期扩增片段大小一致的3条产物:a段(1 408 bp)、b段 (2 893 bp) 和c段 (997 bp) (图2A)。按照方法 1.5构建病毒基因组克隆,双酶切鉴定如图2B所示:SalⅠ+XbaⅠ酶切下基因全长 (a+b+c);SalⅠ+HindⅢ酶切下a段;HindⅢ+EcoRⅠ酶切下b段;EcoRⅠ+XbaⅠ酶切下c段。初步验证成功构建了人博卡病毒基因组,命名为WHL-1。
2.3 HBoV1基因组测序及序列分析
对已鉴定的含有病毒基因组各个片段的质粒进行测序,测序结果拼接后最终获得HBoV基因组中间大片段序列,该序列全长5 299 bp,编码3个开放阅读框:NS1、NP1和VP1/VP2,GenBank登录号为GU139423,基因型为HBoV1型。该序列与已报道序列DQ000496氨基酸同源性达到99%,仅16个核苷酸发生变异,大多位于易突变的衣壳蛋白编码区,而NP1基因完全保守,其他细小病毒中并未发现与NP1同源的蛋白。NP1在MVC病毒DNA复制过程中发挥重要作用,缺失NP1基因的MVC可由HBoV1或 BPV1的 NP1基因回补,正常进行病毒DNA复制[15]。对病毒基因组启动子区分析显示,该启动子中心区域位于146~196 nt,距离NS1起始密码子仅91个核苷酸。该片段包含真核生物基因启动子的基本元件TATA盒、CAAT框以及转录起始基序 (图3),这些元件是否具备功能还需进一步验证。

图2 HBoV1基因组PCR分段扩增 (A) 及重组载体的酶切鉴定 (B)Fig. 2 PCR products of three segments (A) and recombinant plasmid identified by enzyme digestion (B). (A) 1: 1 kb DNA marker; 2−4: PCR product of fragments from a to c. (B) 1: 1 kb DNA marker; 2: pSK-a-b-c digested with Sal I and Xba I; 3: pSK-a-b-c digested with Sal I and Hind III; 4: pSK-a-b-c digested with Hind III and EcoR I; 5: pSK-a-b-c digested with EcoR I and Xba I; 6: pSK-a-b-c digested with EcoR I.

图3 HBoV1启动子序列Fig. 3 Nucleotide sequence of the HBoV1 promoter.
2.4 HBoV1启动子重组载体的构建
以WHL-1质粒为模板,PCR扩增HBoV1启动子序列 (1~252 nt),凝胶电泳检测大小正确(图4A2),PCR回收片段与pGL3-Basic载体连接,酶切鉴定,切下250 bp大小条带 (图4A3),与预期结果一致,成功构建了pGL3-Basic-pBoV重组载体。以pEGFP-N1质粒为模板扩增EGFP基因片段,大小为719 bp (图4B2),通过双酶切用EGFP基因替换已构建载体pGL3-Basic-pBoV的luc报告基因,酶切鉴定如图3B3。以pEGFP-N1质粒为模板扩增CMV启动子区,大小589 bp (图4C2),成功构建阳性对照重组载体pGL3-Basic-pCMV,酶切鉴定如图4C3。构建载体的测序工作由南京金斯瑞生物有限公司完成。
2.5 HBoV1启动子活性检测
重组质粒pGL3-pBoV-EGFP转染试验细胞24 h后,荧光显微镜观察细胞中 EGFP蛋白的表达 (图5),以pEGFP-N1载体转染各试验细胞为阳性对照。所有试验细胞均检测到绿色荧光,表明 HBoV1启动子在哺乳动物细胞中启动下游报告基因EGFP的转录、表达。pEGFP-N1是常用的带有EGFP标签的表达载体,在CMV的启动下,外源基因与EGFP融合表达,在荧光显微镜下可直接观察蛋白表达。各细胞试验组与对照细胞组相比,荧光强度相当甚至更强,显示 HBoV1启动子在哺乳动物中具有很强活性。293T、293G和PT细胞试验组中表达荧光蛋白的细胞明显多于 WI-38AV、A-549、RK13和HeLa细胞试验组,原因在于Lipofectamine Reagent介导下对各种细胞转染效率不同。同时,我们采用荧光素酶检测系统对启动子活性定量检测,以pGL3-Basic-pCMV转染各种试验细胞测得发光值为1,HBoV1启动子在4种细胞中荧光素酶活性相对值见图 6,说明启动子在不同细胞中活性都比CMV启动子强 (荧光素酶相对活性都大于 1)。在293T、HeLa、A-549和WI-38AV细胞中,HBoV1启动子活性分别是CMV的4.5倍、2.2倍、1.4倍和1.1倍。
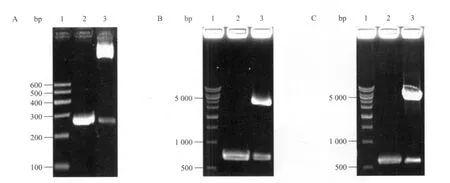
图4 启动子重组载体的构建Fig. 4 Construction of HBoV1 promoter vectors. (A) 1: DNA marker I; 2: PCR product of HBoV1 promoter; 3: pGL3-Basic-pBoV digested with Bgl II/Hind III. (B) 1: 1 kb DNA marker; 2: PCR product of EGFP; 3: pGL3-pBoV-EGFP digested with Nco I/Xba I. (C) 1: 1 kb DNA marker; 2: PCR product of CMV promoter. 3: pGL3-Basic-pCMV digested with Bgl II/Hind III.

图5 荧光显微镜检测HBoV1启动子下的EGFP在不同哺乳动物细胞中的表达Fig. 5 Detection the EGFP expression by HBoV1 promoter function in different cell lines with fluorescence microscope (bar=50 µm).
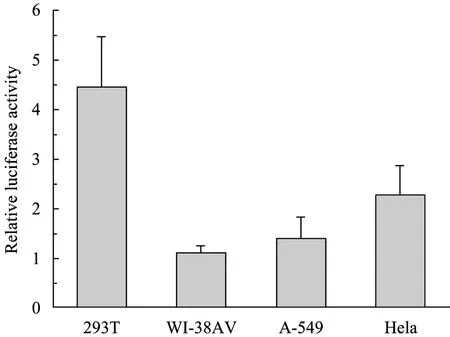
图6 HBoV1启动子在4种细胞中的活性比较Fig. 6 Comparison of the strengths of HBoV1 promoter in different cell lines. The values were calculated by dividing the amount of relative luciferase activity driven by HBoV1 promoter. The activity of the CMV promoter was set at 1 in all cell types. The error bars indicate standard deviations of 3 experiments and each performed in triplicate.
3 讨论
人博卡病毒是近年来新发现的感染人类的细小病毒,最初是在患有呼吸道疾病的小儿鼻咽抽吸物中筛选出该病毒,且在世界范围内都有发现该病毒感染。近两年又在患有胃肠道疾病患者排泄物中鉴定出不同基因型的 HBoV。在成人的呼吸道分泌物中偶尔也能检测到人博卡病毒[16]。本研究采集的标本来自患有呼吸道疾病的患儿,941例痰液样本检测到33例HBoV阳性扩增产物,其中1岁以下婴幼儿患者占阳性样72.7%,为人博卡病毒的易感人群,而有报道5岁儿童90%以上都具有人博卡病毒抗体[17]。
本实验构建了人博卡病毒基因组克隆,对其测序并与已报道的序列比对发现,该博卡病毒属于HBoV1型。与其他细小病毒类似,博卡病毒基因组两端具有ITR结构,但迄今为止还未能得到该序列,也未见有相关报道。我们已构建的病毒重组载体WHL-1也只包括中间5 299 nt的大片段,由于缺乏ITR结构,采用Southern blotting方法,在转染WHL-1的293T细胞中并未检测到病毒DNA复制 (结果未显示),进一步证明ITR结构对病毒复制是必需的。由于未分离得到HBoV病毒粒子,感染性克隆的构建又受阻于ITR结构,对人类博卡病毒的研究多局限于流行病学研究。获得感染性克隆是研究病毒感染的分子机制的突破口,我们正进行这方面的工作。
人类博卡病毒唯一启动子位于基因组左端,由于缺乏ITR结构,启动子区是否会受到影响而无活性,能否在哺乳动物细胞中行使功能。我们将基因组左端252个核苷酸克隆到pGL3-Basic上,分别转染人类、猪、兔代表细胞系,结果显示,在这几类哺乳动物细胞中,HBoV1启动子都具有活性,且在293T细胞中活性最强。首次证明HBoV1启动子在大多数哺乳动物细胞中具有较高活性,为深入研究博卡病毒转录和翻译机制提供了很好的平台。
[1] Allander T, Tammi MT, Eriksson M, et al. Cloning of a human parvovirus by molecular screening of respiratory tract samples. Proc Natl Acad Sci USA, 2005, 102(36):12891−12896.
[2] Vicente D, Cilla G, Montes M, et al. Human bocavirus, a respiratory and enteric virus. Emerg Infect Dis, 2007, 13(4): 636−637.
[3] Allander T, Jartti T, Gupta S, et al. Human bocavirus and acute wheezing in children. Clin Infect Dis, 2007, 44(7): 904−910.
[4] Kesebir D, Vazquez M, Weibel C, et al. Human bocavirus infection in young children in the United States: molecular epidemiological profle and clinical characteristics of a newly emerging respiratory virus. J Infect Dis, 2006, 194(9):1276−1282.
[5] Manning A, Russell V, Eastick K, et al. Epidemiological profle and clinical associations of human bocavirus and other human parvoviruses. J Infect Dis, 2006, 194(9): 1283−1290.
[6] Kapoor A, Slikas E, Simmonds P, et al. A newly identifed bocavirus species in human stool. J Infect Dis, 2009, 199(2): 196−200.
[7] Arthur JL, Higgins GD, Davidson GP, et al. A novel bocavirus associated with acute gastroenteritis in Australian children. PLoS Pathog, 2009, 5(4): e1000391.
[8] Kapoor A, Simmonds P, Slikas E, et al. Human bocaviruses are highly diverse, dispersed, recombination prone, and prevalent in enteric infections. J Infect Dis, 2010, 201(11): 1633−1643.
[9] Dijkman R, Koekkoek SM, Molenkamp R, et al. Human bocavirus can be cultured in differentiated human airway epithelial cells. J Virol, 2009, 83(15): 7739−7748.
[10] Ozawa K, Ayub J, Hao YS, et al. Novel transcription map for the B19 (human) pathogenic parvovirus. J Virol, 1987, 61(8): 2395−2406.
[11] Liu ZW, Qiu JM, Cheng F, et al. Comparison of the transcription profile of simian parvovirus with that of the human erythrovirus B19 reveals a number of unique features. J Virol, 2004, 78(23): 12929−12939.
[12] Qiu JM, Cheng F, Burger LR, et al. The transcription profile of aleutian mink disease virus (AMDV) in CRFK cells is generated by alternative processing of pre-mRNAs produced from a single promoter. J Virol, 2006, 80(2): 654−662.
[13] Burnett E, Cotmore SF, Tattersall P, et al. Segregation of a single outboard left-end origin is essential for the viability of parvovirus minute virus of mice. J Virol, 2006, 80(21): 10879−10883.
[14] Chen AY, Cheng F, Lou S, et al. Characterization of the gene expression profile of human bocavirus. Virology, 2010, 403(2):145−154.
[15] Sun YN, Chen AY, Cheng F, et al. Molecular characterization of infectious clones of the minute virus of canines reveals unique features of bocaviruses. J Virol, 2009, 83(8): 3956−3967.
[16] Longtin J, Bastien M, Gilca R, et al. Human bocavirus infections in hospitalized children and adults. Emerg Infect Dis, 2008, 14(2): 217−221.
[17] Endo R, Ishiguro N, Kikuta H, et al. Seroepidemiology of human bocavirus in Hokkaido prefecture, Japan J Clin Microbiol, 2007, 45(10): 3218−3232.

