抗菌肽SMAP-29结构功能及分子设计策略
陈琛,吴三桥,李新生,张小莺,闫茂仓
1 陕西理工学院 陕西省资源生物重点实验室,汉中 723000
2 西北农林科技大学动物医学院,杨凌 712100
3 浙江省海洋水产养殖研究所,温州 325005
植物、动物等生物体生长在充满各种微生物的环境中,随时面临环境中病原微生物的挑战,抗菌肽(Antibacterial peptide,ABP) 是生物机体在抵御病原性微生物时产生的一类防御性小肽,是生物免疫防御系统的重要组成部分[1-3]。自从Boman首次从昆虫中发现第一个抗菌肽天蚕素 (Cecropin) 以来,目前已经从昆虫、哺乳动物、两栖动物、植物、细菌、海洋生物等中发现的抗菌肽大约有1 598种[4-6]。绵羊骨髓细胞抗菌肽SMAP-29 (Sheep myeloid antibacterial peptides with 29 amino acids),是由意大利Bagella和美国 Mahoney两个不同的研究小组于 1995年同时发现[7-8],是从绵羊Cathelicidins前体蛋白的C端截取的含29个氨基酸残基的Cathelicidin类抗菌肽,分子量为3.2 kDa。Mahoney等[8]首先化学合成并且检测了它的生物活性。SMAP-29具有很强的抗细菌,抗真菌,抗衣原体、螺旋体,抗病毒,抗内毒素活性,是一种非常有开发应用潜力的抗感染肽[9-10]。
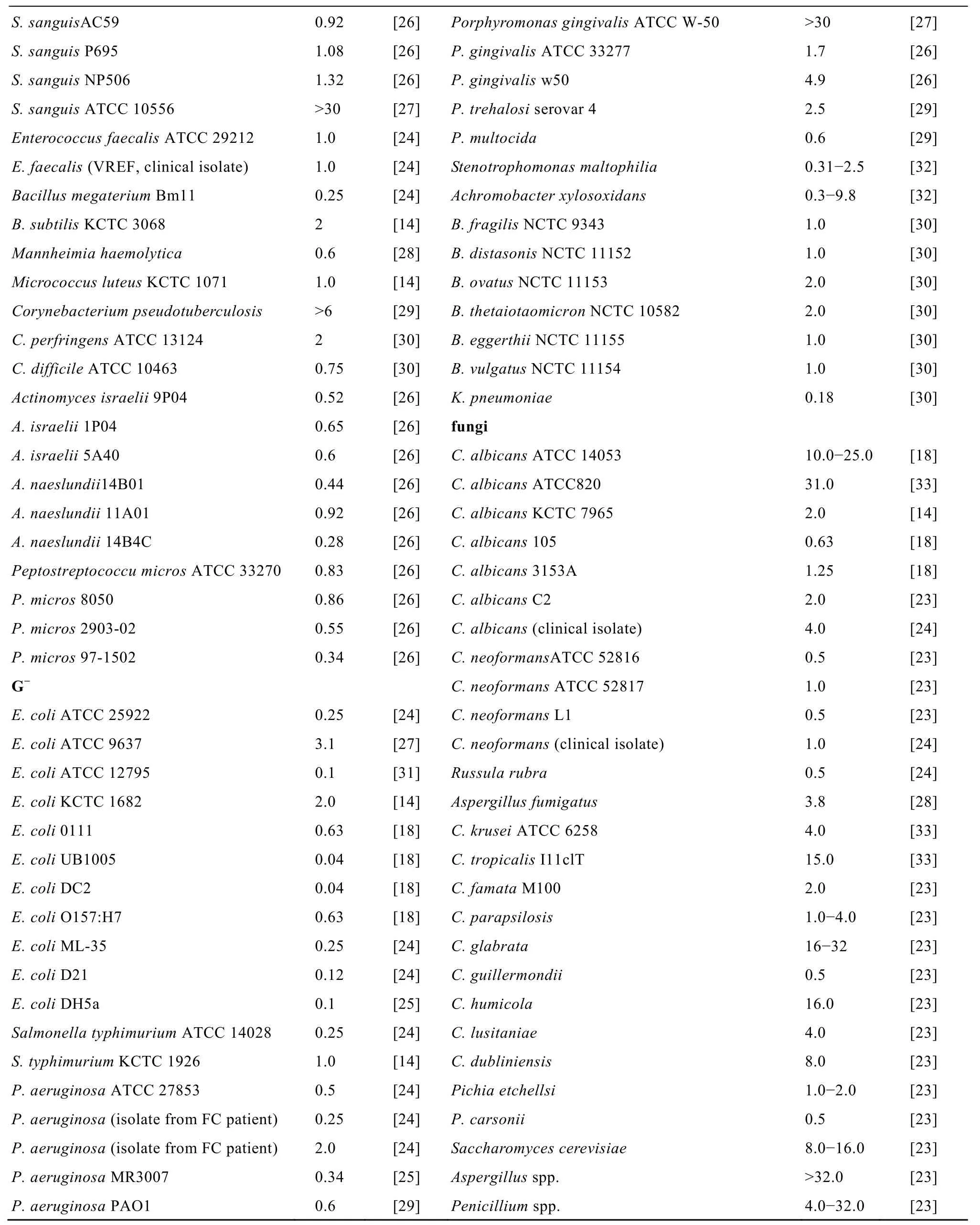
研究者基于SMAP-29的氨基酸序列和结构设计了许多新的类SMAP-29抗菌肽,如Ovispirin-1、Novispirin G-10、Novispirin T-7和Novicidin等,目前SMAP-29抗菌肽家族共有30个成员。近年来出现了大量SMAP-29及SMAP-29家族抗菌肽的研究报道,且呈上升趋势。本文综述了 SMAP-29抗菌肽家族的基因和蛋白结构、作用机制、生物功能,重点阐述了 SMAP-29结构功能及分子设计的必要性和基于 SMAP-29一级、二级结构进行分子设计策略,为 SMAP-29药物设计和研究开发奠定了基础。
1 SMAP-29家族抗菌肽的结构及功能关系
1.1 SMAP-29家族抗菌肽结构
抗菌肽 SMAP-29基因结构:其前体是由567 bp组成的一条编码 160个氨基酸残基的Cathelicidins基因片段,具有4个外显子和3个内含子(图 2A)[11]。第1个外显子编码信号肽的 29个氨基酸残基和前导肽 (Pro) 的部分序列,外显子2、3编码Cathelin蛋白信息,外显子4编码Cathelin的剩余序列和SMAP-29的成熟肽。在信号肽和Pro之间有一个信号肽酶识别位点,可以被信号肽酶识别从而切除信号肽。Pro和SMAP-29成熟肽之间还有一个胰蛋白酶识别位点,在蛋白酶的作用下,Cathelicidins前体变为成熟肽,再释放到细胞外发挥生物学功能。另外,整个基因结构中有 EcoRⅠ、PstⅠB等多个酶切位点,显示了多种限制性片段多态性。
SMAP-29蛋白结构:SMAP-29一级结构包括29个氨基酸,分子量为3 256 Da,序列中富含精氨酸 (Arg)、甘氨酸 (Gly) 两种氨基酸残基,29个氨基酸中共有6个Arg和5个Gly。其余氨基酸残基分别为:亮氨酸、异亮氨酸、赖氨酸、缬氨酸、丙氨酸、脯氨酸和丝氨酸。经圆二光谱分析和X线晶体衍射实验证明,抗菌肽SMAP-29在水相中呈无规则卷曲状态,但在含有SDS的水溶液中以α-螺旋形式存在,α-螺旋的N端起抗菌作用。在类脂质环境中 8~17位氨基酸形成一个两亲性 α-螺旋结构,18~19位的脯氨酸呈中心铰链区、20~28位的氨基酸形成SMAP-29抗菌肽的疏水片段,起溶血作用[12]。SMAP-29净电荷为+10。
目前已知的 SMAP-29家族成员的氨基酸序列见表1。Ovispirin-1是从SMAP-29的N端截取的含有 18个氨基酸的 α-螺旋结构的抗菌肽。将Ovispirin-1中的第10 位的异亮氨酸 (Ile) 用甘氨酸替代后筛选了具有抗菌活性的 Novispirin G-10; Novispirin G-10的第7 位Ile被苏氨酸 (Thr) 替代后的抗菌肽命名为 Novispirin T-7;Novicidin是在Novispirin G-10的C端的Gly18→Phe。Sawai等[13]通过圆二光谱分析 (CD) 和核磁共振 (NMR) 研究表明Ovispirin-1、Novispirin G-10和Novispirin T-7在三氟乙醇 (TFE) 溶液中呈两亲性螺旋结构(见图2C)。Novicidin也是一个线性阳离子α-螺旋抗菌肽。
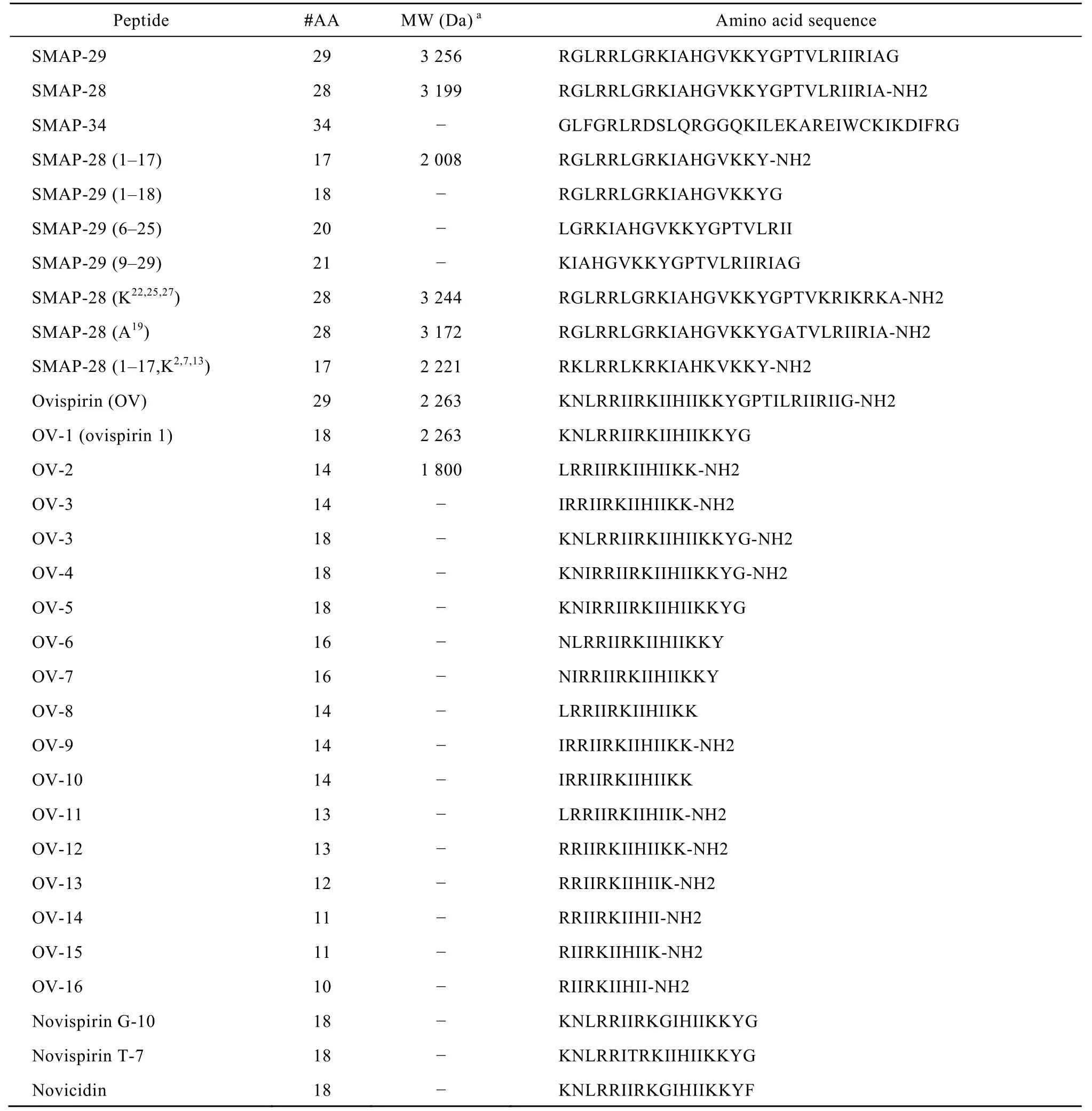
表1 SMAP-29家族抗菌肽的氨基酸序列Table 1 Amino acid sequences of SMAP-29 and variants
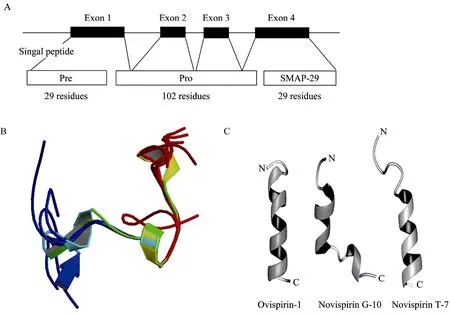
图1 SMAP-29和同系物的结构Fig. 1 Structure of SMAP-29 and variants. (A) Gene structrus of SMAP-29. (B) Structure of SMAP-29 in solution[12]. (C) Structures of the three peptides[13].
1.2 SMAP-29的结构功能关系
SMAP-29分子结构与功能之间的关系已经开展过很多研究,基于SMAP-29的基本结构,通过从末端去除氨基酸合成不同长度的类似物,以研究SMAP-29序列中起主要抗菌活性的氨基酸。Shin等[14]人工合成了几种SMAP-29类似物,并检测了它们的抗菌活性。与天然的SMAP-29相比,SMAP-29 (1-17) 和 22位、25位、27位赖氨酸 (K22,25,27) 替换了的 SMAP-29具有相对有效的抗菌活性 (MIC: 1.0~8.0 µmol/L),并且这2种类似物完全失去了溶血活性,而发生在 19 位 Ala替代 Pro的变化使SMAP-29的抗菌活性大大降低。说明 SMAP-29的N-端两亲性α-螺旋区与抗菌活性密切相关,C-端疏水区与溶血性有关,而位于中心的19位的Pro对增强抗菌活性有很重要的作用。特别是[K2,7,13]-SMAP-29(1-17) 在高盐环境下表现很高的抗菌活性,同时也失去了溶血活性。因此,这种短肽被认为是诱人的抗菌药物的候选者之一。SMAP-29是一个 α-螺旋弯曲或折叠延伸构型,在水相缓冲液中以无序的结构存在,而在类膜环境中高度螺旋。用全长的和截短了的SMAP-29分子实验揭示:全肽包含2个LPS结合区,N-端的LPS结合域 (RGLRRLGR)比 C-端的 LPS结合域的结合 LPS效力更高。LPS与截短了的混合肽的结合试验表明这种协同主要是发生于分子内 (如:含有N-和C-端LPS结合位点的同一种小肽分子)。推断有协同功能的多识别位点的出现使得SMAP-29可以和LPS高亲和性结合。
根据结构研究证明 α-螺旋结构对 SMAP-29的抗菌活性起到至关重要的作用。但是,这不是唯一的决定因素,可能与以下因素也有关:1) 抗菌活性与肽本身的净电荷有关;2) 抗菌活性与沿螺旋轴的疏水性程度有关;3) 抗菌活性与序列中阳离子氨基酸残基的百分比有关。
2 SMAP-29家族抗菌肽的作用机制
抗菌肽都是阳离子型的或两亲性的,这一特征决定了它们的抗菌作用模式,肽的阳离子部分与微生物膜的阴离子相互作用,并最终导致微生物膜的透化。抗菌肽与膜的作用方式主要有以下几种[15]:桶板模型 (Barrel-stave model)、环孔模型 (Toroidalpore model) 和地毯模型 (Carpet model) 等 (图2)。
SMAP-29是以穿孔方式作用于细胞的,但是以何种穿孔方式通过细胞膜尚无定论。在扫描电镜下SMAP-29可以迅速引起大肠杆菌和铜绿假单胞菌外膜表面发生结构变化,形成大量的水泡样物质。免疫电镜下 SMAP-29能在瞬间穿透大肠杆菌细胞膜进入细胞质。Lee等[16]对其类似物的作用机制的研究也证明了这一点。Orlov等认为SMAP-29可以穿透各种细胞膜,使细菌细胞内膜和外膜极化或去极化,迅速诱导革兰氏阳性和阴性菌中的大量钾离子外流[17]。Alessandra等用扫描电镜研究SMAP-29的杀菌机理,认为其主要机理是破坏细胞膜的结构,直接通过磷脂双分子层,形成能量和盐离子依赖性通道,致使离子和其他物质外流,最终达到杀菌的目的[18]。
Nielsen利用CD、石英晶体微天平 (QCM-D)、双偏振干涉测量 (DPI) 和荧光分析法研究了Novicidin的作用机制,结果表明 Novicidin是地毯模式整合到细胞膜上而起到杀死细菌的作用[19]。作用步骤是α-螺旋的Novicidin首先以“地毯”模式聚集在细胞膜上,聚集到一定数量后瞬间产生大的孔洞,然后更多抗菌肽分子的加入,环绕着菌体切断胞膜,使细菌从中部断开,使细胞胞内物质泄露而杀死细菌[20]。
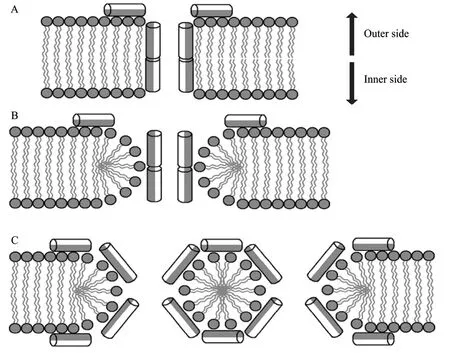
图2 抗菌肽的作用机制 (棒状代表抗菌肽,灰色疏水区,白色亲水区)[21]Fig. 2 Mechanism of action of antibacterial peptides[21]. The cylinders represent antimicrobial peptides, hydrophobic areas are gray, and hydrophilicareas are white. (A) Barrel-stave pore model. (B) Thoroidal pore model. (C) Carpet model.
3 SMAP-29家族抗菌肽生物功能
3.1 抗细菌活性
SMAP-29是一个广谱、具有潜在开发应用价值的抗菌肽,对多种G+、G−细菌,如金黄色葡萄球菌Staphyloccocus aureus、大肠杆菌Escherichia coli、绿脓杆菌Pseudomonas aeruginosa、肺炎克雷伯氏菌Klebsiella pneumoniae、 脆 弱 类 杆 菌 群 细 菌Bacteroides fragilis group、梭菌纲 (Clostridia) 中的产气荚膜梭菌 Clostridium perfringens、难辨梭菌Clostridium difficile等标准株和 100种临床分离的G+何G−均有很好的抑菌效果,SMAP-29最小抑菌浓度 (Minimum inhibitory concentration,MIC) 可达到0.09 µmol/L。对一些口腔疾病性细菌、肺炎疾病临床性分离菌都有较好的抗菌活性,各种细菌的抗菌谱具体见表2。
SMAP-29能快速杀死病原体,在 1~2 h内SMAP-29能完全的杀死病原体,而不是仅仅抑制细菌的生长。0.3~3 µmol/L浓度的SMAP-29在几分钟就能快速杀灭甲氧西林耐药金黄色葡萄球菌。为了证明其杀菌活性及机制,用透射电子显微镜和原子力显微镜研究表明抗菌肽可诱导 S. aureus细胞裂解,胞浆内容物外泄,菌体破裂导致死亡,能快速导致大量的细菌细胞超微结构发生损伤。SMAP-28也能快速有效杀灭细菌,测定细菌生长和存活率实验表明在4 mg/mL (1.2 mmol/L) 浓度下,在5 min内就能杀灭60%细菌数量,其家族的Ovispirin-1、Novispirin G-10、Novispirin T-7和Novicidin都具有较好的抗菌活性[22]。
3.2 抗真菌活性
真菌是具有真核和细胞壁的异养生物,它可引起动植物的多种病害,不仅影响农作物产量、动物生长,而且影响人体健康,威胁人类生命安全,抗真菌药物开发是真菌研究方面的一个重要课题。Benincasa等[23]系统研究了 SMAP-29、BMAP-27、BMAP-28、Protegrin-1 (PG-1) 和Indolicidin 5种抗菌肽对70多种临床分离株的抗真菌活性,均有一定的抗菌活性,MIC值在0.5~32 µmol/L之间。
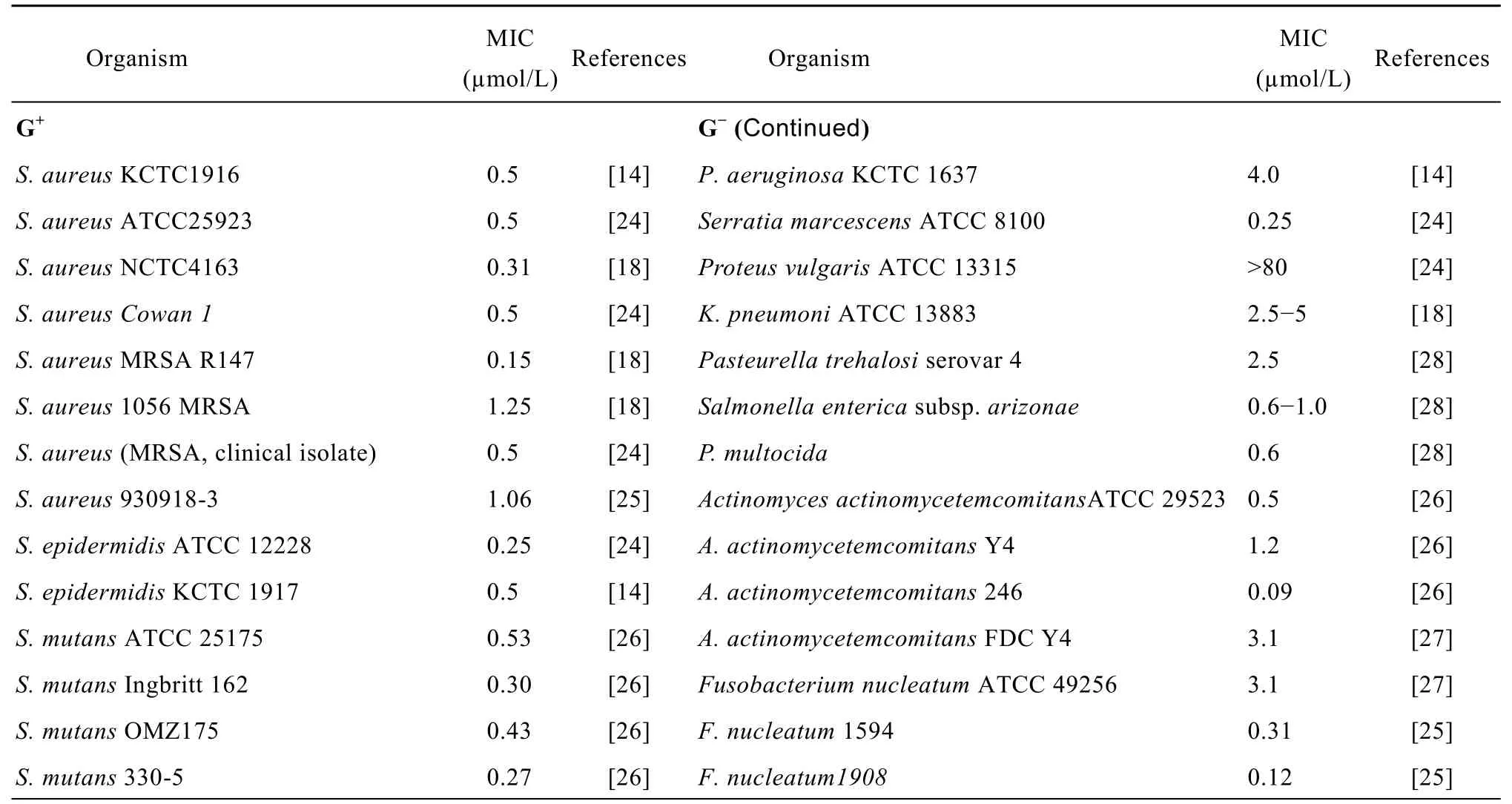
表2 SMAP-29的抗菌活性Table 2 Antimicrobial activity of SMAP-29
续表2
3.3 抗螺旋体、衣原体活性
Vittorio等发现SMAP-29对钩端螺旋体Leptospira interrogan和密螺旋体 Treponemainterrogan抗菌效果较强 (MIC分别为3.84 µmol/L和9.72 µmol/L),而对包柔螺旋体 Borrelia interrogan的 MIC为61.2 µmol/L[34]。Donati等比较了Bac7、SMAP-29、BMAP-27、BMAP-28、PG-1和 LL-37等 6种Cathelicidin家族抗菌肽的抗衣原体活性,结果显示SMAP-29抗沙眼衣原体 Chlamydia trachomatis和肺炎衣原体Chlamydia pneumoniae活性最强 (MIC仅为 3 µmol/L)[35],其余 5种抗菌肽 MIC浓度达25 µmol/L时也不表现抗衣原体活性。
3.4 抗内毒素活性
内毒素是G−细菌死亡时裂解出来的细胞壁脂多糖 (LPS) 成分。LPS的基本结构由O抗原、核心多糖和类脂A (lipid A) 三部分组成,其中类脂A是内毒素的生物学活性主要毒性成分。抗菌肽的多聚阳离子能与LPS上的阴性磷酸盐离子结合,从而竞争性地抑制脂多糖结合蛋白 (LBP) 与 LPS结合,导致游离LPS不能得以转运,使其刺激信号不能得以传递。抗菌肽还能抑制内毒素诱导的前炎症基因表达,阻止分泌型蛋白炎症介质,如抑制肿瘤坏死因子-α (TNF-α) 和内毒素诱导的核转位的核因子-κB (NF-κB) 亚单位的分泌,却产生和释放出多种趋化因子来维持其他前炎症应答,以达到选择性抑制前炎症应答作用,预防内毒素血症。
SAMP-29在多微生物引起的盲肠结扎败血症中,可减少炎性介质的产生和降低体内LPS的循环水平。Tack等研究表明SMAP-29具有2个LPS结合位点和 1 个铰链区[12]。Bartlett等[36]报道SMAP-29、Ovispirins和Novispirins具有LPS结合能力,体外测定了SAMP-29中和内毒素的能力,半数有效浓度 (Median effective concentration values,EC50) 为3.3 µmol/L。Giacometti等[37]以2种小鼠内毒素休克模型和 CD14+的小鼠巨噬细胞系 RAW 264.7研究了SMAP-29抗内毒机制,大鼠腹腔注射E. coli 0111:B4 LPS,然后分成实验组和对照组,给1 mg/kg 多粘菌素B (Polymyxin B)、0.9%氯化钠、1 mg/kg SMAP-29和20 mg/kg亚胺培南,测定血浆中的内毒素、TNF-α-浓度,结果显示SMAP-29能显著降低血浆中的内毒素和TNF-α浓度,SMAP-29与Polymyxin B无显著差异。由于SMAP-29具有双倍的抗内毒素的能力,所以有望开发为预防内毒素血症的药物。
SMAP-28可与 P. aeruginosa、Burkholderia cepacia和K. pneumoniae细菌分泌荚膜多糖相互作用。尽管SMAP-28具有一定的LPS结合能力,但是在SMAP-28≤20 µmol/L时不能抑制LPS诱导表达的 3个前炎因子基因 (白细胞介素-1B基因、CCL-2/MCP-1和CCL-3/MIP-1a)。
3.5 抗寄生虫活性
Giacometti等[38]研究了浓度为 100、10 µg/mL的4种抗菌肽 (SMAP-29、BMAP-28、PG-1和Bac7)与隐孢子虫 Cryptosporidium parvum孢子体和卵囊在37 ℃分别作用0、5、10、15、20、30、40、50、60、120和180 min,结果SMAP-29显示了最高的抗隐孢子虫孢子体活性,10 min后完全抑制了隐孢子虫孢子体活力。3 h后观察对卵囊的抑制,发现SMAP-29抑制率为40%,较其他3种抗菌肽的抑制率高。
3.6 抗囊性纤维化病病原体
囊性纤维化病 (Cystic fibrosis,CF) 是欧美高加索人种中最普遍的致死性遗传病。CF是由于氯离子通道蛋白基因的突变造成的,造成分泌黏液厚度增加,容易引起呼吸道的二次感染,这种感染是由几种细菌引起的,其中一种是铜绿假单胞菌,能够感染全部的 CF患者。Saiman等[32]研究了 5种cathelicidin抗菌肽 (LL37、CAP18、mCRAMP、rCRAMP和SMAP29) 和3种α-螺旋抗菌肽OV-1、OV-2和OV-3对从CF患者临床分离的39株多耐药病原体抗菌活性,SMAP-29对CF患者多耐药病原体的抗菌活性最好,MIC为0.06~8 µg/mL,而人源抗菌肽LL-37的MIC则是1.0~32 µg/mL。
4 SMAP-29的结构功能及分子设计
许多抗菌肽具有一定的细胞毒性、溶血性、生理条件下稳定性差和化学合成成本极高等缺点,制约了其开发和临床应用,到目前仅有极个别抗菌肽药物进入 III期临床试验。为此就要开展 SMAP-29结构功能及分子设计,这是SMAP-29走向临床研究开发的必经之路,也是未来SMAP-29类抗菌肽研究的发展方向。
4.1 开展SMAP-29分子设计的必要性
4.1.1 SMAP-29的高毒性和溶血性
许多抗菌肽具有较高的细胞毒性和溶血性,Cathelicidins类抗菌肽也毫不例外。SMAP-29的 N端疏水性氨基酸与双亲性的真核细胞外膜可通过疏水相互作用而结合。推测SMAP-29对真核细胞的溶解作用与其抗菌机制相似,都是通过SMAP-29在细胞表面发生去垢剂样作用而破坏细胞膜的完整性。SMAP-29对绵羊红细胞的溶血性较高,50 µmol/L时为7.9%。Xiao等研究表明SMAP-29对狗肾细胞(MDCK)具有细胞毒性[39]。
SMAP-28对人红细胞具有很高的溶血性,当肽浓度为4、20、100 µmol/L时溶解率分别达到4%、20%和61%~100%,但是对绵羊红细胞的溶解率相对较低,80 µmol/L时为3%。抗菌肽溶血活性可能出现在以下几种情况中:高疏水性的环境、极性角度相对狭窄和存在高度输水区。
4.1.2 协同效应
协同效应对临床药物开发非常重要。有极个别的研究证明几个抗菌肽和其他的抗菌肽具有一定的协同效应,但是关于SMAP-29的协调效应方面的研究较少,Saiman等[32]研究了 SMAP-29与传统抗生素联合使用没有明显的协同效应。牛明福等[40]报道有4个融合蛋白 (包括SMAP-29) 当在毕赤酵母中表达的时候表现出与链霉素和多粘菌素B有一定的协同效应。也有报道 SMAP-28和溶菌酶和牛Lactoferrin联合在抗大肠杆菌时具有协同效应,其他更多的关于 SMAP-29的协同效应的知识目前知之甚少。
4.1.3 稳定性
许多研究者[14,25,33,38]均发现抗菌肽在没有盐离子的情况下能快速杀灭病原微生物,但是在生理条件下或盐离子浓度存在的溶液中抗菌活性大大下降,甚至有一些抗菌肽,如α、β-defensins和OaBac5,盐离子浓度达到100 mmol/L时就会迅速失去作用效果。Shin等[14]研究表明SMAP-29在未加盐的环境中抗B. subtilis的MIC为2.0,若在0.1 mol/L NaCl存在的溶液中抗B. subtilis的MIC变为未加盐的 2倍。抗菌肽一级结构中由于含有多个碱性氨基酸残基 (如Lys、Arg) 而容易被胰蛋白酶水解。
4.1.4 SMAP-29化学合成成本
与传统抗生素相比多肽的化学成本昂贵,合成0.1 g SMAP-29纯品需要12 000~17 000元,高成本限制了多肽药物开发研究。氨基酸残基的多少决定着合成的难度和成本,氨基酸残基较少的短肽合成成本较低,经过分子设计截短的抗菌肽势必会降低生产成本。
4.2 SMAP-29结构功能及分子设计
抗菌肽分子设计是基于结构与功能关系,通过一系列生物信息学方法,实现对天然抗菌肽的定向改造或全新设计,获得更加符合人类需要的非天然序列,并阐明抗菌肽的活性机制,供进一步开发利用[41]。SMAP-29是α-螺旋结构的阳离子抗菌肽,在分子设计上要遵循以下几个基本原则:
1) 阳离子性。阳离子性决定其能否选择性地与带负电性的细菌细胞膜外表面相互吸引,而不与呈中性的真核生物细胞膜外表面产生相互作用,这也就是它们对哺乳动物细胞没有毒副作用的主要原因。
2) 两亲性。两亲性决定其能否有效插入细菌细胞膜内,形成疏水通道。
3) 结构简化原则。在保证抗菌活性前提下,应尽量简化抗菌肽的序列和结构,这样易于进行化学合成,也有助于阐明单一因素改变对活性的影响。
4.2.1 基于SMAP-29一级结构功能及分子设计
残基替换:就是替换天然序列中的一个或多个氨基酸残基,是结构功能研究最有效和常用的方法,在克服天然肽链的毒性问题上,往往起到理想的效果。对SMAP-29抗菌肽进行残基替换设计了一系列新的抗菌肽,如SMAP-29[A19]、SMAP-29[K22,25,27]、SMAP-29 [1−17,K2,7,13]和Novispirin G-10等。Shin等[14]将SMAP-29中的Pro19→Ala后发现活性降低,SMAP-29序列中Leu22,Ile25,Ile27→Lys(K) 替换,SMAP-29[1-17]中的3个氨基酸也被Lys替换,替换后产生的 SMAP-29[K22,25,27]和 SMAP-29[1−17,K2,7,13]对细胞的毒性降低,在100 µmol/L肽浓度条件下对人红细胞溶血性为 0%。替换后新肽SMAP-29[K22,25,27]的抗 C. albicans菌活性没有发生变化,但是抗M. luteus、S. aureus、S. epidermidis等的活性降低 2~4倍。Sawai等[13]在保留两亲螺旋结构的前提下进行单残基突变,用 Gly取代Ovispirin-1序列中第10 位的Ile,得到一个新的抗菌肽 Novispirin G-10,结果克服了对红细胞的溶血性,替换前35 µmol/L的Ovispirin-1对人和绵羊红细胞高达70%,而同样肽浓度的Novispirin G-10的溶血性为2.5%,降低了96.4%,并提高了抗菌活性。
截取天然抗菌肽的部分序列:将含29个氨基酸的SMAP-29截短,尝试筛选到抗菌活性更高,溶血性较低的短肽方面的做了大量的研究。得到的截短的SMAP-29抗菌肽22个 (表1),并对其性质进行了研究,这些截短肽中最有代表的是从SMAP-29的N 端截取的含有 18个氨基酸的 Ovispirin,但是Ovispirin的高溶血性决定其不能成为优秀的药物开发肽前体,所以产生了Ovispirin-1。
在基于 SMAP-29一级结构设计中往往将截取天然抗菌肽的部分序列法、残基替换和序列模板法等结合使用设计筛选新的抗菌肽,SMAP-29一级结构设计路线总结见图3。
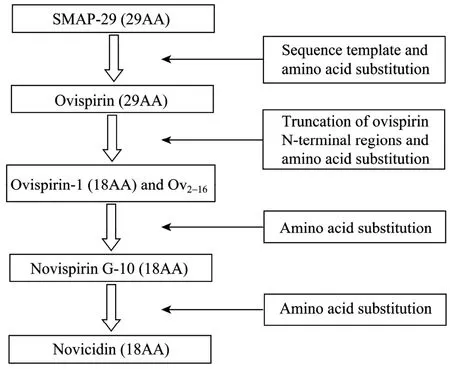
图3 SMAP-29一级结构设计路线[13,27,41-42]Fig. 3 General design route for SMAP-29[13,27,41-42].
4.2.2 基于SMAP-29二级结构功能及分子设计
SMAP-29二级结构是两亲线性α-螺旋结构,结构中任何改变都可能导致活性减弱或消失,但也可通过二级结构分子设计实现降低毒性的目的,二级结构设计考虑以下物理化学因素:大小、氨基酸序列、电荷、螺旋程度、疏水性、两亲性、亲疏水面的夹角。
大小:即肽链长度,肽链长度的改变影响了抗菌肽的疏水性、二级结构以及在水溶液和细胞膜上的状态,从而改变了抗菌肽对膜的结合能力。最早研究者认为要形成横跨膜的通道,最少应含 20个氨基酸残基,其后发现有些抗菌肽仅由 12个氨基酸残基组成。“毡毯”模型认为抗菌肽通过和膜结合后改变其稳定性从而引起细胞死亡,不必形成跨膜通道,这可以很好地解释短肽的抗菌机制。短肽有广谱抗菌性倾向,为了平衡电荷,长度可以适当加长,在10~30个氨基酸内效果也较为理想。经过分子设计后的 SMAP-29肽家族一般含十多个氨基酸。
氨基酸序列:天然抗菌肽具有不同的氨基酸序列,大约有50%的疏水性残基,由Pro或Gly残基形成“铰链”或“扭”。设计上序列安排主要参考天然两亲α-螺旋抗菌肽来进行,并考虑N端和C端残基的选择和修饰。Tossi研究团队[44]分析了许多天然两亲α-螺旋抗菌肽并得出一些共同的规律,前18个氨基酸序列模板见表3,Gly出现在序列第1位的肽序列大约占70%以上;Lys出现在第8位的肽序列大约占50%以上;SMAP-29通过肽模板序列分析了1~18位的氨基酸,得出其氨基酸模序位:第1位是Arg,2、13位Gly代替了疏水性残基,11位疏水性Ala代替了亲水性氨基酸。
电荷:阳离子抗菌肽的电荷影响其活性与选择性毒性,Weistroffer等[26]认为电荷对抗菌活性方面的影响比肽链长度和氨基酸序列更重要,增加阳离子电荷,能增强对G−菌的抗菌活性 (少数报道可增强抗G+菌的活性)。一般认为当阳离子抗菌肽的电荷小于+5时,抗菌活性随正电荷数增加而增加;当电荷大于+7时,增加正电荷对活性影响不大。考虑具有一定抗菌潜力和广度的要求,电荷控制在+3~+9内较为合适。
螺旋程度:稳定的α-螺旋形式有助于SMAP-29保持较好的抗菌活性。研究表明减少 α-螺旋抗菌肽关键位置上 (7、8、12和14) 的Pro,有降低α-螺旋的倾向,而且降低了抗菌活性。许多研究证明 α-螺旋程度对肽的细胞毒性 (中性膜) 比对抗菌活性(带负电荷的细胞膜) 的影响更大[45]。Zelezetsky等[44]通过测定在三氟乙醇水溶液中α-螺旋度,证明溶血性也与 α-螺旋的构象相关。尽管许多研究推测α-螺旋度与抗菌活性、溶血性、细胞毒性有关,但是目前尚未建立几者之间的相关参数。
疏水性:抗菌肽的总体疏水性是肽链序列中所有亲水基团和疏水基团共同作用的结果。疏水作用对其活性的影响可通过改变肽链中 Leu、Ile、Val数量进行。研究发现:增加分子的疏水性,抗菌肽的抗菌活性和细胞毒性 (包括溶血性) 同时增加[46]。这是由于疏水基团在抗菌肽插入细胞膜的过程中起关键作用。另外,由于疏水基团的存在,肽链在溶液中可以通过疏水作用形成多聚体,增加了对真核细胞膜的亲和力;同时也增加了抗菌肽形成两亲α-螺旋的能力,而α-螺旋的增加也提高了抗菌肽的稳定性。Boman[47]提出多肽侧链氨基酸的自由能量可以从环己烷转移到水中能预测多肽的副作用(细胞毒性),并建立了相关指数 (Boman指数),但是检测 SMAP-29和同系物后发现并不能建立较好的参数,相关度较差。
两亲性:两亲性决定其能否有效插入细菌细胞膜内,形成疏水通道,SMAP-29二级结构为两亲α-螺旋,即沿螺旋轴平行的两个侧面,残基排列呈“螺旋轮”(Helix wheel) 分布,一侧亲水残基集中,显亲水性;另外一侧疏水残基,显疏水性。这样,两亲性在螺旋的两个异极性侧面上形成了疏水力矩(Hydorphobic moment),并与α-螺旋在N端和C端形成的电荷偶极一起,对抗菌肽活性起关键作用,多肽疏水力距可通过Eisenberg方程式获得。通过大量研究发现抗菌肽的两亲性为 50%~60%时抗菌活性最好,但是Travis等[25]研究认为抗菌活性与疏水力矩成正比例。
亲疏水面的夹角:Tossi等[48]认为一般α-螺旋结构中亲疏水面角度为140°~180°时抗菌活性最好。夹角是140°时疏水部分对应SMAP-29序列中的8~17位氨基酸,包含大量疏水氨基酸。溶血性也与亲疏水面角度相关,理论上减小SMAP-29 α-螺旋上的亲疏水面夹角可以促进SMAP-29的治疗指数,实际中测定发现 EC50与 MIC值不同,EC50的降低往往是通过增加夹角角度实现。
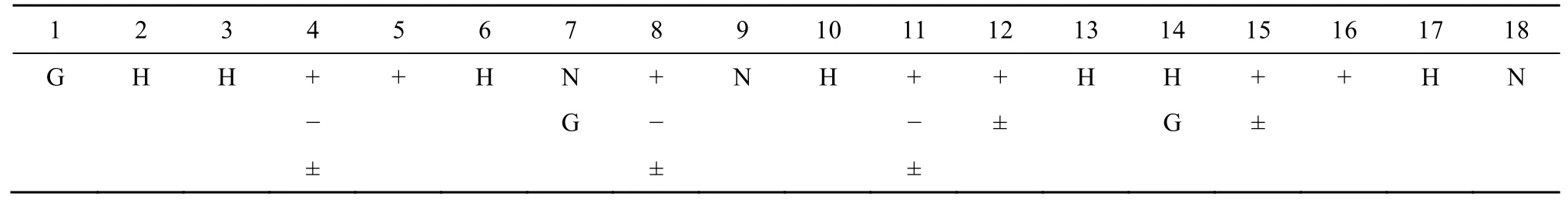
表3 天然来源的两亲性α-螺旋结构抗菌肽1~18个氨基酸的序列模板Table 3 Sequence template for amino acids 1−18 of natural amphipathic α-Helical antimicrobial peptides
5 SMAP-29基因重组表达及转基因
SMAP-29分子量小,直接从绵羊骨髓组织中提取纯化天然抗菌肽存在一定的困难,而且产量有限,所以化学合成和基因工程表达法是获得抗菌肽SMAP-29的主要手段。但化学合成抗菌肽成本高,而通过基因工程表达抗菌肽基因则由于抗菌肽分子小、易被蛋白酶降解、表达产物可能对宿主有害,从而影响了基因的高水平表达。Morassuttia等以内含子介导的方式在大肠杆菌中融合表达了SMAP-29,产物用亲和层析、高压液相色谱纯化,抗菌活性较化学合成的SMAP-29弱[49]。韩福郎选用大肠杆菌偏好密码子,设计合成了SMAP-29基因,并在大肠杆菌中成功表达了抗菌肽SMAP-29[50]。
牛明福等[40]为了得到高活性的抗菌肽,将4种抗菌肽 PG-1、蟹防御素 (SD)、碧蝽抗菌肽Metalnikowin-2A) 和 SMAP-29串联在毕赤酵母真核表达系统中成功分泌表达,抑菌试验表明串联的抗菌肽抑菌效果优于SD。任耀军等[51]也将SMAP-29在真核表达系统中进行了表达。Morassutti等将SMAP-29基因转到在烟草植物中[52]。
6 展望
SMAP-29家族抗菌肽具有广谱抗菌活性包括抗革兰氏阳/阴性菌、抗真菌、抗病毒、抗寄生虫、抗螺旋体、抗衣原体和中和抗内毒素活性,并且有作用机制独特、快速杀灭细菌的特点。抗菌肽以前的研究热点主要集中在从各种各样的生物或同一种生物不同器官中提取、鉴定新的天然抗菌肽,经过30多年的研究,天然中存在的抗菌肽已经基本发掘,笔者认为以后抗菌肽的研究热点将主要在抗菌肽开发应用方面,包括:从目前已经发现的天然抗菌肽库中进行结构设计和改造,尽量提高抗菌活性而降低细胞毒性;抗菌机制的深入研究;基因工程重组、高效表达及多肽药物的临床前试验研究。所以降低细胞毒性提高活性、稳定性仍然是SMAP-29家族抗菌肽研究中需要解决的重大问题。
[1] Zasloff M. Antimicrobial peptides of multicellular organisms. Nature, 2002, 415(6870): 389−395.
[2] Kindrachuk J, Napper S. Structure-activity relationships of multifunctional host defence peptides. Mini Rev Med Chem, 2010, 10(7): 596−614.
[3] Schlee M, harder J, köten B, et al. Antimicrobial peptides: ancient molecules as modern therapeutics? Expert Rev Dermatol, 2008, 3(1): 1−5.
[4] Guaní-Guerra E, Santos-Mendoza T, Lugo-Reyes SO, et al. Antimicrobial peptides:general overview and clinical implications in human health and disease. Clin Immunol, 2010, 135(1): 1−11.
[5] Boman HG, Nilsson I, Rasmuson B. Inducible antibacterial defence system in Drosophila. Nature, 1972, 237(5352): 232−235.
[6] Hultmark D, Steiner H, Rasmuson T, et al. Insect immunity. Purification and properties of three inducible bactericidal proteins from hemolymph of immunized pupae of Hyalophora cecropia. Eur J Biochem, 1980, 106(1): 7−16.
[7] Bagella L, Scocchi M, Zanetti M. cDNA sequences of three sheep myeloid cathelicidins. FEBS Lett, 1995, 376(3): 225−228.
[8] Mahoney MM, Lee AY, Brezinski-Caliguri DJ, et al. Molecular analysis of the sheep cathelin family reveals a novel antimicrobial peptide. FEBS Lett, 1995, 377(3): 519−522.
[9] Neville F, Ivankin A, Konovalov O, et al. A comparative study on the interactions of SMAP-29 with lipid monolayers. Biochim Biophys Acta, 2010, 1798(5): 851−860.
[10] Dawson RM, Liu CQ. Cathelicidin peptide SMAP-29: comprehensive review of its properties and potential as a novel class of antibiotics. Drug Dev Res, 2009, 70(7): 481−498.
[11] Huttner KM, Lambeth MR, Burkin HR, et al. Localization and genomic organization of sheep antimivrobial peptides genes. Gene, 1998, 206(1): 85−91.
[12] Tack BF, Sawai MV, Kearney WR, et al. SMAP-29 has two LPS-binding sites and a central hinge. Eur J Biochem, 2002, 269(4): 1181−1189.
[13] Sawai MV, Waring AJ, Kearney WR, et al. Impact of single-residue mutations on the structure and function of ovispirin/novispirin antimicrobial peptides. Protein Eng, 2002, 15(3): 225−232.
[14] Shin SY, Park EJ, Yang ST, et al. Structure-activity analysis of SMAP-29, a sheep leukocytes-derived antimicrobial peptide. Biochem Biophy Res Commun, 2001, 285(4): 1046−1051.
[15] Vad B, Thomsen LA, Bertelsen K, et al. Divorcing folding from function: how acylation affects the membraneperturbing properties of an antimicrobial peptide. Biochim Biophys Acta, 2010, 1804(4): 806−820.
[16] Lee DG, Pyoung IK, Park Y, et al. Antifungal mechanism of SMAP-29(1-18) isolated from sheep myeloid mRNA against Trichosporon beigelii. Biochem Biophys Res Commun, 2002, 295(3): 591−596.
[17] Orlov DS, Nguyen T, Lehrer RI, et al. Potassium release, a useful tool for studying antimicrobial peptides. J Microbiol Methods, 2002, 49(3): 325−328.
[18] Anderson RC, Hancock REW, Yu PL. Antimicrobial activity and bacterial-membrane interaction of ovinederived cathelicidins. Antimicrob Agents Chemother, 2004, 48(2): 673−676.
[19] Nielsen SB, Otzen DE. Impact of the antimicrobial peptide Novicidin on membrane structure and integrity. J Colloid Interface Sci, 2010, 345(2): 248−256.
[20] Khandelia H, Ipsen JH, Mouritsen OG. The impact of peptides on lipid membranes. Biochim Biophys Acta, 2008, 1778 (7/8): 1528−1536.
[21] Pálffy R, Gardlík R, Behuliak M, et al. On the physiology and pathophysiology of antimicrobial peptides. Mol Med, 2009, 15(1/2): 51−59.
[22] Kruse T, Christensen B, Raventós D,et al.Transcriptional profile of Escherichia coli in response to novispirin G10. Int J Pept Res Ther, 2009, 15(2): 97−105.
[23] Benincasa M, Scocchi M, Pacor S, et al. Fungicidal activity of five cathelicidin peptides against clinically isolated yeasts. J Antimicrob Chemother, 2006, 58(5): 950−959.
[24] Skerlavaj B, Benincasa M, Risso A, et al. SMAP-29: a potent antibacterial and antifungal peptide from sheep leukocytes. FEBS Lett, 1999, 463(1/2): 58−62.
[25] Travis SM, Anderson NN, Forsyth WR, et al. Bactericidal activity of mammalian cathelicidins-derived peptides. Infect Immun, 2000, 68(5): 2748−2755.
[26] Weistroffer PL, Joly S, Srikantha R, et al. SMAP29 congeners demonstrate activity against oral bacteria and reduced toxicity against oral keratinocytes. Oral Microbiol Immunol, 2008, 23(2): 89−95.
[27] Guthmiller JM, Vargas KG, Srikantha R, et al. Susceptibilities of oral bacteria and yeast to mammalian cathelicidins. Antimicrob Agents Chemother, 2001, 45(11): 3216−3219.
[28] Kalfa VC, Jia HP, Kunkle RA, et al. Congeners of SMAP29 kill ovine pathogens and induce ultrastructural damage in bacterial cells. Antimicrob Agents Chemother, 2001, 45(11): 3256−3261.
[29] Brogden KA, Kalfa VC, Ackerman MR, et al. The ovine cathelicidin SMAP29 kills ovine respiratory pathogens in vitro and in an ovine model of pulmonary infection. Antimicrob Agents Chemother, 2001, 45(1): 331−334.
[30] Arzese A, Skerlavaj B, Tomasinsig L, et al. Antimicrobial activity of SMAP-29 against the Bacteroides fragilis group and clostridia. J Antimicrob Chemother, 2003, 52(3): 375−381.
[31] Brogden KA, Nordholm G, Ackermann M. Antimicrobial activity of cathelicidins BMAP28, SMAP28, SMAP29, and PMAP23 against Pasteurella multocida is more broad-spectrum than host species specific. Vet Microbiol, 2007, 119(1): 76−81.
[32] Saiman L, Tabibi S, Starner TD, et al. Cathelicidin peptides inhibit multiply antibiotic-resistant pathogens from patients with cystic fibrosis. Antimicrob Agents Chemother, 2001, 45(10): 2838−2844.
[33] Guthmiller JM, Vargas KG, Srikantha R, et al. Susceptibilities of oral bacteria and yeast to mammalian cathelicidins. Antimicrob Agents Chemother, 2001, 45(11): 3216−3219.
[34] Sambri V, Marangoni A, Giacani L, et al. Comparative in vitro activity of five cathelicidin-derived synthetic peptides against Leptospira, Borrelia and Treponema pallidum. J Antimicrob Chemother, 2002, 50(6): 895−890.
[35] Donati M, Di Francesco A, Gennaro R, et al. Sensitivity of Chlamydia suis to cathelicidin peptides. Vet Microbiol, 2007, 123(1/3): 269−273.
[36] Bartlett KH, McCray PB Jr, Thorne PS. Reduction in the bactericidal activity of selected cathelicidin peptides by bovine calf serum or exogenous endotoxin. Int J Antimicrob Agents, 2004, 23(6): 606−612.
[37] Giacometti A, Cirioni O, Ghiselli R, et al. Cathelicidin peptide sheep myeloid antimicrobial peptide-29 prevents endotoxin-induced mortality in rat models of septic shock. Am J Respir Crit Care Med, 2004, 169(2): 187−194.
[38] Giacometti A, Cirioni O, Del Prete MS, et al. In vitro effect on Cryptosporidium parvum of short-term exposure to cathelicidin peptides. J Antimicrob Chemother, 2003, 51(4): 843−847.
[39] Xiao YJ, Cai YB, Bommineni YR, et al. Identification and functional characterization of three chicken cathelicidins with potent antimicrobial activity. J Biol Chem, 2006, 281(5): 2858−2867.
[40] Niu MF, Li X, Cao RB, et al. Secreted expression of the combinant antimicrobial peptide PL in Pichia pastoris and its antibacterial activity in vitro. Chin J Biotech, 2007, 23(3): 418−422.牛明福, 李翔, 曹瑞兵, 等. 复合抗菌肽PL在毕赤酵母中的分泌表达及其活性研究. 生物工程学报, 2007, 23(3): 418−422.
[41] Wang W, Wang LJ. Current status of molecular design of cationic antimicrobial peptides. Sci Technol Food Ind, 2010, 31(1): 442−445, 448.王威, 王联结. 阳离子抗菌肽分子设计的研究现状. 食品工业科技, 2010, 31(1): 442−445, 448.
[42] Steinstraesser L, Tack BF, Waring AJ, et al. Activity of novispirin G10 against Pseudomonas aeruginosa in vitro and in infected burns. Antimicrob Agents Chemother, 2002, 46(6): 1837−1844.
[43] Taboureau O, Olsen OH, Nielsen JD, et al. Design of novispirin antimicrobial peptides by quantitative structureactivity relationship. Chem Biol Drug Des, 2006, 68(1): 48−57.
[44] Zelezetsky I, Tossi A. Alpha-helical antimicrobial peptides−using a sequence template to guide structure−activity relationship studies. Biochim Biophys Acta, 2006, 1758(9): 1436−1449.
[45] Huang YB, Huang JF, Chen YX. Alpha-helical cationic antimicrobial peptides: relationships of structure and function. Protein Cell, 2010, 1(2): 143−152.
[46] Dawson RM, Liu CQ. Properties and applications of antimicrobial peptides in biodefense against biological warfare threat agents. Crit Rev Microbiol, 2008, 34(2): 89−107.
[47] Boman HG. Antibacterial peptides: basic facts and emerging concepts. J Intern Med, 2003, 254(3): 197−215. [48] Tossi A, Sandri L, Giangaspero A. Amphipathic, a-helical antimicrobial peptides. Biopolymers, 2000, 55(1): 4−30.
[49] Morassutti C, De Amicis F, Bandiera A, et al. Expression of SMAP-29 cathelicidin-like peptide in bacterial cells by intein-mediated system. Protein Expr Purif, 2005, 39(2): 160−168.
[50] Han FL. Design, Synthesis and expression of SMAP-29 gene and assay the antibacterial activity of SMAP-29[D]. Hunan: Nanhua University, 2006.韩福郎. 抗菌肽 SMAP-29基因的设计、合成、表达纯化及抗菌活性的检测[D]. 湖南: 南华大学, 2006.
[51] Ren YJ, Wang XH, Bo XW. The expression of sheep myeloid antibacterial peptides29 (SMAP-29) in Picha pastotis. J Shihezi Univ: Nat Sci, 2008, 26(6): 695−699.任耀军, 王新华, 薄新文. 抗菌肽SMAP-29在毕赤酵母中的表达. 石河子大学学报: 自然科学版, 2008, 26(6): 695−699.
[52] Morassutti C, De Amicis F, Skerlavaj B, et al. Production of a recombinant antimicrobial peptide in transgenic plants using a modified VMA intein expression system. FEBS Lett, 2002, 519(1/3): 141−146.

