利用Gateway技术构建重组腺病毒pAd-NK4
阙文忠,陈君敏
(福建医科大学附属第一医院血液风湿科,福建福州 350005)
肝细胞生长因子(hepatocyte growth factor,HGF)是一种多功能的蛋白,作用于肿瘤细胞表面的跨膜受体c-Met蛋白[1],从而引起肿瘤细胞的增殖、侵袭、黏附及促进新生血管的生成作用[2]。研究发现[3-6],在多种肿瘤组织和细胞中高表达c-Met蛋白。此外,在肿瘤病人的血清和骨髓中发现HGF浓度明显高于正常人,并且发现这与病人治疗效果及其预后呈负相关[7-8]。这些结果表明 HGF/c-Met通路在肿瘤的发生和发展中具有重要的作用。NK4是肝细胞生长因子(hepatocyte growth factor,HGF)α链的含447个氨基酸的片段,包括N末端的发夹结构和4个kringle结构,编码序列长度1 434 bp。研究表明NK4能和HGF竞争性结合c-Met蛋白,使后者无法发生磷酸化,从而抑制HGF所诱导的肿瘤生长、浸润及血管生成活性,是第一个能全面拮抗HGF活性的生物分子[9-10]。
由Invitrogen公司开发的Gateway技术是一种通用型克隆方法,其基于λ噬菌体位点特异性重组系统,利用位点特异重组构建入门载体[11-12],整个过程没有限制性内切酶和连接酶的参与。一旦拥有了一个入门克隆,就可以多次使用它,转移需要的目的基因到Gateway改造过的各种表达载体(目的载体)。这项强大的体外技术大大地简化了基因克隆和亚克隆的步骤,而同时典型的克隆效率高达95%或以上。当基因在目的表达载体之间快速简便的穿梭时,还可以保证正确的方向和阅读框,因而也不必再为新的表达克隆测序担心。这样就能高效、快速地将目的基因克隆到其它的受体载体或目的载体上。本研究采用gateway技术成功构建了NK4基因的重组腺病毒载体并制备重组腺病毒,为下一步在体内、外水平进行NK4基因功能的研究奠定了基础。
1 材料与方法
1.1 材料 含NK4基因的真核表达载体pBluescript II-SK(+)-HGF(Fig 1)和腺病毒穿梭载体pYr-adshuttle-6购自长沙赢润生物技术有限公司;腺病毒骨架载体pAd/BL-DEST、LR重组酶、DMEM培养液及新生牛血清购自Invitrogen公司。限制性内切酶和T4 DNA连接酶购自TaKaRa公司;CloneEZ试剂盒购自Genescript公司;质粒小量提取试剂盒、DNA凝胶回收试剂盒、dNTP、Taq酶及DNA Marker购自天根;酵母粉和胰蛋白胨购自Oxide公司;腺病毒包装细胞HEK293购自美国ATCC;其它化学试剂均为国产分析纯。
1.2 方法
1.2.1 pBluescript II-SK(+)-HGF质粒的鉴定为确保模板质粒 pBluescript II-SK(+)-HGF(含NK4基因)的正确性,将该质粒送到南京金斯瑞科技有限公司进行DNA测序,测序结果与NCBI公布的HGF(ORF)2187bp进行比对,检测模板质粒HGF基因的准确性。
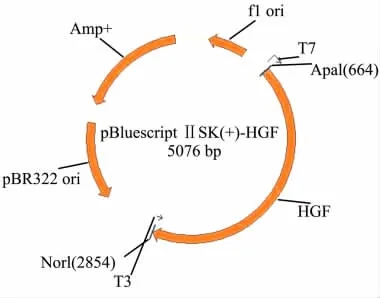
Fig 1 Plasmid map of pBluescriptⅡ-SK(+)-HGF
1.2.2 PCR引物的设计、合成及PCR扩增NK4基因 应用Primer 5.0软件设计引物,在上下游引物5'端分别引入用于定向克隆的限制性酶切位点NheI、SalI,同时在上游引物中添加kozak序列GCCACC,用以增强基因表达。以含有NK4基因的质粒pBluescript II-SK(+)-HGF为模板扩增目的基因,引物序列如下:hNK4-F:5'CTAGCTAGCGCCAC CATGTGGGTGAC3'(NheI);hNK4-R:5'ACGCGTCG ACTCAGACTATTGTAGGTGT3'(SalI)。以 质 粒pBluescript II-SK(+)-HGF为模板,反应条件为94℃ 2 min;94℃ 30 s,60℃ 40 s,72℃ 90 s,72℃ 10 min,共计30 cycle。然后将PCR产物进行琼脂糖凝胶电泳,在GIS凝胶系统中检测是否出现预期中的NK4基因带(1 434 bp)。
1.2.3 NK4基因克隆至腺病毒穿梭载体pYr-adshuttle-6 用NheI和SalI双酶切穿梭载体pYr-adshuttle-6和PCR获得的NK4目的片段,凝胶电泳回收目的片段,用T4 DNA连接酶连接过夜,反应产物转化感受态大肠杆菌DH5α。次日挑取卡那霉素选择性培养基筛选的阳性克隆进行菌落PCR鉴定,提取质粒进行PCR,NheI和SalI双酶切鉴定;同时送阳性菌落到南京金斯瑞科技有限公司测序。将正确克隆命名为pYr-adshuttle-6-NK4。
1.2.4 采用LR体外同源重组将NK4表达框克隆至腺病毒表达载体pAd/BL-DEST 在10 μl LR体外同源重组反应体系(含pYr-adshuttle-6-NK4、pAd/ BL-DEST和LR Clonase II)中,加入蛋白酶K消化LR ClonaseⅡ。将充分反应后得到的反应产物转化感受态细胞DH5а,涂布于含Ampr抗性(终浓度为100 mg·L-1)的LB平板上,37℃恒温箱培养过夜。接着再次从每个培养皿上随机挑取若干个单克隆菌落接种于50 ml含Ampr抗性(终浓度为100 mg· L-1)的LB培养液中,37℃恒温摇床(250 r·min-1)培养过夜。用中量提取试剂盒提取质粒,对提取的质粒进行PCR验证XbalⅠ酶切鉴定。并将同源重组后的质粒命名为pAd-NK4。
1.2.5 重组腺病毒rAd-NK4的包装 293A细胞的准备:转染前24 h将HEK293细胞悬液以1.5×106的细胞量接种在60 mm培养皿中,转染前1 h,换成无血清的DMEM培养基250 μl。
转染293A细胞包装病毒:用Lipo 2000脂质体介导,由Pac I单酶切线性化的目的片段转染293A细胞。当有明显的细胞病态反应(CPE)现象,且有>50%脱壁时即收细胞,加入500 μl无菌PBS缓冲液重悬,干冰浴和37℃间快速反复冻融3次裂解细胞,室温下1 000×g离心15 min,沉淀细胞碎屑。将上清液再次感染293A细胞扩增病毒,直到当细胞在1周内有明显的CPE现象,且有>50%脱壁时为止即收集细胞。同样用无菌PBS缓冲液重悬,干冰浴和37℃间快速反复冻融3次裂解细胞,室温下1 000×g离心15 min,收集上清液,0.22 μm微孔滤膜过滤除菌,-80℃保存。并进行PCR鉴定,包含NK4 DNA的重组腺病毒命名为rAd-NK4。
1.2.6 TCID 50(tissue cell infectious dosage 50,TCID 50)法测定重组腺病毒滴度 简略过程为:在两块96孔板中准备1×104细胞/孔,依次以10倍稀释病毒液,每个稀释度的病毒液加入每排10孔中,最后两孔为对照,在37℃孵箱中培养10 d,观察每孔细胞形态以及绿色荧光蛋白表达情况,并计算病毒滴度。
1.2.7 病毒感染HEK293细胞 HEK293细胞接种于12孔板,1×105细胞/孔。12 h后将培养液吸出,各孔分别加入MOI 100的rAd-NK4,常规培养48 h后,在倒置荧光显微镜下分别用可见光和荧光观察、成像。
1.2.8 Western blot检测转染后HEK293细胞中NK4的表达 rAd-NK4(MOI 100)转染HEK293细胞48 h后,将培养液弃掉,预冷PBS洗3次,加入RIPA裂解液及蛋白酶抑制剂PMSF,提取蛋白质,测定浓度,并分装。取40 g蛋白质,与2×SDS上样缓冲液1∶1混合,沸水煮5 min,样品以10%的SDSPAGE电泳。常规转膜;50 g·L-1脱脂奶粉封闭;山羊抗人HGFα(N-17)多克隆抗体(Santa Cruz公司)(50 g·L-1脱脂奶粉1∶500稀释)室温孵育2 h,TBST洗脱5 min×3次;兔抗山羊 HRP二抗(TBST 1∶2 000稀释)室温孵育2 h,TBST洗脱10 min×3次;ECL化学发光。
2 结果
2.1 pBluescriptⅡ-SK(+)-HGF质粒的鉴定经测序,模板质粒pBluescriptⅡ-SK(+)-HGF(Fig 1)的DNA序列分析结果与预期结果完全相符,与NCBI公布的HGF的ORF进行序列比对发现,正确性达100%。
2.2 PCR扩增NK4基因 将扩增的NK4基因片段进行琼脂糖凝胶电泳,在GIS凝胶系统中检测,出现NK4片段的条带(约1.45 kb),结果见Fig 2,PCR扩增出的片段大小与NK4片段的理论大小一致,胶回收约1.45 kb大小片段。
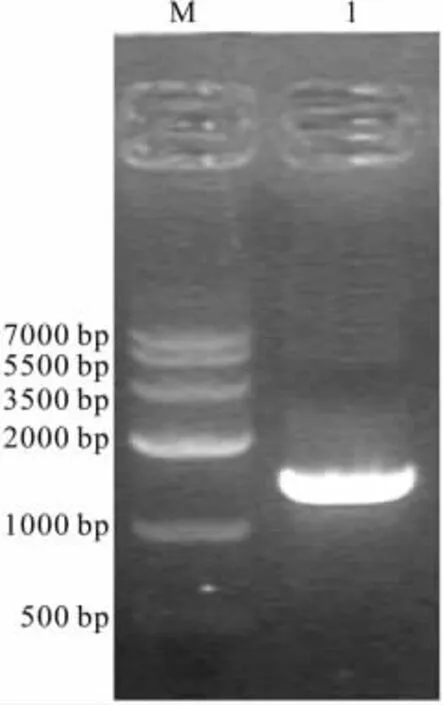
Fig 2 Analysis of PCR product of NK4 gene by agarose gel electrophoresis
2.3 pYr-adshuttle-6-NK4载体鉴定 将NK4片段亚克隆至pYr-adshuttle-6载体,阳性克隆经NheI和SalI双酶切鉴定,可切出约1.45 kb的片段带和约5.8 kb的载体带(Fig 3),初步推测NK4基因片段已经克隆到pYr-adshuttle-6载体。将阳性克隆送到南京金斯瑞公司测序,并将测序所得的序列和NK4基因片段序列进行比对,显示序列完全正确,证实pYr-adshuttle-6-NK4构建成功。
2.4 重组腺病毒载体pAd-NK4的鉴定 将NK4基因片段(NK4-IRES-EGFP)采用LR体外重组技术克隆至腺病毒表达载体pAd/BL-DEST,阳性克隆经XbalⅠ酶切鉴定,可切出约3.5 kb的小片段、约7.5 kb的片段以及大于15 kb的大片段(说明载体为腺病毒载体),初步推测NK4基因片段已经克隆到pAd/BL-DEST载体,阳性克隆命名为pAd-NK4(Fig 4)。接着我们以质粒pAd-NK4为模板,设计引物扩增NK4片段(约500 bp),将扩增产物进行琼脂糖凝胶电泳,在GIS凝胶系统中检测,结果见Fig 5,PCR扩增出的片段大小与设计的NK4片段大小一致,证实pAd-NK4载体构建成功。
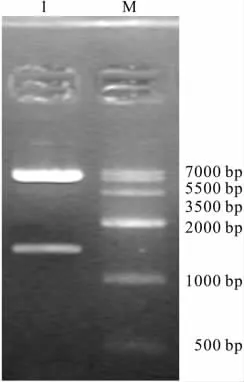
Fig 3 Analysis of restriction enzyme digestion of pYr-adshuttle 6-NK4 by agarose gel electrophoresis
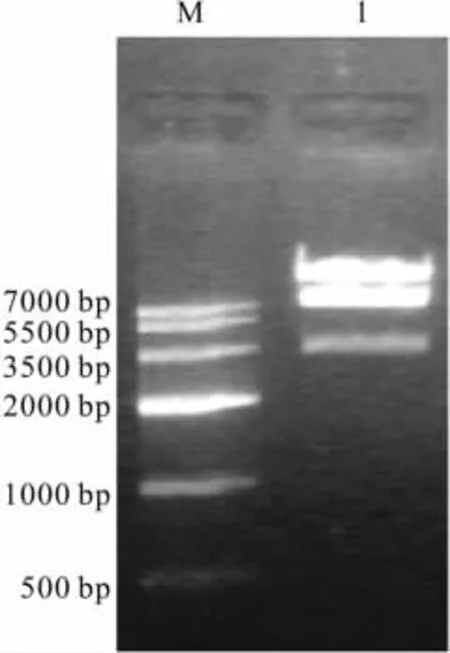
Fig 4 Analysis restriction enzyme digestion of pAd-NK4 byagarose gel electrophoresis
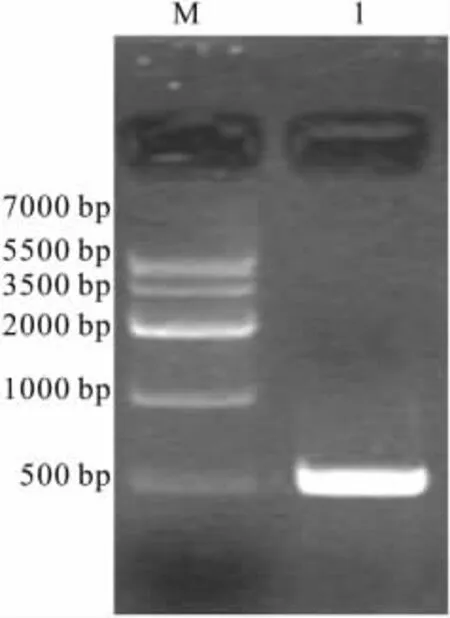
Fig 5 Analysis of PCR product of pAd-NK4 by agarose gel electrophoresis
2.5 重组腺病毒rAd-NK4的PCR鉴定 提取重组腺病毒基因组DNA,设计NK4的引物并扩增NK4基因片段,以检测重组腺病毒rAd-NK4是否构建正确。将NK4片段的PCR产物进行琼脂糖凝胶电泳,在GIS凝胶系统中检测,出现NK4片段的条带(约500 bp),结果见Fig 6,PCR扩增出的片段大小与设计的NK4片段大小一致,证实重组腺病毒rAd-NK4包装成功。
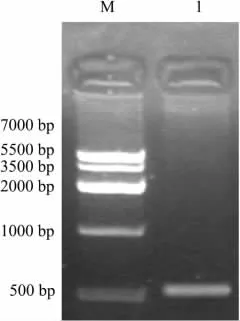
Fig 6 Analysis of PCR product of rAd-NK4 by agarose gel electrophoresis
2.6 重组腺病毒的扩增及滴度测定 利用HEK293细胞进行Ad-NK4腺病毒的扩增,被病毒感染后,细胞皱缩变小,形态不规则,细胞间缝隙增大,然后贴壁细胞脱壁悬浮,当细胞几乎全部成病变状态CPE(cyto pathic effect),且有约一半的细胞漂浮于培养皿时收集细胞,-80℃保存。将细胞在-80℃和37℃水浴间反复冻融3次,离心取上清,即含有扩增之Ad-NK4。TCID50法显色情况如下: 10-7及大于10-7的稀释度均显示(阳性);10-8:7个孔中有显示细胞;10-9:3个孔中有显示细胞;10-10:均无显示细胞,故测得所得病毒滴度为:6.3×108PFU·ml-1(阳性率=1+1+1+1+1+1+1+0.7 +0.3+0=8)。
2.7 重组腺病毒rAd-NK4感染HEK293细胞采用 rAd-NK4重组腺病毒感染 HEK293细胞。HEK293细胞被病毒感染后,细胞皱缩变小,形态不规则,细胞间缝隙增大,荧光显微镜下观察可见明显的荧光(Fig 7)。
2.8 腺病毒介导的NK4在HEK293细胞中的表达 取rAd-NK4重组腺病毒,感染HEK293细胞,以感染Ad-GFP重组腺病毒的细胞作为阴性对照,病毒感染48 h后收集细胞裂解液进行Western blot检测。结果显示:rAd-NK4感染的HEK293细胞(第1和3泳道)均出现特异的NK4条带,而在阴性对照Ad-GFP感染组(第2泳道)没有检测到特异条带(Fig 8),提示rAd-NK4可高效感染HEK293细胞,并成功表达外源导入的NK4基因。
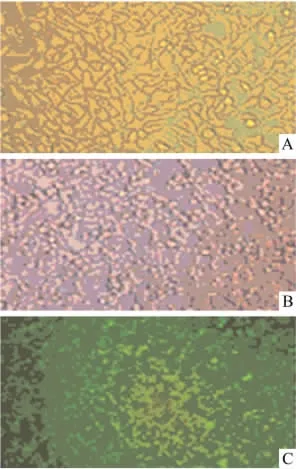
Fig 7 Morphological observation of rAd-NK4-transfected HEK293

Fig 8 Western blot analysis of NK4 expressed by recombinant adenoviruse rAd-NK4
3 讨论
目前基因治疗中应用最广泛的生物病毒载体有重组逆转录病毒载体及重组腺病毒载体。重组腺病毒载体比逆转录病毒载体具有更高的感染力,宿主范围广,体内外均能有效感染分裂期和静息期的细胞,外源基因表达水平高,重组腺病毒的大规模制备相对容易,并且病毒滴度高,能满足临床的需要。腺病毒载体DNA以附加体的形式存在于染色体之外,在细胞的分裂增殖过程中逐渐丢失,因此,其在基因功能研究以及基因治疗中应用较为广泛[13-15]。
当前大多还是采用Adeasy系统来构建和包装腺病毒载体,该系统在设计目的基因引物是先要酶切位点和保护碱基,将目的基因和穿梭质粒Transfer vector分别进行双酶切,再进行连接、转化、筛选并构建穿梭载体,线性化后将穿梭载体和病毒骨架Adeasy在大肠杆菌BJ183中进行同源重组,然后挑选带有kana抗性的重组子,鉴定后经线性化在293细胞中包装,整个过程需要多次酶切、连接和转化筛选,并且在BJ183菌中的重组阳性率很低,还存在假阳性的可能,过程显得既耗时又繁琐[16]。
本实验采用了Invitrogen公司的BLOCK-iT腺病毒表达系统和Gateway技术,即利用LR重组酶进行体外重组。与当前其它腺病毒表达系统相比,这种体外重组更加方便、快速,重组效率更高。在本研究中,我们通过Gateway技术成功构建了rAd-NK4重组腺病毒,其滴度为6.3×1011PFU·L-1。并将此重组腺病毒转染HEK293细胞,经荧光显微镜和Western blot鉴定,发现 rAd-NK4可高效感染HEK293细胞,并成功表达外源导入的NK4基因。该病毒的滴度已经能很好地满足当前体外实验研究的需要,在今后的动物实验中,我们会根据需要进一步的扩增获得更高滴度的病毒。综上,这些结果为进一步研究NK4基因在肿瘤细胞中的调控作用及其作用机制奠定了基础。
[1] Giordano S,Ponzetto C,DiRenzo M F,et al.Tyrosine kinase receptor in distinguish able from the c-Met protein[J].Nature,1989,339:155-6.
[2] 楼兴法,杨 波.HGF/c-Met信号通路与肿瘤的关系及相关抗肿瘤药物的研究[J].药学进展,2007,31(24):486-90.
[2] Lou X F,Yang B.Role of HGF/c-Met signaling in tumorigenesis and the tumor therapy therewith[J].Prog Pharm Sci,2007,31 (24):486-90.
[3] Camp R L,Rimn E B,Rimm D L.Met expression is associated with poor outcome in patients with axillary lymph node negative breast carcinoma[J].Cancer,1999,86:2259-65.
[4] Cheng H L,Liu H S,Lin Y J,et al.Co-expression of RON and MET is a prognostic indicator for patients with transitional cell carcinoma of the bladder[J].Br J Cancer,2005,92:1906-14.
[5] Pons E,Uphoff C C,Drexler H G.Expression of hepatocyte growth factor and its receptor c-met in human leukemia-lymphoma cell lines[J].Leuk Res,1998,22:797-804.
[6] Borset M,Lien E,Espevik T,et al.Concomitant expression of hepatocyte growth factor/scatter factor and the receptor c-MET in human myeloma cell lines[J].J Biol Chem,1996,271:24655-61.
[7] Wader K F,Fagerli U M,Holt R U,et al.Elevated serum concentrations of activated hepatocyte growth factor activator in patients with multiple myeloma[J].Eur J Haematol,2008,81:380-3.
[8] Pour L,vachova H S,Adam Z,et al.Levels of angiogenic factors in patients with multiple myeloma correlate with treatment response[J].Ann Hematol,2010,89:385-9.
[9] Matsumoto K,Nakamura T.NK4 gene therapy targeting HGF-Met and angiogenesis[J].Front Biosci,2008,13:1943-51.
[10]Du W,Hattori Y,Yamada T,et al.NK4,an antagonist of hepatocyte growth factor(HGF),inhibits growth of multiple myeloma cells:molecular targeting of angiogenic growth factor[J].Blood,2007,109:3042-9.
[11]Bushman W,Thompson J F,Vargas L,et al.Control of directionality in lambda site specific recombination[J].Science,1985,230 (4278):906-11.
[12]Landy A.Dynamic,structural,and regulatory aspects of lambda site-specific recombination[J].Annu Rev Biochem,1989,58: 913-49.
[13]Jager L,Ehrhardt A.Emerging adenoviral vectors for stable correction of genetic disorders[J].Curr Gene Ther,2007,7(4):272-83.
[14]Douglas J T.Adenoviral vectors for gene therapy[J].Mol Biotechnol,2007,36(1):71-80.
[15]刘永靖,陈飞虎,于 奇,等.腺病毒载体携带人TRAIL基因治疗H446小细胞肺癌的体外实验研究[J].中国药理学通报,2007,23(6):755-9.
[15]Liu Y J,Chen F H,Yu Q,et al.Antitumor activity of replicationdefective adenovirus carrying human tumor necrosis factor-related apoptosis-inducing ligand gene on human small cell lung cancer cell line H446 in vitro[J].Chin Pharmacol Bull,2007,23(6): 755-9.
[16]顾洪生,程志安,李振宇,等.利用Gateway技术构建腺病毒载体pAd-LMP-1[J].中国组织工程研究与临床康复,2010,14 (24):4425-9.
[16]Gu H S,Cheng Z A,Li Z Y,et al.Constructing a recombinant adenovirus vector pAd-LMP-1 using Gateway technology[J].J Clin Rehab Tiss Engin Res,2010,14(24):4425-9.
