抗菌肽融合表达研究进展
马青山,余占桥,韩冰,张日俊
中国农业大学饲料生物技术实验室 动物营养学国家重点实验室,北京 100193
抗菌肽融合表达研究进展
马青山,余占桥,韩冰,张日俊
中国农业大学饲料生物技术实验室 动物营养学国家重点实验室,北京 100193
抗菌肽抗菌谱广、活性稳定,且具有与抗生素不同的抗菌机制,在抑杀病原微生物的同时不易产生耐药性,因而在食品、饲料、医药等领域具有重要的应用价值。基因工程技术是降低抗菌肽生产成本的主要方式,其中融合表达在提高抗菌肽产量方面起到了重要作用。文中综述了抗菌肽融合表达的国内外研究进展,探讨了部分融合标签用于抗菌肽表达的策略,并对今后的发展提出了自己的看法。
抗菌肽,基因工程技术,融合表达
1 抗菌肽融合表达概述
1.1 抗菌肽生物学特性
抗菌肽是由生物细胞通过核糖体合成机制产生的一类具有抗菌活性的多肽或蛋白质,按来源可分为哺乳动物抗菌肽、昆虫抗菌肽、鱼类抗菌肽、蛙类抗菌肽、植物抗菌肽和微生物抗菌肽 (细菌素);按结构特点可分为 α-螺旋型抗菌肽、β-折叠型抗菌肽、具有片层结构的抗菌肽和具有环状结构的抗菌肽[2]。抗菌肽抗菌谱广,且有着不同于传统抗生素的抗菌机制,一般由20~60个氨基酸残基组成,分子量约为2~7 kDa,通常为阳离子形式存在,具有强碱性,同时具有热稳定性和较宽的pH耐受范围等特点,许多抗菌肽在100 ℃加热10 min后仍能保持一定活力[3]。
抗菌肽在体内可以通过自身的免疫机制来抵御环境中容易侵染宿主的病原微生物[4-5],而且近年研究发现,某些抗菌肽同时具有选择杀伤肿瘤细胞[6]、抑制HBV、HIV等病毒的复制等功能,且抗菌肽仅作用于原核细胞和发生病变的真核细胞,对正常的真核细胞几乎无作用[7-8]。
1.2 抗菌肽融合表达及意义
迄今为止,大约有 2 000多种抗菌肽已经被分离出来,部分已应用于畜牧业、食品加工业、医疗卫生业等行业[9],但由于生产成本居高不下,制约了抗菌肽大规模应用。同天然提取及化学合成法相比,通过生物表达系统异源表达抗菌肽显著降低了生产成本,具有良好的应用前景[10]。但由于抗菌肽一般是一些阳离子小分子多肽,极易在蛋白酶的作用下降解,而且表达产物往往对宿主细胞有毒性作用,易造成宿主细胞的死亡,因此,为了降低抗菌肽对宿主细胞的毒性,同时提高其表达量、简化分离纯化过程,抗菌肽的异源表达经常融合一些蛋白标签,其作用类似于天然抗菌肽产生过程中能够保护抗菌肽及宿主菌的前导肽部分[11]。抗菌肽融合表达经常使用的融合标签如下:谷胱甘肽硫转移酶 (Glutathione S-transferase)[12-14],硫氧化还原蛋白 (Thioredoxin)[15-17],绿色荧光蛋白 (Green fluorescent protein)[18-19],Protein PaP3.30[20],外壳蛋白 (Site-mutated coat protein)[21-22],类弹性蛋白(Elastin-like polypeptides)[23-25],CMP-3-脱氢-D-甘露-辛酮糖酸合成酶 (CMP-KDO synthetase)[26],酮类固醇异构酶 (Ketosteroid isomerase)[27],小分子泛素样修饰蛋白 (Small ubiquitin-related modifier)[28-29]等(见表1)。
以上标签与抗菌肽融合表达最终是为了获取抗菌肽,因此需要将融合蛋白进行切割,进一步分离纯化出抗菌肽。近年,亦有部分研究者将抗菌肽与其他功能蛋白融合表达,使融合蛋白具有双功能特性,融合蛋白即是目的蛋白,不需进一步分离。Pan等将具有免疫原性的Ag85B基因与α2b干扰素基因在酵母中融合表达,在发酵上清中检测到了具有抗病毒活性的融合蛋白,该融合蛋白可能同时实现Ag85B刺激产抗体功能及α干扰素的抗病毒和免疫调节因子功能[30]。

表1 抗菌肽融合表达统计表Table 1 Antimicrobial peptides expressed as fusion proteins

续表1
1.3 抗菌肽融合蛋白标签设计原则
抗菌肽融合蛋白标签的选择常遵循以下原则:1) 融合蛋白标签的分子量最好为抗菌肽的3~4倍,这样将有利于后期抗菌肽的分离、纯化。2) 等电点至少高于或低于抗菌肽等电点 2个 pH单位。Wei等选择等电点为 5.83的杆状病毒多角体蛋白(Baculoviral Polyhedrin Protein) 作为融合蛋白标签,表达等电点为8.24的抗菌肽Halocidin,获得占菌体蛋白 30%、纯度 90%以上的目的抗菌肽[37]。3) 由于目前发现的抗菌肽多具有阳离子性质,所以可选择酸性的融合蛋白标签以中和其正电荷,以降低对宿主菌的毒性[38]。Wang等将抗菌肽HKABF与酸性前导肽融合表达,而后利用肠激酶进行切割,发现表达的重组抗菌肽显示出良好的抑菌活性[10]。4) 融合蛋白标签同抗菌肽的融合位点应存在化学试剂或蛋白酶特异切割位点,以便抗菌肽的活性恢复及后续的分离纯化[39]。5) 对表达宿主无害。Rao等以绿脓杆菌噬菌体蛋白 PaP3.30为融合蛋白标签,该蛋白完全满足上述 5个条件,将该蛋白的编码基因连接入pQE-32构建成大肠杆菌表达载体pQE-PaP30,成功实现了6种抗菌肽hPAB-β、MSI-78、蜂毒素、天蚕素 A、一种来源于羊的阴离子多肽在大肠杆菌中的高效表达[20]。
2 常用抗菌肽融合蛋白标签及其表达策略
如前所述,降低抗菌肽对表达宿主的毒性作用及被蛋白酶降解的程度,同时简化后续的分离纯化工作是选择融合蛋白标签的主要目的[27],通过对最新文献检索发现,抗菌肽融合蛋白标签的使用主要集中在硫氧化还原蛋白 (Trx)、谷胱甘肽硫转移酶(GST) 等 (表 2),而表达宿主主要是大肠杆菌表达系统 (表3)。
2.1 硫氧化还原蛋白 (Trx) 融合标签
硫氧化还原蛋白是一类存在于细菌、植物及动物等多种生物体内的耐热蛋白[41],作为E. coli核苷酸还原酶的电子供体第一次被发现[42],相对分子质量为17 kDa,溶解度很高,大肠杆菌中最高表达量可达到菌体蛋白总量的40%。由于Trx融合蛋白不仅能够增加重组蛋白的可溶性,降低重组蛋白被宿主蛋白酶降解的机率,而且能够催化胞质中重组蛋白二硫键的形成[43],所以目前利用Trx蛋白融合表达的重组抗菌肽数目远多于使用其他融合标签[40]。但是,由于 Trx融合蛋白标签不能用专门的亲和基质纯化,所以融合蛋白构建时最好与可用于纯化的小亲和标签联用,如 6×His标签。Bang等将抗菌肽hin/MSH与6×His-Trx蛋白融合表达,发现融合蛋白占菌体总蛋白的 20%以上,并且 50%以上以可溶形态存在,后期通过 Ni柱亲和层析纯化及肠激酶切割复性,重组抗菌肽产量达210 mg/L,且具有良好的抗菌活性[31]。另外,Wang等利用Trx融合蛋白系统表达人源防御素-4,融合蛋白占菌体蛋白量高达60%,切割纯化后目标蛋白产量达102 mg/L,且具有良好的生物活性[30]。值得注意的是在使用Trx融合蛋白时采用低温诱导能够提高融合抗菌肽的可溶性[44]。至于切割方式的选择,不同的研究有着不同的结果,大部分研究认为酶切是比较有效的切割方式,但也有些研究表明化学切割效率更高[45-48]。
2.2 谷胱甘肽硫转移酶 (GST) 融合标签
GST融合表达是将谷胱甘肽S转移酶与目标蛋白以融合蛋白的方式进行外源表达,融合蛋白可从未经处理的裂解液中用固定化的谷胱甘肽琼脂糖亲和层析加以纯化,结合的融合蛋白在非变性条件下用10 mmol/L还原型谷胱甘肽进行洗脱[49],融合蛋白通过位点专一的蛋白酶如凝血酶或 Xa-因子切除GST部分,获得目的蛋白。由于GST标签有助于保护重组蛋白免受胞外蛋白酶的降解,提高其稳定性、可溶性,并且通过亲和层析简化后续的纯化工作,所以抗菌肽同GST标签融合表达将显著提高其表达量、降低生产成本。本研究组利用GST标签表达植物乳杆菌素PlnE和PlnF,经亲和层析纯化后,获得2种产量高达30%的纯品融合蛋白,表明此种融合表达对宿主不会产生毒害作用,但酶切后未检测到抑菌活性,这可能是由于酶切后PlnE和PlnF摩尔配比未达到最佳造成,不过值得肯定的是GST标签在表达对宿主细胞有毒害作用的蛋白中发挥的重要作用[50]。另外,Fan等将4.7 kDa的抗菌肽PR-39与 GST标签融合表达,通过谷胱甘肽琼脂糖亲和层析纯化及肠激酶切割,获得具有抗菌活性目的蛋白 1.9 mg/L[13]。但是,也有研究发现将抗菌肽CecropinB和 GST标签融合表达后造成了宿主细胞
E. coli的死亡,这可能是由于融合蛋白具有杀伤原核细胞的作用[51],形成包涵体或者利用真核细胞表达系统可能是解决这一问题的一个途径。GST融合蛋白标签表达抗菌肽的另一个问题是由于其分子量比较大 (27 kDa),而抗菌肽通常是小分子量多肽,这样会造成抗菌肽在融合蛋白中比例偏低,降低表达效率[40]。
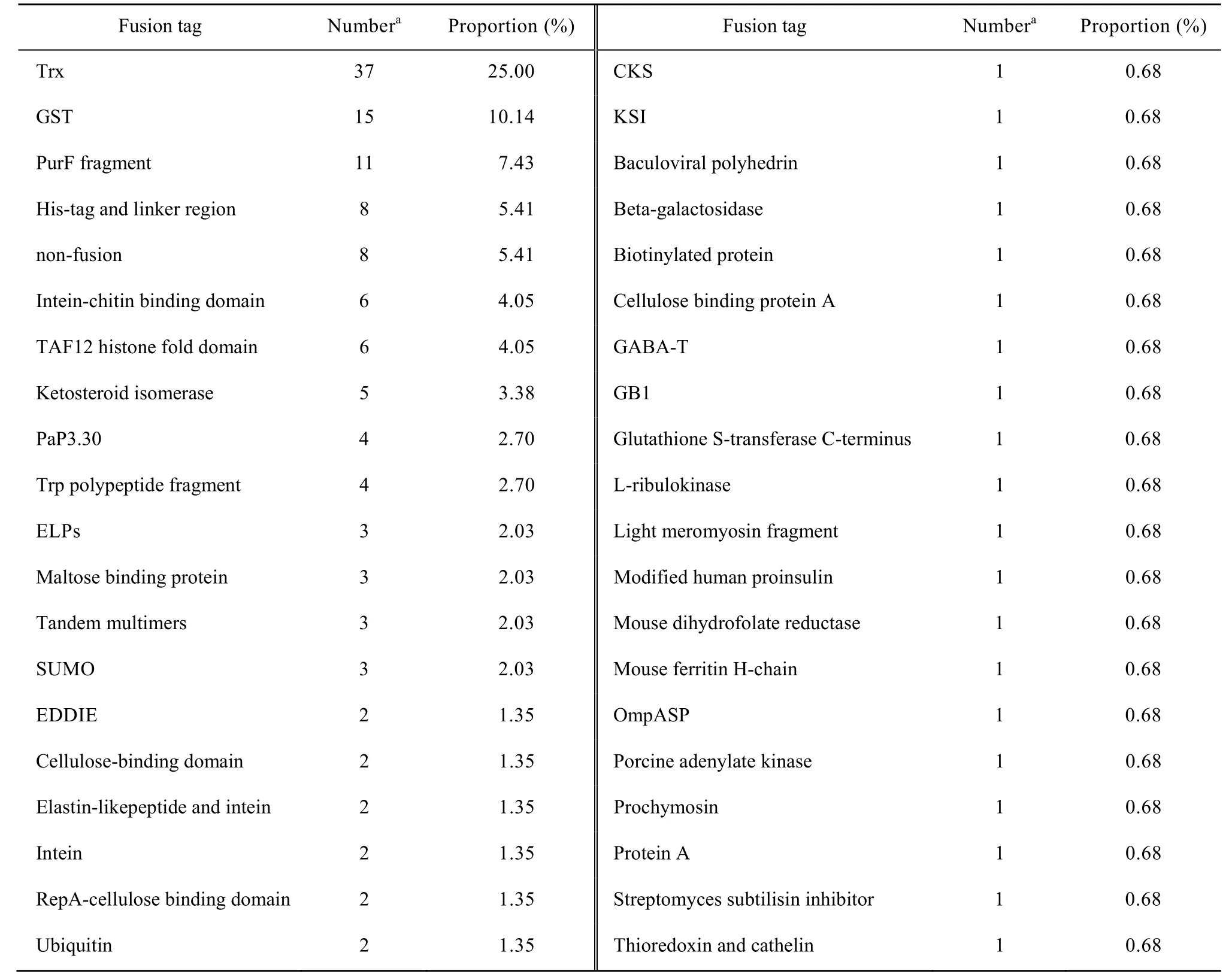
表2 抗菌肽融合表达标签使用情况统计表Table 2 Tags for fusion expression of antimicrobial peptides

表3 重组抗菌肽不同表达宿主使用情况统计表Table 3 Antimicrobial peptides expressed with different host
2.3 小分子泛素样修饰蛋白 (SUMO) 融合标签
最近,一种新型的表达系统渐渐发展了起来,即将小分子泛素样修饰蛋白基因与目的蛋白基因连接,组成融合表达载体进行表达。SUMO是一种同泛素结构类似但功能不同的小分子量蛋白质 (大约由 100个氨基酸组成),能够帮助目的蛋白正确折叠,由于其具有疏水的核心及亲水的表面,可明显提高目的蛋白的可溶性及表达量[52]。融合蛋白表达出来后,经过特异性的SUMO蛋白酶进行切割,不同于其他的蛋白酶,SUMO蛋白酶能够特异识别SUMO的三级结构,这样就能够完全避免对目的抗菌肽的切割,使酶切后的目的蛋白具有天然的 N端,这对于保持抗菌肽活性至关重要[53-55]。另外,同Trx融合标签类似,SUMO融合标签分子量比较小 (12 kDa),提高了目的肽在融合蛋白中的比例,这对提高抗菌肽的产量比较有利。基于以上优点,SUMO表达系统表达抗菌肽获得比较理想的效果,在我们目前的研究工作中,利用大肠杆菌SUMO表达系统表达细菌素 Lactin Q,融合蛋白 6×His SUMO-Lactin Q主要以可溶形态存在,过 Ni-NTA柱纯化后,其产量约为 110 mg/L,融合蛋白经SUMOase切割后,发现重组Lactin Q对金黄色葡萄球菌有明显抑制作用。Li等利用大肠杆菌SUMO表达系统表达天蚕抗菌肽ABP-CM4、人源防御素-4,表达量分别达到48 mg/L、166 mg/L,并且抗菌活性与天然抗菌肽相当[28,32]。Chen等构建枯草芽胞杆菌SUMO表达系统并用其表达重组抗菌肽 Cecropin AD,产量达到30.6 mg/L,对金黄色葡萄球菌的MICs (Minimal inhibitory concentrations,最小抑菌浓度)仅为0.2 µg/mL[56]。总的来看,SUMO融合表达抗菌肽的报道还不是很多,但随着商品化的SUMO表达载体的开发,SUMO融合表达系统以其高的表达量、简单高效的纯化方式,必将在抗菌肽生产中发挥重要作用。
3 结语
随着新型融合标签表达系统的不断开发,抗菌肽融合表达越来越受到研究者的青睐,同Trx、GST及SUMO等标签融合表达能够显著提高重组抗菌肽可溶性、产量;简化分离纯化过程;降低生产成本,但不同抗菌肽表达结果不同。为提高其产量及活性,需进行融合标签同表达载体及菌株等的优化组合并进行相关的遗传设计与改造,同时需对温度、pH、培养基组成等表达条件进行优化。
从长远来看,在抗菌肽融合表达研究方面,如何进一步提高产量及进一步降低分离纯化成本仍是需要解决的主要问题,串联表达目的抗菌肽及构建分泌型表达载体或许是解决这一问题的新途径。随着技术的发展,越来越多的融合标签系统用于抗菌肽的异源表达,使低成本大量生产抗菌肽成为可能。在细菌耐药性日益严重的今天,抗菌肽的应用将在医学、食品卫生、畜牧行业中发挥重要的作用。
REFERENCES
[1] Makovitzki A, Avrahami D, Shai Y. Ultrashort antibacterial and antifungal lipopeptides. Proc Natl Acad Sci USA, 2006, 103(43): 15997−16002.
[2] Brogden KA. Antimicrobial peptides: pore formers or metabolic inhibitors in bacteria? Nat Rev Microbiol, 2005, 3(3): 238−250.
[3] Svetoch EA, Eruslanov BV, Perelygin VV, et al. Diverse antimicrobial killing by Enterococcus faecium E 50-52 bacteriocin. J Agric Food Chem, 2008, 56(6): 1942−1948.
[4] Kagan BL, Selsted ME, Ganz T, et al. Antimicrobial defensin peptides form voltage-dependent ion-permeable channels in planar lipid bilayer membranes. Proc Natl Acad Sci USA, 1990, 87(1): 210−214.
[5] Sugiarto H, Yu PL. Avian antimicrobial peptides: the defense role of β-defensins. Biochem Biophys Res Commun, 2004, 323(3): 721−727.
[6] Rajanbabu V, Chen JY. Applications of antimicrobial peptides from fish and perspectives for the future. Peptides, 32(2): 415−420.
[7] Dean RE, O'Brien LM, Thwaite JE, et al. A carpet-based mechanism for direct antimicrobial peptide activity against vaccinia virus membranes. Peptides, 2010, 31(11): 1966−1972.
[8] Wachinger M, Kleinschmidt A, Winder D, et al. Antimicrobial peptides melittin and cecropin inhibit replication of human immunodeficiency virus 1 by suppressing viral gene expression. J Gen Virol, 1998, 79(4): 731−740.
[9] Lazarev VN, Govorun VM. Antimicrobial peptides and their use in medicine. Appl Biochem Microbiol, 2010, 46(9): 803−814.
[10] Wang L, Lai CE, Wu QF, et al. Production and characterization of a novel antimicrobial peptide HKABF by Pichia pastoris. Process Biochem, 2008, 43(10): 1124−1131.
[11] Vassilevski AA, Kozlov SA, Grishin EV. Antimicrobial peptide precursor structures suggest effective production strategies. Recent Pat Inflamm Allergy Drug Discov, 2008, 2(1): 58−63.
[12] Ouyang P, Gao Y, Lei LC, et al. Prokaryotic expression and antimicrobial activity of human lysozymetachyplesins fusion protein. Chin J Biologicals, 2010, 23(8): 829−833.
[13] Fan F, Wu Y, Liu J. Expression and purification of two different antimicrobial peptides, PR-39 and Protegrin-1 in Escherichia coli. Protein Expr Purif, 2010, 73(2): 147−151.
[14] Feng XJ, Liu CL, Guo JY, et al. Expression and purification of an antimicrobial peptide, bovine lactoferricin derivative LfcinB-W10 in Escherichia coli. Curr Microbiol, 2010, 30(3): 179−184.
[15] Wang LN, Yu B, Han GQ, et al. Molecular cloning, expression in Escherichia coli of Attacin A gene from Drosophila and detection of biological activity. Mol Biol Rep, 2010, 37(5): 2463−2469.
[16] Jing XL, Luo XG, Tian WJ, et al. High-level expression of the antimicrobial peptide plectasin in Escherichia coli. Curr Microbiol, 2010, 61(3): 197−202.
[17] Krahulec J, HyršováM, Pepeliaev S, et al. High level expression and purification of antimicrobial human cathelicidin LL-37 in Escherichia coli. Appl Microbiol Biotechnol, 2010, 88(1): 167−175.
[18] Skosyrev VS, Rudenko NV, Yakhnin AV, et al. EGFP as a fusion partner for the expression and organic extraction of small polypeptides. Protein Expr Purif, 2003, 27(1): 55−62.
[19] Lin CY, Yang PH, Kao CL, et al. Transgenic zebrafish eggs containing bactericidal peptide is a novel food supplement enhancing resistance to pathogenic infection of fish. Fish Shellfish Immun, 2010, 28(3): 419−427.
[20] Rao XC, Li S, Hu JC, et al. A novel carrier molecule for high-level expression of peptide antibiotics in Escherichia coli. Protein Expr Purif, 2004, 36(1): 11−18.
[21] Cheng XW, Lu WG, Zhang SQ, et al. Expression and purification of antimicrobial peptide CM4 by Nprofusion technology in E. coli. Amino Acids, 2010, 39(5): 1545−1552.
[22] Zhang Z, Ke T, Zhou Y, et al. High expression of antimicrobial peptide Cecropin AD in Escherichia coli by fusion with EDDIE. Chin J Biotechnol, 2009, 25(8): 1247−1253.
[23] Hu F, Ke T, Li X, et al. Expression and purification of an antimicrobial peptide by fusion with elastin-like polypeptides in Escherichia coli. Appl Biochem Biotechnol, 2010, 160(8): 2377−2387.
[24] Guo CY, Diao H, Lian YD, et al. Recombinant expression and characterization of an epididymis-specific antimicrobial peptide BIN1b/SPAG11E. J Biotechnol, 2009, 139(1): 33−37.
[25] Hu F, Ke T, Li X, et al. Expression and purification of the antimicrobial polypeptide by fusion with elastin-like polypeptide. J Mol Cell Biol, 2008, 41(3): 233−237.
[26] Peng H, Yang M, Huang WS, et al. Soluble expression and purification of a crab antimicrobial peptide scygonadin in different expression plasmids and analysis of its antimicrobial activity. Protein Expr Purif, 2010, 70(1): 109−115.
[27] Sun YL, Kuan TC, Lin YJ, et al. Construction and expression of rabbit neutrophil peptide-1 gene in Escherichia coli. Ann Microbiol, 2010, 60(2): 329−334.
[28] Li JF, Zhang J, Zhang Z, et al. SUMO mediating fusion expression of antimicrobial peptide CM4 from two joined genes in Escherichia coli. Curr Microbiol, 2010, 62(1): 296−300.
[29] Bommarius B, Jenssen H, Elliott M, et al. Cost-effective expression and purification of antimicrobial and host defense peptides in Escherichia coli. Peptides, 2010, 31(11): 1957−1965.
[30] Pan Y, Gao BY, Wang HH, et al. Fusion expression of genes IFNα2b and Ag85B in Pichia pastoris. J Fudan Univ: Nat Sci, 2005, 4(4): 511−516.潘颖, 高卜渝, 王洪海, 等. α2b干扰素基因与Ag85B基因在毕赤氏酵母中的融合表达. 复旦学报: 自然科学版, 2005, 4(4): 511−516.
[31] Bang SK, Kang CS, Han MD, et al. Expression of recombinant hybrid peptide hinnavin II/β-melanocytestimulating hormone in Escherichia coli: Purification and characterization. J Microbiol, 2010, 48(1): 24−29.
[32] Li JF, Zhang J, Zhang Z, et al. Production of bioactive human beta-defensin-4 in Escherichia coli using SUMO fusion partner. Protein J, 2010, 29(5): 314−319.
[33] Shen Y, Ai HX, Song R, et al. Expression and purification of moricin CM4 and human β-defensins 4 in Escherichia coli using a new technology. Microbiol Res, 2010, 165(8): 713−718.
[34] Upadhyay SK, Saurabh S, Rai P, et al. SUMO fusion facilitates expression and purification of garlic leaf lectin but modifies some of its properties. J Biotechnol, 2010, 146(1/2): 1−8.
[35] Wang AP, Su YP, Wang S, et al. High efficiency preparation of bioactive human α-defensin 6 in Escherichia coli Origami (DE3) pLysS by soluble fusion expression. Appl Microbiol Biotechnol, 2010, 87(5): 1935−1942.
[36] Wang YL, Jiang Y, Gong TX, et al. High-level expression and novel antifungal activity of mouse beta defensin-1 mature peptide in Escherichia coli. Appl Biochem Biotechnol, 2010, 160(1): 213−221.
[37] Wei Q, Kim YS, Seo JH, et al. Facilitation of expression and purification of an antimicrobial peptide by fusion with baculoviral polyhedrin in Escherichia coli. Appl Environ Microbiol, 2005, 71(9): 5038−5043.
[38] Lee JH, Kim JH, Hwang SW, et al. High-level expression of antimicrobial peptide mediated by a fusion partner reinforcing formation of inclusion bodies. Biochem Biophys Res Commun, 2000, 277(3): 575−580.
[39] Haught C, Davis GD, Subramanian R, et al. Recombinant production and purification of novel antisense antimicrobial peptide in Escherichia coli. Biotechnol Bioeng, 1998, 57(1): 55−61.
[40] Li YF. Carrier proteins for fusion expression of antimicrobial peptides in Escherichia coli. Biotechnol Appl Biochem, 2009, 54(1): 1−9.
[41] Hlavac F, Rouer E. Expression of the protein-tyrosine kinase p56lck by the pTRX vector yields a highly soluble protein recovered by mild soni-cation. Protein Expr Purif, 1997, 11(3): 227−232.
[42] Laurent TC, Moore EC, Reichard P. Enzymatic synthesis of deoxyribonucleotides. IV. Isolation and characterization of thioredoxin, the hydrogen donor from Escherichia coli. J Biol Chem, 1964, 239: 3436−3444.
[43] Stewart EJ, Åslund F, Beckwith J. Disulfide bond formation in the Escherichia coli cytoplasm: an in vivo role reversal for the thioredoxins. EMBO J, 1998, 17(19): 5543−5550.
[44] Gagliardo B, Faye A, Jaouen M, et al. Production of biologically active forms of recombinant hepcidin, the iron-regulatory hormone. FEBS J, 2008, 275(15): 3793−3803.
[45] Li YF, Li X, Wang GS. Cloning, expression, isotope labeling, and purification of human antimicrobial peptide LL-37 in Escherichia coli for NMR studies. Protein Expr Purif, 2006, 47(2): 498−505.
[46] Li BC, Zhang SQ, Dan WB, et al. Expression in Escherichia coli and purification of bioactive antibacterial peptide ABP-CM4 from the Chinese silk worm, Bombyx mori. Biotechnol Lett, 2007, 29(7): 1031−1036.
[47] Li YF, Li X, Li H, et al. A novel method for purifying recombinant human host defense cathelicidin LL-37 by utilizing its inherent property of aggregation. Protein Expr Purif, 2007, 54(1): 157−165.
[48] Gibbs GM, Davidson BE, Hillier AJ. Novel expression system for large-scale production and purification of recombinant class IIa bacteriocins and its application to piscicolin 126. Appl Environ Microbiol, 2004, 70(6): 3292−3297.
[49] Terpe K. Overview of tag protein fusions: from molecular and biochemical fundamentals to commercial systems. Appl Microbiol Biotechnol, 2003, 60(5): 523−533.
[50] Yang F, Yu ZQ, Zhang RJ. Heterologly expression of plantaricin genes PlnE and PlnF in E. coli. Chin Anim Husb Vet Med, 2010, 37(12): 55−60.杨芳, 余占桥, 张日俊. 乳酸菌素基因PlnE和PlnF在大肠杆菌中的异源表达. 中国畜牧兽医, 2010, 37(12): 55−60.
[51] Hu YL, Hu TS, Lin SK, et al. The site-directed mutagenesis and expressing of Cecropin B Gene. Pharm Biotechnol, 1999, 6(4): 193−197.胡云龙, 胡泰山, 林世康, 等. Cecropin B抗菌肽基因的定向诱变与表达. 药物生物技术, 1999, 6(4): 193−197.
[52] Sun Z, Xia Z, Bi F, et al. Expression and purification of human urodilatin by small ubiquitin-related modifier fusion in Escherichia coli. Appl Microbiol Biotechnol, 2008, 78(3): 495−502.
[53] Bayer P, Arndt A, Metzger S, et al. Structure determination of the small ubiquitin-related modifier SUMO-1. J Mol Biol, 1998, 280(2): 275−286.
[54] Butt TR, Edavettal SC, Hall JP, et al. SUMO fusion technology for difficult-to-express proteins. Protein Expr Purif, 2005, 43(1): 1−9.
[55] Zuo X, Mattern MR, Tan RB, et al. Expression and purification of SARS coronavirus proteins using SUMO-fusions. Protein Expr Purif, 2005, 42(1): 100−110.
[56] Chen X, Zhu F, Cao Y, et al. Novel expression vector for secretion of cecropin AD in Bacillus subtilis with enhanced antimicrobial activity. Antimicrob Agents Chemother, 2009, 53(9): 3683−3689.
Research progress in fusion expression of antimicrobial peptides
Qingshan Ma, Zhanqiao Yu, Bing Han, and Rijun Zhang
Laboratory of Feed Biotechnology, State Key Laboratory of Animal Nutrition, China Agricultural University, Beijing 100193, China
Antimicrobial peptides (AMPs) are of great significance in the field of food, feed and medicine due to their wide spectrum of antimicrobial activity and new mechanism of action different from conventional antibiotics. AMPs production from natural sources is usually limited, and chemical synthesis is not economically practical, especially for the production of long peptides. Therefore, heterologous expression of AMPs has been widely studied as an alternative, and fusion expression plays an important role in increasing production. The present review mainly focuses on the types and bioactivities of AMPs. In addition, the recent strategies to the most commonly used carrier proteins for fusion expression of AMPs and prospects for future research were also discussed.
antimicrobial peptides, genetic engineering, fusion expression
目前,细菌、真菌对抗生素产生的耐药性正在以惊人的速度增加,如近些年出现的超级细菌,这引起了全世界对现有抗生素药物疗效的普遍担忧[1],新型抗生素替代品的开发迫在眉睫。抗菌肽因其优良的抗菌特性和安全性有望成为抗生素的理想替代品。
March 11, 2011; Accepted: June 7, 2011
Supported by:National Natural Science Foundation of China (No. 30972124).
Rijun Zhang. Tel: +86-10-62731208; E-mail: zhangrj621@yahoo.com.cn
国家自然科学基金 (No. 30972124) 资助。

