混合菌絮凝性能的研究
崔亚楠,张从良,王 岩
(郑州大学化工与能源学院,河南郑州 450001)
微生物絮凝剂是一类由微生物产生且具有絮凝活性的次生代谢产物,其主要成分为糖蛋白、多糖、蛋白质、纤维素和DNA等[1-2],与传统絮凝剂相比,具有无毒无害、安全性高、易被微生物降解、无二次污染等特点,是一种高效、无毒、无二次污染的新型水处理剂,因此倍受国内外广泛关注[1]。本试验针对自行筛选的混合菌进行絮凝性能研究,并通过其他废水来验证其絮凝效果。
1 材料与方法
1.1 菌种的筛选
自郑州某猪场污泥分离筛得17株絮凝活性较高的菌株(絮凝活性均在90%以上),分别命名为xn1~xn17。通过菌落形态和个体形态观察,可初步推断xn1、xn2、xn4为霉菌;xn17为放线菌;其他13株菌为细菌。将其两两复配后,(xn10+xn9)的絮凝活性最高,絮凝率为97%。
1.2 水样来源
①高岭土标准悬浮液:将高岭土配制成浓度为5 g/L的悬浊液;②郑州某猪场废水;③染料废水:浓度100 mg/L碱性品红溶液。
1.3 混合菌发酵液絮凝率的测定
絮凝率采用改进方法[2]测定,将1 mL发酵液和2 mL CaCl2(10 g·L-1)溶液加入装有100 mL高岭土悬浊液(5 g/L)的150 mL锥形瓶中,调pH值至7.5左右,均匀搅拌1 min,静置10 min后用吸管吸取上清液于722型分光光度计550 nm处测定吸光度,以不加培养液的溶液为对照来确定培养液的絮凝活性。絮凝率计算如下:

式中,A为对照上清液吸光度,B为样品上清液吸光度。
1.4 絮凝分布活性的测定
絮凝活性分布试验即测定发酵液、发酵上清液及细胞菌悬液的絮凝活性。取5 mL发酵液在3 000 r/m下离心30 min,取上清液测定絮凝活性;另取5 mL发酵液在3 000 r/m下离心30 min,弃去上清液,将沉于底部的菌体用蒸馏水洗涤3次,在3 000 r/m下离心,弃去上清液,加蒸馏水定容至5 mL,混匀测定细胞菌悬液的絮凝活性。
1.5 提取和成分初步分析
将离心获得的上清液与两倍体积的95%预冷乙醇均匀混合,在4℃下将放置24 h后,经离心收集的沉淀物用95%乙醇反复洗涤、离心3次,最后真空干燥即得絮凝剂。对提取的粗品通过糖的呈色反应和蛋白质的呈色反应[3]初步分析,Molish反应、蒽酮反应和Seliwanoff反应为检测糖类的呈色反应;双缩脲反应、黄蛋白反应和茚三酮反应为检测氨基酸或蛋白质的呈色反应。
1.6 实验仪器
722S可见分光光度计、BS124S分析天平、80-2离心机、SHZ-82水浴恒温振荡器等。
2 结果与讨论
2.1 金属离子对絮凝活性的影响
以 1%FeCl3、AlCl3、MgCl2、NaCl、KCl溶液代替1%CaCl2溶液测定(xn10+xn9)的絮凝率,结果如表1所示。几种阳离子对(xn10+xn9)絮凝效果促进程度的大小顺序为Ca2+>Al3+>Mg2+>Fe3+>K+> Na+,显然,Ca2+、Al3+、Mg2+对(xn10+xn9)助凝作用明显,而 K+、Na+、Fe3+则较小,因此最佳金属离子为Ca2+和Al3+。但Al3+存在二次污染问题,不宜作助凝剂,故宜选Ca2+作助凝剂。

表1 不同金属离子对(xn10+xn9)絮凝率的影响 %
2.2 氯化钙投加量对絮凝活性的影响
通过改变CaCl2投加量来进一步研究金属离子对微生物絮凝活性的影响,结果如图1所示。不投加Ca2+的发酵不具有絮凝活性,随Ca2+的增加,(xn10+xn9)絮凝率逐渐增大,在1%CaCl2投加量为3 mL时,其絮凝活性达最大值(97.24%),但继续增大CaCl2投加量对絮凝率无效,因此Ca2+对提高微生物絮凝效果有不可忽略的作用。
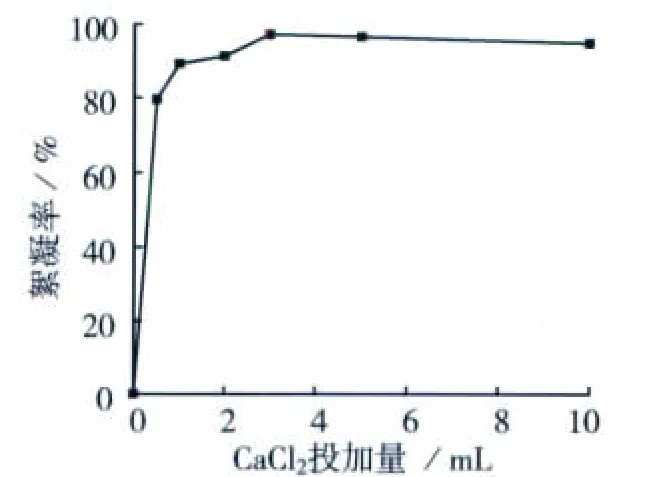
图1 CaCl2投加量对(xn10+xn9)絮凝率的影响
2.3 微生物投加量对絮凝活性的影响
将不同剂量的(xn10+xn9)投加到100 mL高岭土悬浊液中,效果见图2。随(xn10+xn9)投加量的增加,其絮凝率逐渐提高,在投加量为3 mL时达最大值(96.35%),随后絮凝率逐渐降低。这是因为絮凝活性官能团通过Ca2+作用与高岭土颗粒形成一种独特吸附,絮凝剂过量会影响絮凝的压缩双电子层和吸附架桥作用而使原来的稳定状态脱稳。

图2 絮凝剂投加量对(xn10+xn9)絮凝率的影响
2.4 高岭土悬浊液pH值对絮凝活性的影响
微生物絮凝剂受外界环境pH的影响程度不同,这是因为pH值不仅影响胶体颗粒的表面电荷、Zete电位,也会影响微生物絮凝剂表面的电荷性质,从而影响微生物絮凝剂和高岭土悬浊液间的电中和作用和吸附作用[4]。将微生物絮凝剂和CaCl2投加到不同pH值的高岭土悬浊液中,以相应pH值的废水为对照,混匀静置10 min后其对絮凝性能的影响如表2所示。在pH值2~10范围内(xn10+xn9)能保持较好絮凝活性,絮凝率在68%以上,具有一定的pH稳定性和广谱性;但相比较而言,该絮凝剂更适合处理酸性废水。

表2 不同pH值对(xn10+xn9)絮凝率的影响 %
2.5 热稳定性
微生物絮凝的热稳定性和微生物絮凝剂的组分密切相关。有些研究[5]发现絮凝剂组分以蛋白质为主的絮凝活性受温度影响较大;而以多糖为主的絮凝剂,热稳定性较好,受温度的影响很小。由图3可以看出,在温度范围为30~100℃内微生物絮凝剂(xn10+xn9)的絮凝率均在90%以上,且絮凝率波动幅度不大,说明其热稳定性较好,可以初步推断其主要成分为多糖。

图3 微生物絮凝(xn10+xn9)的热稳定性
2.6 对其他废水的絮凝性能
利用(xn10+xn9)对其他废水进行初步絮凝试验处理,结果见表3。絮凝剂投加量和CaCl2投加量各1 mL于30 mL(100 g/L)碱性品红溶液中,均匀搅拌1 min,静置10 min后在碱性红最大吸收波长为543 nm下测定吸光度为0.046,脱色率97.26%;对猪场废水,将2 mL絮凝剂和9 mLCaCl2投加至100 mL废水,均匀搅拌1 min,静置20 min后,浊度从280降到54,去除率为83.93%。对这两种较难处理的废水,(xn10+xn9)均有较好的絮凝效果,但实际应用尚需对各种絮凝影响因素进行深入研究。
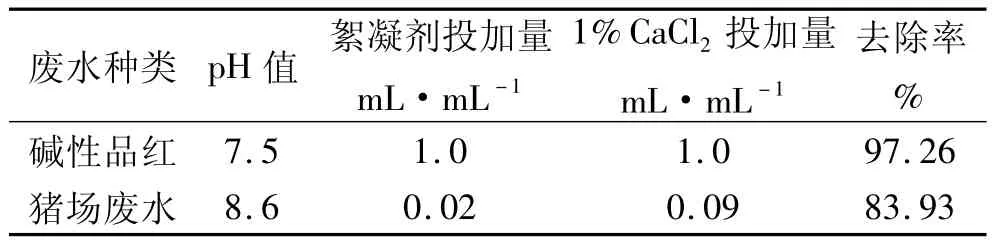
表3 处理结果
2.7 絮凝活性分布及成分初步分析
测定发酵液、发酵上清液和细胞菌悬液的絮凝活性结果如表4所示,由表4可以看出,其絮凝活性大小顺序为:发酵液>发酵上清液>细胞菌悬液,且离心后上清液的絮凝活性和发酵原液的絮凝活性较接近,这说明微生物的絮凝活性物质主要是胞外产物,主要分布在培养液中。

表4 絮凝活性分布
对于(xn10+xn9)的Molish反应,在浓硫酸和样品液面的分界处呈现明显紫环;蒽酮反应呈现蓝绿色,这说明其含有糖类成分;而Seliwanoff反应没有鲜红色出现,说明其所含多糖成分为非酮糖多糖。双缩脲反应不显紫色,黄蛋白反应不显桔黄色,茚三酮反应不显蓝紫色,这说明其不含蛋白质或氨基酸成分。
3 结论
本文研究结果表明(xn10+xn9)具有较好的热稳定性和pH稳定性,在较广的范围内均能保持较好的絮凝活性,且Ca2+、Al3+、Mg2+对其助凝作用明显。(xn10+xn9)的絮凝活性物质主要为胞外产物,主要成分为非酮糖多糖,不含蛋白质。对猪场废水和碱性品红溶液均具有良好絮凝效果,其浊度去除率和脱色率分别为83.93%、97.26%,但实际推广应用尚需对生产成本等问题进行深入研究。
[1]Salehizadeh H,Vossoughi M,Alemzadeh I.Some investigations on bioflocculant producing bacteria[J].Biochem Eng J,2000,5(1),39-44.
[2]Kurane R,Toeda K,Takeda K,et al.Screening and characteristics of microbial flocculants[J].Agr Biol Chem,1986b,50:2301-2307.
[3]李建斌等.生物化学实验原理和方法[M].北京:北京大学出版社,1994.
[4]郑怀礼.生物絮凝剂与絮凝技术[M].北京:化学工业出版社,2004.
[5]Yim J H,Kim S J,Ahn S H,et al.Characterization of a novel bioflocculant,p-KG03,from a marine dinoflagellate,gyrodinium impudicum KG03[J].Bioresource Technol,2007,98:361-367.

