小鼠体温对体积描记箱内压力变化的影响
徐卫华
(浙江省立同德医院呼吸科,浙江 杭州 310012)
小动物在一个密封的体积描记箱内呼吸,将引起描记箱内压力变化,从而推导出一些小动物的肺功能指标[1-4]。这些压力变化主要有两个来源[5]:吸气时胸廓膨胀引起的气体压缩,以及空气吸入肺内由于温化和湿化作用,后者使吸入气体进一步膨胀从而进一步压缩胸廓外体积描记箱内气体。
在测量小动物肺功能时,除采用整体体积描记法(whole body plethysmography)外,还使用双室体积描记法(double-chamber plethysmography)或躯体体积描记法(head-out plethysmography)[6-8]。鉴于小动物呼出的气体温度高于描记箱内气体的温度,可能影响实际测量结果,有学者[9]在头室的壁上设置通口,并以固定的流量(500 ml/min)将头室内空气交换为新鲜空气,以去除头室内温度变化的影响。
由于动物体温高于描记箱内的空气温度,因此除动物肺内的温化和湿化作用外,在描记箱内的空气亦存在加温过程。Amdur和Mead观察了整体体积描记箱内动物体温对箱内温度和压力变化的影响[10],但未涉及体积描记箱内温度变化趋势以及具体变化数据。另外,体积描记箱内动物呼吸运动时产生的热量,是否亦对描记箱内温度和压力产生影响?更重要的是,在压力型体积描记箱内由动物体温引起的压力变化是否会影响小动物的呼吸频率和描记箱内压力变化幅度等问题均未见报道。为此,本研究观测了放置有小鼠的整体体积描记箱、双室体积描记箱以及躯体体积描记箱内温度和压力变化,并研究这些压力变化对小鼠的呼吸频率和呼吸幅度的影响。
1 材料与方法
1.1 动物 本研究使用6-8周龄、体重为18~22 g的雌性BALB/c小鼠(浙江大学实验动物中心提供)。动物在标准的清洁级饲养环境中饲养,自由饮水和进食。所有动物实验均遵循浙江大学医学院第二附属医院伦理委员会的规定操作。小鼠在实验前1 h进入测量实验室,适应温度(19.5 ±0.5)℃、湿度为 50%的实验环境。对小鼠进行的气管插管操作,先用1%戊巴比妥钠以5 ml/kg的剂量腹腔注射麻醉,再用2 cm长的12G自制气管插管针对小鼠行气管插管,外科手术缝线结扎固定插管针。实验结束后小鼠用超剂量戊巴比妥腹腔注射麻醉处理。
1.2 实验设备与配置 本研究所使用体积描记箱同文献所述[11-12]:呈正方体型,中空体积为(3×4×12)cm3,两个体积描记箱可由小三通管连通成一个双室体积描记箱,亦可分开成整体体积描记箱或者躯体体积描记箱。每个描记箱均连接一个压力传感器,压力信号由压力传感器测量并由Medlab U/4CS系统(南京美易科技贸易有限公司)处理。基线压为压力曲线的基线部分,振幅压为压力曲线的振幅部分。
Medlab U/4CS系统工作条件、描记箱内压力和容量的校准换算均与既往研究相同[11-12]。温度测量使用科学实验温度计(上海华晨医学器械有限公司),精度为0.01℃,测量时该温度计从盖板中心孔隙进入描记箱内0.5 cm。
1.3 实验设计 本研究由以下3个实验组成。
1.3.1 实验1 小鼠体温对整体体积描记箱内温度和压力变化的影响。8只小鼠麻醉后放入整体体积描记箱,记录小鼠呼吸时描记箱内的压力变化曲线,每分钟测量1次描记箱内的温度和压力曲线的基线压。6 min后将小鼠取出,并予超剂量戊巴比妥腹腔注射将小鼠致死。然后,把死亡小鼠放回到另一整体体积描记箱,再次测量描记箱内温度和压力变化,每分钟1次,共测量6 min。
1.3.2 实验2 小鼠体温对双室体积描记箱内温度和压力变化的影响。8只小鼠按前描述的程序麻醉及气管插管后,放入双室体积描记箱的躯体室,插管针连接到描记箱之间的三通管,使其从头室呼吸。同步测量两室内的温度和压力变化。温度和基线压每2 min测量1次,共测量20 min。
1.3.3 实验3 体积描记箱内温度变化所致的压力变化对小鼠呼吸频率和压力变化幅度的影响。两个相互独立的躯体体积描记箱,将其中一箱体保持对外密封(密封式躯体体积描记箱),另一箱体则每2 min内对外开放1 min(开放式躯体体积描记箱)。本实验的小鼠均先进行麻醉和气管插管,步骤同上。
8只小鼠依次被放入密封式躯体体积描记箱,气管插管针与描记箱前壁的三通管连接。这样小鼠从外界呼吸空气,而躯体在描记箱内。小鼠的呼吸频率和箱内压力变化幅度每2 min测量1次,共测量22 min。
另8只小鼠依次被放入开放式躯体体积描记箱,实验步骤与密封式躯体体积描记箱的小鼠相同。当两个描记箱都对外密封时,同步测量小鼠的呼吸频率和描记箱内压力变化幅度,每2 min记录1次,连续22 min。
1.4 数据统计 所有数据用SPSS 13.0统计软件处理,每个指标的数值以均数±标准差表示。实验1、2中的数据,采用配对t检验比较每个时间点上不同组之间的温度和压力变化。实验3采用随机区组方差分析不同时间点及不同小鼠的呼吸频率和压力变化。P<0.05被认为具有统计学意义。
2 结果
2.1 整体体积描记箱内麻醉小鼠和死亡小鼠引起的温度及压力变化 在注入0.2 ml空气后,体积描记箱内压力迅速上升至1.06 mmHg并保持水平不衰减。图1A显示,当麻醉小鼠置于体积描记箱,在6 min内箱内温度从(19.94±0.06)℃升高至(21.14±0.20)℃,而死亡小鼠温度从(19.95±0.04)℃升高至(21.12±0.16)℃。二者引起的温度升高均大约为1.2℃,且在每分钟的观察点,两组温度之间均无显著性差异(P>0.05)。图1B显示,麻醉小鼠引起的体积描记箱内基线压在6 min内从0 mmHg升高至(2.710±0.428)mmHg,而死亡小鼠的基线压增加为(2.671±0.377)mmHg。在每分钟的观察点,二者引起的压力变化均无显著性差异(P>0.05)。
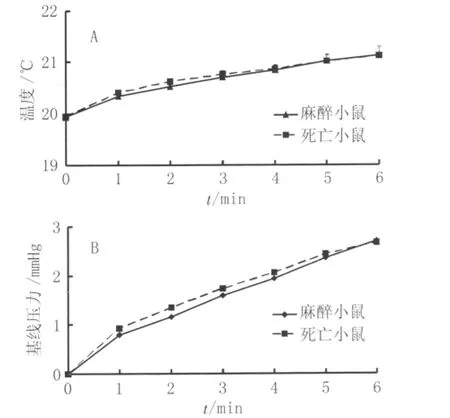
图1 整体体积描记箱内麻醉小鼠和死亡小鼠引起的温度和压力变化曲线Fig.1 Temperature and pressure changes inside whole body plethysmograph generated from anesthetized mice and dead mice
2.2 双室体积描记箱内温度和压力变化 躯体室的温度在20 min内从(19.05±0.26)℃增加至(20.97±0.18)℃,在每个时间观察点上均显著高于头室(P<0.001),后者从(19.05±0.26)℃升高至(19.14±0.34)℃。其中在14 min的观察点,躯体室及头室内温度达到高峰,分别较起始温度增加2.01℃和0.41℃。在4 min的观察点,躯体室的温度较起始温度增加1.03℃,为温度升幅最大时间点,升幅达51.32%。躯体室的基线压,在20 min内升高(5.554±0.224)mmHg,在每个时间观察点上均显著高于头室(P<0.001),后者20 min升高(0.627±0.552)mmHg(图2B)。
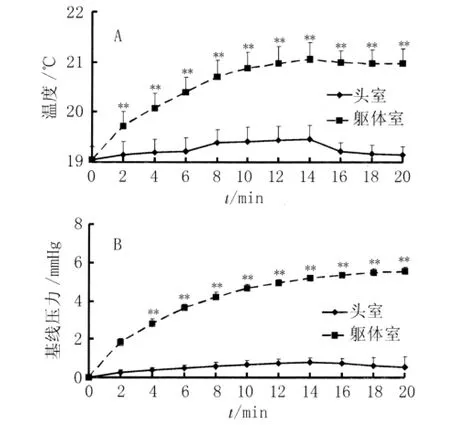
图2 头室和躯体室内温度和压力变化曲线Fig.2 Temperature and pressure changes inside head chamber and body chamber
2.3 密封室及开放室内小鼠呼吸频率和压力变化幅度 小鼠放置于密封室内,其呼吸频率由初始的(125.04±22.39)次/min迅速上升至(168.45±36.37)次/min(图3A),随机区组方差分析的统计数据显示在不同的时间观察点上小鼠的呼吸频率存在显著性差异(F=4.751,P<0.001)。而不同小鼠间随机区组因素的F值为26.238,P<0.001,提示随机区组设计良好。小鼠呼吸引起的压力变化幅度呈逐渐下降趋势,由最高的(1.090±0.245)mmHg逐渐下降至(0.883±0.168)mmHg(图3B)。在不同时间观察点之间亦存在显著性差异(F=2.535,P=0.009)。不同小鼠间压力幅度的随机区组因素的F值为32.770,P<0.001,提示随机区组设计良好。在开放室内,小鼠的呼吸频率在120次/min左右,最低为(115.74±26.19)次/min,最高为(129.30±40.10)次/min(图3A),小鼠的呼吸频率在不同时间观察点之间无显著性统计学差异(F=0.472,P=0.915)。随机区组设计数据显示不同小鼠间F值为63.389,P<0.001,提示随机区组设计良好。小鼠呼吸时压力变化的振幅在1 mmHg左右,最低为(0.980±0.178)mmHg,最高为(1.032±0.231)mmHg(图3B),不同时间观察点间比较无显著性统计学差异(F=1.396,P=0.192)。随机区组设计在压力幅度的统计数据显示不同小鼠间F值为370.964,P<0.001,提示随机区组设计良好。
3 讨论
1868 年,Bert[13]首先提出体积描记法概念和操作原理与步骤,并将其用于科学实验。随后,经学者们进一步改进[14-15],使其更适合于小动物呼吸生理的测试。
当用体积描记法测量小鼠的呼吸生理参数时,假设描记箱内的压力为Pb,容量为Vb,吸气前描记箱内温度为Tb;假设呼气后描记箱内压力为Pe,Vi为吸入气体体积,Ve为呼出气体体积,Te为一次呼吸后描记箱内温度。这样,在一次呼吸后,根据玻义耳定律公式:

当 Tb为 20℃,Te是 21℃,而 Pb为 760 mmHg,则Pe将可以计算出:
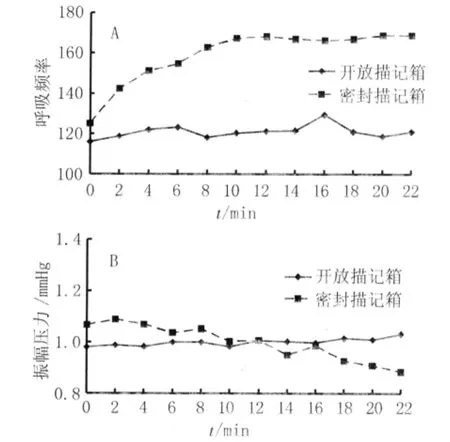
图3 密封室及开放室内小鼠呼吸频率和压力幅度变化曲线Fig.3 Changes curve of respiratory frequencies and amplitudes of pressure of mice in the sealed head-out plethysmograph and open head-out plethysmograph
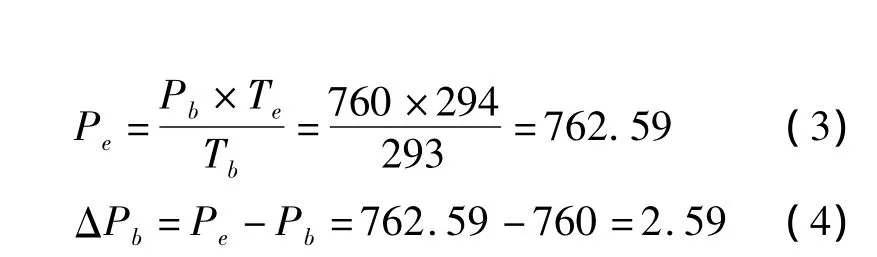
从公式4可知,当温度升高1℃,描记箱内压力将升高约2.6 mmHg。
体积描记法按照小动物放置的位置不同,可分为整体体积描记法和双室体积描记法。而按照测试物理原理的不同,又可分为压力型体积描记法[16]和流量型体积描记法[17]。由于气体流量信号远小于压力信号,对传感器精确度要求高,因此有不少学者利用压力型体积描记法进行小动物呼吸生理相关实验。
当用压力型体积描记法测量小动物呼吸生理参数时,在室温条件下,由于描记箱内空气低于小动物体温,动物体表的热量将辐射至描记箱内空气,因此空气的温化过程在动物肺外即体积描记箱内也同样存在。实验1的结果显示,描记箱内温度在实验开始6 min内持续上升,并使压力曲线的基线保持同步上升。Lundblad的研究发现[18],当用器械拨弄小动物的皮毛使热量加速释放时,描记箱内压力加速上升。这说明动物体温对于动物所在体积描记箱内压力产生显著影响,与理论部分的方程式推导结果一致。麻醉动物在体积描记箱内,其呼吸运动本身涉及胸廓及腹部的肌肉运动,这些运动将产生热量。本研究测量并比较了麻醉小鼠和死亡小鼠对于整体体积描记箱内温度和压力的作用,结果提示二者均使描记箱内温度上升,数据十分接近。死亡小鼠去除了肌肉运动这一影响因素,因此麻醉小鼠所在的体积描记箱内温度变化主要来源于小鼠的体温,而并非呼吸运动本身。
除体温因素、呼吸所涉及肌肉运动外,由于小动物呼出气体的温度亦高于动物周围的空气,故当温度高的呼出气体与温度低的描记箱内空气混合后,将使后者温度上升,从而导致描记箱内压力上升。实验2的数据显示头室内温度及躯体室内的温度均上升,但前者小于后者。有学者[9]使用设备将头室内空气以固定流量向外抽出并泵入同等流量的外界空气,使头室内空气的空气条件保持与实验前一致。由于躯体室内温度变化远高于头室,因此在使用压力型双室体积描记箱测量小动物呼吸生理参数时,双向气流交换更应在躯体室进行而非仅局限于头室。
本实验3观察了密封室内小鼠的呼吸频率及呼吸运动产生的压力变化幅度,发现其呼吸频率在所观察的22 min内逐渐上升,而压力变化的幅度逐渐下降。同样的过程在开放室内并不存在。开放室定期向大气开放,室内压力保持与大气相近,而不是实验1和2中保持持续上升趋势。实验结果提示小鼠体温使箱内上升的气体压力,能反作用于小鼠的呼吸运动,使其呼吸频率增加,潮气量下降。因此,我们在用压力型体积描记法较长时间内测量小动物肺功能,尤其是频率和潮气量等数据时,必需定期开放描记箱内气体与外界大气相通,或者直接使用流量型体积描记法测量,以避免升高的基线压影响测量结果。
小鼠的体温显著影响压力型整体体积描记箱内压力变化。压力式双室体积描记法测量小鼠呼吸生理参数时,头室及躯体室的温度和基线压力均呈上升趋势,但前者的变化过程低于后者。而在压力型体积描记箱内,升高的基线压力反过来作用并影响其中的小鼠的呼吸频率和潮气量。
[1]RIBAS-SALGUEIRO J L,MATARREDONA E R,SARMIENTO M,et al.Respiratory response to systemic inhibition of the Na+/H+exchanger type 3 in intact rats [J].Respir Physiol Neurobiol,2009,165(2-3):254-260.
[2]AMANO K,FUJII M,ARATA S,et al.DSCAM deficiency causes loss of pre-inspiratory neuron synchroneity and perinatal death [J].J Neurosci,2009,29(9):2984-2996.
[3]SOKOLOWSKA B,REKAWEK A,JOZWIK A.Respiratory responses to acute intermittent hypoxia and hypercapnia in awake rats[J].J Physiol Pharmacol,2008,59(Suppl 6):S659-S667.
[4]HOYMANN H G,WOLLIN L,MULLER M,et al.Effects of the phosphodiesterase type 4 inhibitor roflumilast on early and late allergic response and airway hyperresponsiveness in Aspergillusfumigatus-sensitized mice [J].Pharmacology,2009,83(3):188-195.
[5]MITZNER W,TANKERSLEY C.Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography[J].Am J Respir Crit Care Med,1998,158(1):340341 .
[6]POLIANSKIJM, BRUN-PASCAUD M C,JELAZKO P R,et al.Ventilation in awake rats with permanent arterial catheters[J].Comp Biochem Physiol A Comp Physiol,1984,77(2):319-324.
[7]KANAMARU M,HOMMA I.Compensatory airway dilation and additive ventilatory augmentation mediated by dorsomedial medullary 5-hydroxytryptamine 2 receptor activity and hypercapnia[J].Am J Physiol Regul Integr Comp Physiol,2007,293(2):R854-860.
[8]AGRAWAL A,RENGARAJAN S,ADLER K B,et al.Inhibition of mucin secretion with MARCKS-related peptide improves airway obstruction in a mouse model of asthma[J].J Appl Physiol,2007,102(1):399-405.
[9]FLANDRE T D,LEROY P L,DESMECHT D J.Effect of somatic growth,strain,and sex on doublechamber plethysmographic respiratory function values in healthy mice[J].J Appl Physiol,2003,94(3):1129-1136.
[10]AMDUR M O,MEAD J.Mechanics of respiration in unanesthetized guinea pigs[J].Am J Physiol,1958,192(2):364-368.
[11]HONG W J,SHEN H H,XU W H(洪武军,沈华浩,徐卫华).Relationship between measurements of thoracic inflating volume and tidal volume by pressure plethysmography in mice[J].Journal of Zhejiang University:Medical Sciences(浙江大学学报:医学版),2008,37(3):257-260.(in Chinese)
[12]XU W H(徐卫华).Measurement of differential values of inhaled volumes and exhaled volumes in mice.[J].Journal of Zhejiang University:Medical Sciences(浙江大学学报:医学版),2010,39(3):325-328.(in Chinese)
[13]BERT P.Changements de pression de l'air dans la poitrinependantles deux temps de l'acte respiratoire[J].Cr Soc Biol,1868,20:22-23.
[14]DRORBAUGH J E,FENN W O.A barometri c method formeasuring ventilation in newborn infants[J].Pediatrics,1955,16(1):8187 .
[15]EPSTEIN M A,EPSTEIN R A.A theoretical analysis of the barometric method for measurement of tidal volume [J].Respir Physiol,1978,32(1):105-120.
[16]OYAMADA Y,MURAI M,HARADA N,et al.Age-dependent involvement of ATP-sensitive potassium channel Kir6.2 in hypoxic ventilatory depression ofmouse [J].Respir Physiol Neurobiol,2008,162(1):80-84.
[17]CUMMINGS K J,KALF D,MOORE S,et al.Superoxide dismutase-1 influences the timing and post-hypoxic stability of neonatal breathing[J].Adv Exp Med Biol,2008,605:133-138.
[18]LUNDBLAD L K,THOMPSON-FIGUEROA J,LECLAIR T, et al. Thoracic gas volume measurementsin paralyzed mice [J].Ann Biomed Eng,2004,32(10):1420-1427.

