脂微球前列腺素E1对控制性降压患者动脉氧分压及肺内分流影响
姜天乐,赵斌江
(北京世纪坛医院麻醉科,北京,100038)
控制性降压为手术操作创造良好条件,减少失血[1-3]。控制性降压常用药物硝普钠在对全身血管扩张同时对肺血管也产生影响,在通气条件不变下使通气/血流比值发生变化,肺内分流也发生改变,导致动脉血氧分压降低[4-6]。本研究拟观察脂微球前列腺素E1在硝普钠控制性降压鼻内窥镜手术期间对动脉氧分压及肺内分流影响,从而进一步改善硝普钠控制性降压安全性。
1 资料与方法
1.1 一般资料
择期行鼻内窥镜手术患者40例,ASAⅠ、Ⅱ级,年龄18~50岁,体重50~75 kg,心、肺功能未见异常。分为脂微球前列腺素E1组(P组)和对照组(C组),每组20例。P组持续静脉泵注脂微球前列腺素E1(凯时,北京泰德制药有限公司)2 ng/(kg·min),C组以同样容积速率泵入生理盐水,在气管插管完成后开始用药,术毕时停药。
1.2 麻醉方法
术前30 min肌注地西泮10 mg、阿托品0.5 mg。入室后右桡动脉置管测压,右颈内静脉置管至右心房水平。诱导静注芬太尼2 μ g/kg、异丙酚2.5 mg/kg及维库溴铵0.1 mg/kg,气管插管后机械通气,潮气量8~10 mL/kg,吸呼比1:2,呼吸频率 12次/min,气道压维持 12~15 cmH20。吸入异氟醚维持麻醉,异氟醚呼气末浓度为1.2%~1.5%(MAC维持1.1~1.2),FiO2=90%。
1.3 监测指标
术中持续监测有创平均动脉压(MAP)、中心静脉压(CVP)、ECG、呼气末二氧化碳浓度、麻醉气体浓度、脉搏血氧饱和度等。
1.4 数据采集
微量泵输注硝普钠行控制性降压,初始速率为1~ 3 μ g/(kg·min),使 MAP 降低 30%~40%,调整硝普钠输注速率,补充血容量,维持血压在此水平至手术结束。分别于输注硝普钠前,降压30、60 min,停止硝普钠输注复压后20 min时分别取动脉血和右心房血(代替混合静脉血)做血气分析,计算肺内分流率(Qs/Qt)。计算公式如下:Qs/Qt=(CcO2-CaO2)/(CcO2-CvO2)×100%,其中CcO2为肺毛细血管末段血液氧含量=Hb×1.39×SaO2+(PaO2×0.031),其中PaO2=FiO2×(Pb-PH2O)-(PaCO2/0.8),Pb为大气压,PaO2为肺泡氧分压。CaO2为动脉血氧含量=(1.34×Hb×SaO2)+(0.0031×PO2);CvO2为静脉血氧含量=(1.34×Hb×SvO2)+(0.003 1×PO2)。取 Pb=760 mmHg,37 ℃时 PH2O为47 mmHg。
2 结 果
两组患者一般情况年龄、男女性别比、体质量、手术时间、补液量、失血量及尿量等无统计学差异(P>0.05)。
表1 两组患者一般资料(n=40,±s)

表1 两组患者一般资料(n=40,±s)
项目 C组 P组年龄(岁) 38.1±6.1 37.6±5.7性别(男/女) 13/7 12/8体重(kg) 60.5±7.9 61.2±8.1手术时间(min) 117.2±27.1 124.1±22.3补液量(mL) 1 450±210 1 550±170失血量(mL) 254±87 266±75尿量(mL) 300±184 340±162
两组患者在不同采样点组间MAP、HR无显著性差异(P>0.05);两组pH值在降压时均降低,复压后上升,但组间无显著性差异(P>0.05);与降压前比较,两组降压 30、60 min时 Qs/Qt升高,PaO2降低(P<0.05);组间比较降压30、60 min、复压后3点,P组 PaO2高于C组(P<0.05),而Qs/Qt仅在复压后P组高于C组(P<0.05);组内比较,C组复压后PaO2低于降压前(P<0.05),P组复压后PaO2与术前无明显差异(P>0.05)。
表2 两组患者控制性降压观察指标术(n=40,±s)
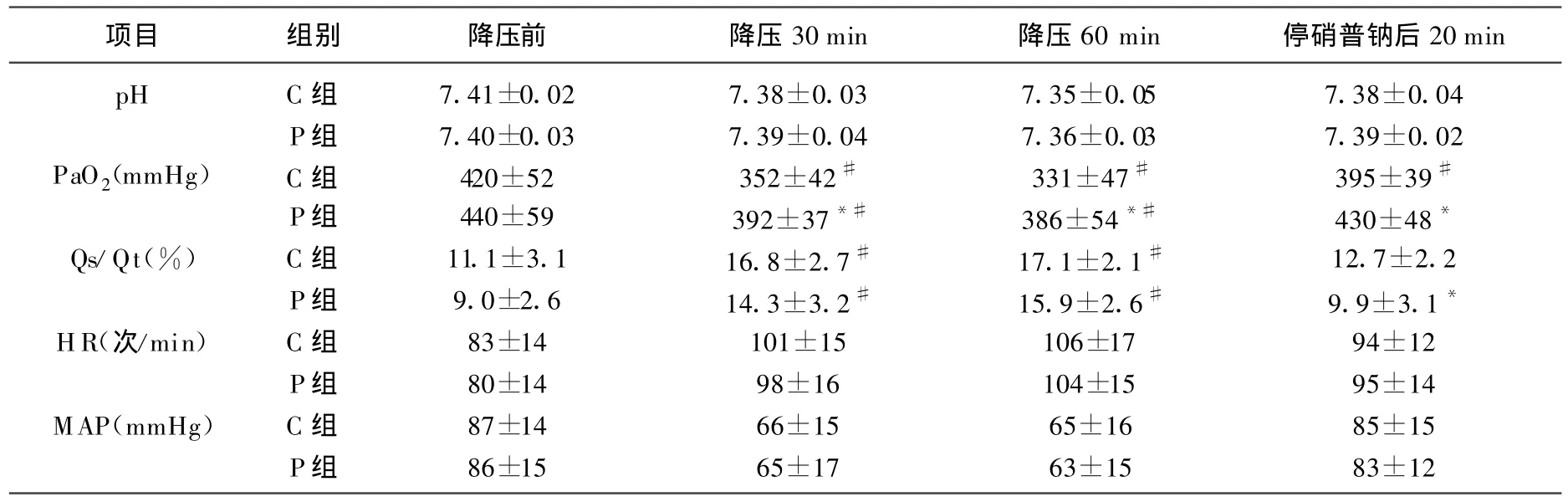
表2 两组患者控制性降压观察指标术(n=40,±s)
与C组比较,*P<0.05;与降压前比较,#P<0.05。
项目 组别 降压前 降压30 min 降压60 min 停硝普钠后20 min pH C组 7.41±0.02 7.38±0.03 7.35±0.05 7.38±0.04 P组 7.40±0.03 7.39±0.04 7.36±0.03 7.39±0.02 PaO2(mmHg) C组 420±52 352±42# 331±47# 395±39#P组 440±59 392±37*# 386±54*# 430±48*Qs/Qt(%) C组 11.1±3.1 16.8±2.7# 17.1±2.1# 12.7±2.2 P组 9.0±2.6 14.3±3.2# 15.9±2.6# 9.9±3.1*HR(次/min) C组 83±14 101±15 106±17 94±12 P组 80±14 98±16 104±15 95±14 MAP(mmHg) C组 87±14 66±15 65±16 85±15 P组 86±15 65±17 63±15 83±12
3 讨 论
硝普钠控制性降压期间肺内分流增加、动脉血氧分压下降,是由于一方面全麻后可发生肺部分萎陷,肺气体交换障碍,导致通气/血流比失调,肺内分流增加[7];另一方面硝普钠、吸入性麻醉药(异氟醚)可抑制缺氧性肺血管收缩[8]。实验结果两组均不同程度有肺内分流增加及动脉血氧分压下降。
抑制缺氧性肺血管收缩原因除了上述情况,还包括肺动脉高压、酸中毒、炎性介质作用等[9]。虽然脂微球前列腺素E1扩血管作用一定程度抑制缺氧性肺血管收缩,但其具有的选择性扩张肺动脉作用,能在一定程度上减轻其对肺分流的影响[10]。适当剂量脂微球前列腺素E1不影响体循环血压,改善心肌供血,提高心输出量和心指数,减少分流并改善动脉氧合[11]。硝普钠代谢产物弥散入组织,与线粒体氧化酶有高度亲和力,导致组织缺氧,介导炎性因子产生[12],脂微球前列腺素E1靶向性更宜分布于受损肺组织、在肺泡毛细血管浓度较高,能抑制围术期肺泡细胞炎性反应,降低血浆炎性细胞因子水平,减少肺毛细血管渗出和肺组织血管外含水量,从而改善肺内弥散和动脉氧合[13-14]。
本结果显示P组动脉氧分压在降压后高于C组,在复压后C组动脉氧分压低于降压前水平,而P组动脉氧分压与降压前无显著性差异,说明脂微球前列腺素E1改善硝普钠对控制性降压前后动脉氧分压影响。两组肺内分流量在降压时无显著性差异,降压后P组肺内分流量小于C组肺内分流量,可能是由于在停止硝普钠输注复压后脂微球前列腺素E1靶向性聚集继续发挥作用,改善肺内分流,提高氧合能力。
前列腺素E1大剂量才会扩张全身小动脉,小剂量仅改变肺血管。NAKAZAWA等报道单肺通气食管癌手术中以20 ng/(kg·min)静注前列腺素E1不会引起明显的系统性低血压,而脂微球前列腺素E1效能约为前列腺素E1的10倍[15],故本研究采用2 ng/(kg·min)速度静脉泵注脂微球效前列腺素E1。
综上所述,脂微球前列腺素E1可以改善硝普钠控制性降压所引起动脉氧合变化,对降压期间肺内分流和血流动力学无明显影响,复压后可改善肺内分流。
[1] 邵晓梅,方剑乔.控制性降压的脑保护机制研究进展[J].四川医学,2010(2):256.
[2] Weldon B C.Blood conservation in pediatric anesthesia[J].Anesthesiol Clin North America,2005,23(2):347.
[3] Dutton R P.The role of deliberate hypotension[J].Hosp Med,2005,66(2):72.
[4] Zall S,Kirno K,Milocco I,et al.Vasodilation with adenosine or sodium nitroprusside after coronary artery bypass surgery:a comparative study on myocardial blood flow and metabolism[J].Anesth Analg,1993,76(3):498.
[5] Jiao H N,Ren F,Cai H W,et al.Effect of controlled hypotension with different drugs combined with acute hypervolemic hemodilution on bleeding volume and gastrointestinal perfusion in nasal endoscopic surgery[J].Nan Fang Yi Ke Da Xue Xue Bao,2009,29(6):1163.
[6] Toyama S,Okada C,Ikeda N.Sodium nitroprusside-induced hypotension for pediatric orthopedic surgery[J].Masui,2009,58(2):174.
[7] van der Starre P J,Feld R J,Reneman R S.Ketanserin in the treatment of pulmonary hypertension aftervalvular surgery:a comparison with sodium nitroprusside[J].Crit Care Med,1989,17(7):613.
[8] 王家和,成文聪,张炳熙.鼻内窥镜手术患者硝普钠控制性降压期间肺内分流的变化[J].中华麻醉学杂志,2006,6:501.
[9] Ketabchi F,Egemnazarov B,Schermuly R T,et al.Effects of hypercapnia with and without acidosis on hypoxic pulmonary vasoconstriction[J].Am J Physiol Lung Cell Mol Physiol,2009,297(5):977.
[10] Taylor J,Park Y C,Hynds J M,et al.Liposomal prostaglandin E1(TLC C-53)in acute respiratory distress syndrome:a controlled,randomized,double-blind,multicenter clinical trial.T LC C-53 ARDS Study Group[J].Crit Care Med,1999,27(8):1478.
[11] Finan E,Mak W,Bismilla Z,et al.Early discontinuation of intravenous prostaglandin E1after balloon atrial septostomy is associated with an increased risk of rebound hypoxemia[J].J Perinatol,2008,28(5):341.
[12] Phillips L,Toledo A H,Lopez-Neblina F,et al.Nitric oxide mechanism of protection in ischemia and reperfusion injury[J].J Invest Surg,2009,22(1):46.
[13] Farrokhnia E,Makarem J,Khan Z H,et al.The effects of prostaglandin E1on interleukin-6,pulmonary function and postoperative recovery in oesophagectomised patients[J].Anaesth Intensive Care,2009,37(6):937.
[14] Aronoff D M,Lewis C,Serezani C H,et al.E-prostanoid 3 receptor deletion improves pulmonary host defense and protects mice from death in severe Streptococcus pneumoniae infection[J].J Immunol,2009,183(4):2642.
[15] Nakzawa K,Narumi Y,Ishikawa S,et al.Efect of prostaglandin E1on inflammatory responses and gas exchange in patients undergoing surgery for oesophageal cancer[J].Br J Anaesth,2004,93(2):199.

