强肝胶囊治疗非酒精性脂肪性肝纤维化的疗效及机制研究
古 赛,黄妙兴(重庆医科大学附属第一医院消化内科,重庆市 400016)
强肝胶囊治疗非酒精性脂肪性肝纤维化的疗效及机制研究
古 赛*,黄妙兴(重庆医科大学附属第一医院消化内科,重庆市 400016)
目的:研究强肝胶囊治疗非酒精性脂肪性肝纤维化的疗效及机制。方法:将104例非酒精性脂肪性肝纤维化患者随机分为2组,对照组40例进行基础护肝治疗,治疗组64例在对照组基础上加用强肝胶囊(1.2 g,tid)治疗。2组疗程均为6个月。观察治疗前后2组患者的肝纤维化谱(HA、PcⅢ、CⅣ、LN)、基质金属蛋白酶组织抑制因子-1(TIMP-1)及肝脏病理变化。采用逆转录多聚酶链反应(RT-PCR)检测结缔组织生长因子(CTGF)及细胞外基质前胶原α2(collα2)mRNA水平。免疫组化法检测CTGF的蛋白表达。结果:治疗组治疗后,其肝纤维化谱及肝脏病理均明显减轻,与治疗前比较差异有统计学意义(P<0.05),2组治疗后肝纤维化程度均明显改善,治疗组优于对照组,差异有统计学意义(P<0.05)。TIMP-1水平及CTGF、collα2mRNA水平以及CTGF蛋白表达水平,治疗组治疗后较治疗前显著下降,与对照组治疗后比较差异也有统计学意义(均P<0.05),而上述指标对照组治疗前后差异无统计学意义(P>0.05)。结论:强肝胶囊通过下调肝脏组织中CTGF的基因和蛋白水平,降低TIMP-1水平,下调collα2 mRNA的表达等多条途径而实现抗肝纤维化的功能,显示其为治疗非酒精性脂肪性肝纤维化的有效药物之一。
强肝胶囊;非酒精性脂肪性肝病;肝纤维化;机制
非酒精性脂肪性肝病(Nonalcoholic fatty liver disease,NAFLD)是遗传-环境-代谢应激相关性肝病,包括单纯性脂肪肝、脂肪性肝炎、脂肪性肝纤维化和肝硬化,其中肝纤维化是一切慢性肝病共同的病理学基础,是肝硬化的必经阶段。现已公认[1],肝纤维化是可逆性的病变,而肝硬化则难以逆转。目前,肝纤维化的发病机制尚未完全明了,也缺乏有效、安全的抗肝纤维化的治疗方案。本试验应用强肝胶囊治疗非酒精性脂肪性肝纤维化患者,观察其在抗肝纤维化方面的疗效,并探讨其作用机制。
1 资料与方法
1.1 一般资料
选择2008年7月-2009年10月我院住院及门诊NAFLD患者,经肝脏穿刺活检证实为肝纤维化S1~S3期的患者作为本试验的研究对象。纳入标准:参照2006年中华医学会肝脏病学分会脂肪肝和酒精性肝病学组会议制定的非酒精性肝病诊断标准[2]。所有研究对象均同意参加本研究,并签订知情同意书。排除标准:病理分期上无肝纤维化表现的S0期和出现肝硬化表现的S4期患者。入选的118例患者按随机数字表法分为2组,研究中,因各种原因未完成者14例(不能按时回访的3例,不愿再次肝穿刺活检的8例,患其他疾病退出的2例,加用试验以外的保肝药者1例),共104例完成本试验。治疗组64例,其中男性46例,女性18例,年龄33~58岁;对照组40例,其中男性28例,女性12例,年龄30~55岁。2组在年龄、性别、临床分期上比较,差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
2组均采用饮食控制,加强锻炼,给予一般护肝对症治疗,即护肝宁(重庆华邦制药股份有限公司)每次5片,tid,治疗组在此基础上加服强肝胶囊(石家庄东方药业有限公司)1.2 g,tid。2组疗程均为6个月。
1.3 观察指标
观察2组治疗前、后肝纤维化谱:玻璃酸(Serum hyaluronic acid,HA)、Ⅲ型前胶原肽(Amino-terminal propeptide of typeⅢcollagen,PcⅢ)、Ⅳ型胶原(Collagen,CⅣ)、层黏蛋白(Laminin,LN);基质金属蛋白酶组织抑制因子-1(Tissue inhibitor of metalloproteinase-1,TIMP-1);肝脏病理的变化;肝脏结缔组织生长因子(Connective tissue grow th factor,CTGF)的基因蛋白表达及细胞外基质前胶原α2(Ⅰ)(collα2)的基因表达。
1.4 仪器与试剂
肝纤维化谱试剂盒购于北京北方生物技术研究所,采用放射免疫法检测,仪器为DFM-96型多管放射免疫计数器。TIMP-1检测采用双抗体“夹心”酶联免疫吸附法(ELISA)检测[3]。CTGF及collα2检测试剂盒购自武汉博士德生物工程有限公司。
1.5 检测方法
肝纤维化谱:清晨空腹采集静脉血5m L,分离血清,放射免疫法检测肝纤维化谱。
TIMP-1检测:清晨空腹采集静脉血5m L,常温下放置30 min,待其凝固后,1000 rmp·m-1离心10min,取血清,参照文献[3]用ELISA检测。
肝脏总RNA提取参照TriZol法提取,反转录酶-聚合酶链锁反应(RT-PCR)按试剂盒操作步骤操作,PCR引物的设计和合成,全部的序列均在美国生物医学中心基因库中检索合成。经PCR扩增后,采用琼脂糖凝胶电泳检测扩增产物,并用Imagemaster VDS软件分析基因表达水平。
免疫组织化学法采用SABC法。结果判读:以细胞浆中出现棕黄色颗粒或团块判断为阳性细胞,图像分析采用M IAS医学分析系统进行图像半定量分析,随机选取每张切片5个视野测定阳性细胞面积比。
参照文献[4]方法行肝穿刺活检,采用2000年全国病毒性肝炎防治方案中的肝纤维化分期标准(肝纤维化分为S0~S4期),由指定的有经验的病理教授阅片。
1.6 疗效判断标准
按中华肝脏病学会肝纤维化学组达成的共识[5],采用纤维化半定量计分系统(SSS),肝组织活检肝纤维化SSS评分较治疗前下降≥2分者为有效。凡未达到有效标准者为无效。
1.7 统计学方法
2 结果
2.1 2组肝纤维化谱及TIMP-1比较
2组治疗前、后肝纤维化指标(HA、PcⅢ、CⅣ、LN)及TIMP-1治疗前、后检测结果比较详见表1。
由表1可见,治疗后治疗组HA、PcⅢ、CⅣ、LN均较治疗前下降(P<0.01),而对照组下降不明显(P>0.05),2组比较差异有统计学意义(P<0.01)。治疗后治疗组TIMP-1明显下降(P<0.01),而对照组下降不明显(P>0.05),2组比较差异有统计学意义(P<0.01)。
2.2 肝脏病理检查
2组肝脏病理检查肝纤维化疗效比较见表2。
治疗组有效率为56.3%[95%可信区间(95%CI):44.1%~68.5%],对照组有效率为15.0%(95%CI:6.0%~30.0%),2组差异有统计学意义(χ2=17.40,P<0.000 1)。
表1 2组治疗前后肝纤维化指标及TIMP-1比较(μg·L-1,±s)Tab 1 Com parison of the hepatic fibrosis indicators and TIMP-1 between 2 groupsbefore and after treatmen(tμg·L-1,±s)
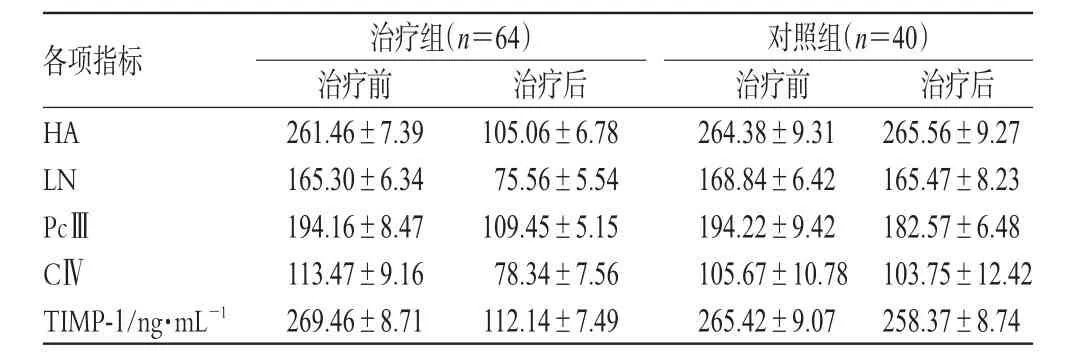
表1 2组治疗前后肝纤维化指标及TIMP-1比较(μg·L-1,±s)Tab 1 Com parison of the hepatic fibrosis indicators and TIMP-1 between 2 groupsbefore and after treatmen(tμg·L-1,±s)
各项指标HA LN PcⅢCⅣTIMP-1/ng·mL-1治疗组(n=64)治疗前261.46±7.39 165.30±6.34 194.16±8.47 113.47±9.16 269.46±8.71治疗后105.06±6.78 75.56±5.54 109.45±5.15 78.34±7.56 112.14±7.49对照组(n=40)治疗前264.38±9.31 168.84±6.42 194.22±9.42 105.67±10.78 265.42±9.07治疗后265.56±9.27 165.47±8.23 182.57±6.48 103.75±12.42 258.37±8.74

表2 2组治疗前后肝纤维化分期疗效比较(n)Tab 2 Comparison of the effect of stage of hepatic fibrosis between 2 groups before and after treatment(n)
由表2可见,与治疗前比较,强肝胶囊治疗后治疗组肝纤维化分期具有一定程度的改善(P<0.05),而对照组治疗后改善不明显(P>0.05)。
治疗前、后肝活检肝纤维化分期及病理组织HE染色图见图1。
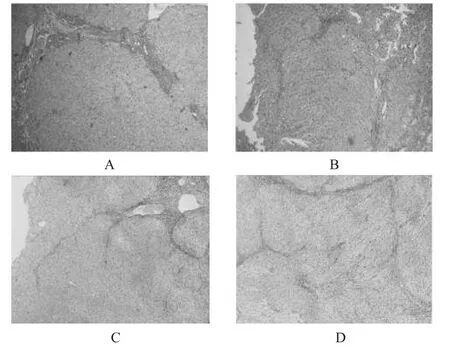
图1 2组治疗前后肝脏组织切片HE染色图像A:治疗组治疗前(4×10倍);B:治疗组治疗后(4×10倍);C:对照组治疗前(4×10倍);D:对照组治疗后(4×10倍)Fig 1 Hepatic tissue slice in 2 groups before and after treatmentA:before treatmentof treatmentgroup(4×10 time);B:after treatmentof treatmentgroup(4×10 time);C:before treatmentof control group(4×10 time);D:after treatmentof controlgroup(4×10 time)
由图1(A)、图1(B)可见,治疗组肝纤维化程度由治疗前S3期下降为治疗后的S2期,肝纤维化程度明显改善,由图1(C)、图1(D)可见,对照组治疗前、后肝活检结果纤维化程度无明显改变,均为S2期。
2.3 RT-PCR基因检测
2组治疗前、后CTGF及collα2mRNA比较见表3。
由表3可见,治疗组治疗后CTGF及collα2mRNA表达较治疗前均明显下降(P<0.01),而对照组治疗后各指标无明显变化(P>0.05),2组治疗后比较,CTGF及collα2mRNA表达差异均有统计学意义(P<0.01)。
表3 2组治疗前后CTGF及collα2m RNA的比较(±s)Tab 3 Com paresion of CTGF and collα2 m RNA between 2 groups before and after treatment(±s)

表3 2组治疗前后CTGF及collα2m RNA的比较(±s)Tab 3 Com paresion of CTGF and collα2 m RNA between 2 groups before and after treatment(±s)
各项指标CTGF collα2治疗组(n=64)治疗前1.57±0.58 0.94±0.34治疗后0.95±0.37 0.74±0.22对照组(n=40)治疗前1.53±0.45 0.96±0.27治疗后1.48±0.40 0.95±0.24
2.4 CTGF在肝脏组织中的表达与分布
运用免疫组化法对CTGF在治疗前、后半定量分析,结果见表4。
表4 2组治疗前后CTGF比较(±s)Tab 4 Comparesion of CTGF in between groups before and after treatment(±s)
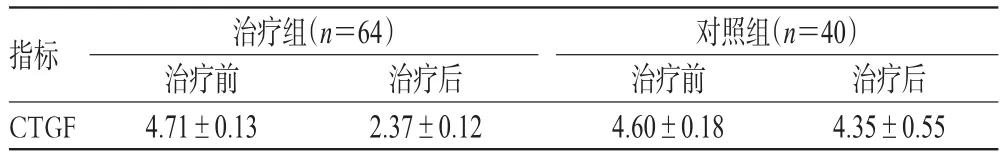
表4 2组治疗前后CTGF比较(±s)Tab 4 Comparesion of CTGF in between groups before and after treatment(±s)
指标CTGF治疗组(n=64)治疗前4.71±0.13治疗后2.37±0.12对照组(n=40)治疗前4.60±0.18治疗后4.35±0.55
由表4可见,治疗组治疗后CTGF表达较治疗前均明显下降(P<0.05),而对照组治疗后CTGF无明显变化(P>0.05),2组治疗后比较,CTGF表达差异有统计学意义(P<0.05)。
2组治疗前、后肝组织CTGF表达变化图像见图2。
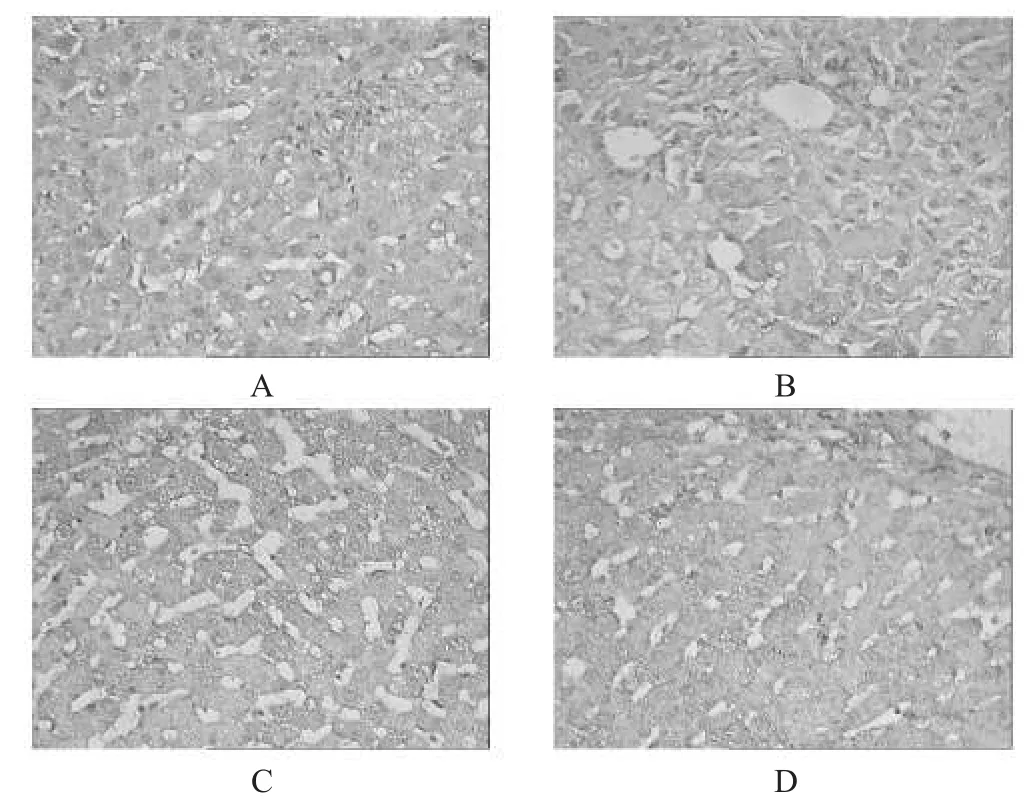
图2 2组治疗前后肝组织CTGF表达变化图像A:治疗组治疗前(10×40倍);B:治疗组治疗后(10×40倍);C:对照组治疗前(10×40倍);D:对照组治疗后(10×40倍)Fig 5 Comparison of CTGF in 2 groups before and aftertreatmentA:before treatment of treatment group(10×40 time);B:after treatment of treatment group(10×40 time);C:before treatment of control group(10×40 time);D:after treatmentof controlgroup(10×40 time)
由图2(A)和2(C)可见,CTGF表达在治疗前阳性细胞数较多,主要见于纤维化汇管区及纤维间隔里的梭状细胞类间质细胞和炎性细胞中,图2(B)和2(D)可见,强肝胶囊治疗后CTGF表达的阳性细胞数明显减少,而对照组则无明显减少。
2.5 不良反应
试验中未见由本试验药物所引起的不良反应及肝肾毒性发生。
3 讨论
肝纤维化是NAFLD发展中的关键阶段,是向肝硬化发展的重要病理过程,其机制为各种致炎因子引起肝内肝星状细胞(Hepatic stellate cell,HSC)激活、增殖和分泌细胞外基质(ECM)等胶原物质(HA、CⅣ、PCⅢ、LN)增加,使汇管区出现纤维间隔分割小叶,假小叶形成,肝正常结构被破坏,最后发展成肝硬化[6]。肝纤维化目前尚无确切有效的逆转手段,尽管现有许多西药抗肝纤维化治疗药物,但大多处于试验研究阶段,并且因其毒副作用较大而难以在临床推广应用,而中药具有多组分的物质基础和多途径与多靶点的作用特点,针对肝纤维化等复杂疾病可发挥综合治疗优势。
强肝胶囊是由茵陈、板蓝根、党参、山药、黄芪、当归、芍药、生地、丹参、郁金、山楂、神曲、秦艽、泽泻、甘草等药物组成。现代药理表明:党参、当归、丹参、黄芪具有保护肝细胞、减轻炎症坏死的作用;板蓝根、黄芪、茵陈具有提高免疫力、抗病毒的作用;秦艽、当归、黄精能拮抗CTGF;黄芪、当归、丹参、甘草能阻止贮脂细胞活化;郁金、白芍、山药、丹参合用可提高胶原酶活性;丹参、生地黄合用具有拮抗或清除自由基的作用。已有研究[7]表明,以上诸药共同作用于肝纤维化形成和/或降解的不同阶段或过程,从而有效地发挥抗纤维化和防止肝硬化的作用。
在本研究中,强肝胶囊治疗组治疗后HA、PcⅢ、CⅣ、LN均明显下降(P<0.05),而对照组治疗前后无明显差异(P>0.05),上述指标在治疗组与对照组治疗后比较,差异均有统计学意义(P<0.05)。这提示,强肝胶囊治疗6个月后可显著降低肝纤维化程度。此结果也被肝脏病理结果进一步证实。治疗组治疗后肝纤维化分期显著下降,肝纤维化程度的明显改善,差异有统计学意义(P<0.05),而对照组治疗后改善不明显,差异无统计学意义(P>0.05)。
组织金属蛋白酶(Matrixmetalloproteinase,MMP)是机体中参与细胞外基质(Extracellularmatrix,ECM)降解的重要蛋白酶,在机体正常情况下,发挥着重要的生理作用[8]。其中,在ECM降解过程中起关键作用的主要是MMP-1。研究[9]表明,在肝纤维化早期,胶原酶的活性变化不大或只有轻微增加,随着纤维化的发展,MMP的活性逐渐增强,至肝纤维化晚期,此活性逐渐降低。TIMP是MMP的特异性抑制剂,在肝纤维化时,肝组织内的TIMP-1表达增多,特异性地抑制MMP的活性,使ECM降解减少,促使纤维化形成,同时还对细胞增殖有促进作用。本研究中,强肝胶囊治疗组治疗后TIMP-1均明显降低(P<0.01),而对照组治疗前、后无明显差异,治疗组与对照组治疗后比较TIMP-1显著降低。这提示,强肝胶囊可通过降低TIMP-1活性,从而降低其对MMP活性的抑制,起到有效的抗纤维化作用。
CTGF是一个重要的促纤维化细胞因子[10],CTGF不仅可直接导致原代HSC活化、增殖及迁移,还能促进活化HSC合成及分泌ECM,同时肝胶原构成比发生变化,使Ⅰ、Ⅲ型胶原特别是I型胶原显著增加。在肝纤维化中,CTGF主要表达于汇管区和纤维间隔周围以及肝非实质细胞中。本研究中,肝纤维化患者可见CTGF强阳性表达,棕色颗粒主要集中于汇管区和纤维间隔周围,强肝胶囊治疗后,下调CTGFmRNA水平,从而使CTGF棕色颗粒明显减少,表明强肝胶囊可通过下调CTGF基因和蛋白表达,最终下调了作为主要细胞外基质的collα 2mRNA,达到抗纤维化的目的。
本研究显示,针对慢性非酒精性脂肪性肝纤维化患者应用强肝胶囊6个月,患者肝纤维化谱及其程度比对照组显著改善(P<0.05),对其机制研究中发现,强肝胶囊可能是通过下调CTGF和collα2mRNA,降低CTGF蛋白表达,降低TIMP-1活性,从而减少ECM的分泌,促进其降解,最终达到抗纤维化的作用。试验中尚未发现该药明显的不良反应及肝肾毒性。因此,强肝胶囊可作为治疗非酒精性脂肪性肝纤维化安全、有效的药物之一。
[1] Raszeja-Wyszom irska J,Lawniczak M,MarliczW,etal. Non-alcoholic fatty liver disease-new view[J].PolMerkur Lekarski,2008,24(144):568.
[2] 中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南[J].中华肝脏病杂志,2006,14(3):161.
[3] 金伯泉主编.细胞和分子免疫学试验技术[M].西安:第四军医大学出版社,2002:44-46.
[4] 中华医学会传染病与寄生虫病分会,肝病学分会.病毒性肝炎防治方案[J].中华肝脏病杂志,2000,8(8):324.
[5] 中华肝脏病学会肝纤维化学组.肝纤维化诊断及疗效评估共识[J].中华肝脏病杂志,2002,10(10):327.
[6] 王宝思.肝星状细胞与肝纤维化[J].中华肝脏病杂志,2000,8(8):197.
[7] 丁向春,马丽娜,张 栩.强肝胶囊对慢性肝病肝纤维化指标的影响[J].中国中西医结合消化杂志,2003,11(6):351.
[8] PoletteM,BirembautP.Membrane-typemetalloproteinases in tumor invasion[J].Int JBiochem Cell Biol,1998,30(11):1 195.
[9] 邵 彬,聂青和.基质金属蛋白酶组织抑制剂(TIMPs)的基础及临床研究现状[J].实用肝脏病杂志,2005,8(3):182.
[10] Williams EJ,Gaça MD,Brigstock DR,et al.Increased expression of connective tissue grow th factor in fibrotic human liver and in activated hepatic stellate cells[J].J Hepatol,2000,32:745.
Clinical Observation and M echanism of Qianggan Capsule in the Treatment of Nonalcoholic of Nonalcoholic Fatty Liver Fibrosis
GU Sai,HUANG M iao-xing(Dept.of Digestive System,The First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China)
OBJECTIVE:To study the efficacy and the mechanism of Qianggan capsule in the treatment of nonalcoholic fatty liver fibrosis.METHODS:104 patients w ith nonalcoholic fatty live fibrosis were random ly divided into treatment group(n=64)and control group(n=40).Both groups were given basic treatment of hepatoprotective drug for 6 months.Treatment group were treated w ith Qianggan capsule additionally.Hepatic fibrosis(HA、PcⅢ、CⅣ、LN),TIMP-1,the hepatocyte CTGF、collα2 mRNA and CTGF protein expression indicators of 2 groups before and after treatmentwere observed as well as liver biopsy.RESULTS:Hepatic fibrosis indicators and histopathology score were significant improved after experiment in Qianggan capsule group,and statistical results indicated significant difference between 2 groups(P<0.05).The expressions of CTGF、collα2 mRNA gene were inhibited and the expressions of CTGF protein were reduced after experiment in Qianggan capsule group,and statistical results indicated significant difference between 2 groups(P<0.05).CONCLUSION:Qianggan capsule can protecting hepatocyte,anti-fibrosis through cut down TIMP-1 level,and reduced CTGF、collα2 mRNA and the expressions of CTGF protein.It is a suitable drug in the treatment of nonalcoholic fatty liver fibrosis.
Qianggan capsule;Nonalcoholic fatty liver disease;Hepatic fibrosis;Mechanism
R285.5
A
1001-0408(2011)36-3421-04
*副主任医师,副教授,博士。研究方向:脂肪性肝病。电话:023-67455522。E-mail:Saigu20042004@yahoo.com.cn
2011-05-17
2011-07-20)

