ZD6474对膀胱癌裸小鼠皮下移植瘤的影响
陈爱武
辽宁省沈阳市于洪区人民医院,辽宁沈阳 110141
近年来,恶性肿瘤的治疗观念由经验科学向循证医学、由细胞攻击模式向靶向性治疗模式转变,越来越多的学者应用向肿瘤区域定位传送药物的“靶向治疗”及“靶点治疗”。肿瘤靶向治疗分为2大类,一为肿瘤细胞靶向治疗,肿瘤细胞靶向治疗是利用肿瘤细胞表面的特异性抗原或受体作为靶向;二为肿瘤血管靶向治疗,利用肿瘤区域新生毛细血管内皮细胞表面的特异性抗原或受体起作用。血管靶向治疗与肿瘤细胞靶向治疗相比,不仅提高了局部肿瘤组织内的浓度,给药后可以迅速高浓度地积聚在靶标部位[1]。本文通过建立膀胱癌裸鼠皮下移植瘤,探讨ZD6474的抗肿瘤作用,报道如下:
1 材料与方法
1.1 动物与药品
5~6周龄BALB/c裸鼠购自北京华阜康生物科技股份有限公司;人膀胱移行细胞癌E-J细胞株由中国医科大学药理教研室提供,ZD6474标准品购自深圳市明博林生物科技有限公司。
1.2 方法
1.2.1 实验分组
将接种E-J细胞分为5组,每组6只,并分别于接种后第 7、14、21、28、35 天,测量动物体重及行 MRI检查,测量肿瘤细胞直径。
阴性对照组;实验组 A[0.5 mg/(kg·d)];实验组 B[3 mg/(kg·d)];实验组 C[7 mg/(kg·d)];实验组 D[10 mg/(kg·d)];实验组将ZD6474添加到饮水中灌胃。
1.2.2 荷人膀胱癌原位移植瘤动物模型的建立
首先使用的胰酶(0.25%)对培养到对数生长期的E-J细胞在37℃的温度下消化,加入D-Hanks液调整细胞浓度至1.0×107个/ml。裸小鼠麻醉后仰卧位固定、消毒。切开腹壁牵出膀胱,压迫膀胱排出尿液。用穿刺针穿刺进入膀胱腔内,针尖轻划黏膜造成损伤,然后向腔内注入E-J细胞悬液200 μl,使用微量止血钳固定裸小鼠尿道3~5 min,确定无含有肿瘤细胞的尿液外溢后停止,并缝合腹壁切口。
所有裸小鼠置于SPF级动物实验室饲养,分别于接种后第 7、14、21、28、35 天测量动物体重及行 MRI检查, 测量肿瘤细胞直径。
1.3 统计学处理
应用SPSS 15.0统计软件进行统计学分析,裸鼠体重、肿瘤直径变化采用重复测量数据方差分析。
2 结果
实验期间,所有裸鼠健康状况均可,其体重变化各组比较差异无统计学意义(P>0.05),见表1,表明塞来昔布处理对裸鼠一般状况及体重无明显影响。
表1 裸鼠体重变化情况(±s,g)

表1 裸鼠体重变化情况(±s,g)
注:与阴性对照组比较,*P<0.05
组别 0 7 d 12.3±1.7 12.2±1.9 12.4±1.7 11.9±1.9 12.4±1.7阴性对照组实验组[0.5 mg/(kg·d)]实验组[3 mg/(kg·d)]实验组[7 mg/(kg·d)]实验组[10 mg/(kg·d)]18.3±2.2 18.1±2.0 17.9±1.9 17.8±1.9 18.3±1.9 14 d 24.3±2.6 24.2±2.8 24.5±2.9 23.9±2.7 23.8±2.6 21 d 29.8±1.9 29.7±2.0*29.9±1.9 29.6±2.0 29.8±2.1 28 d 33.9±2.2 33.6±2.0 33.9±2.2 33.6±1.9 33.8±2.2 35 d 37.9±2.2 37.8±2.1 37.6±2.2 37.5±2.1 37.5±2.0
7 mg/(kg·d)组在给予 ZD6474 第 21 天时,肿瘤直径为(1.20±0.08) mm,与 3 mg/(kg·d)组比较差异有统计学意义;15 mg/(kg·d)组与 7 mg/(kg·d)相比,肿瘤直径(1.20±0.09) mm,差异无统计学意义,但是有2例死亡,尸体解剖示肝坏死,提示剂量过大肝中毒。见表2。
表2 裸鼠皮下移植瘤直径变化情况(±s,mm)
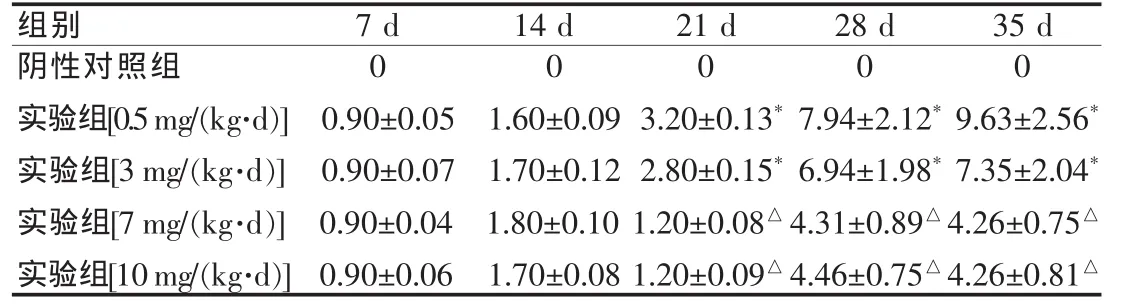
表2 裸鼠皮下移植瘤直径变化情况(±s,mm)
注:与阴性对照组比较,*P<0.05,△P<0.05
组别 7 d 14 d 0 0.90±0.05 0.90±0.07 0.90±0.04 0.90±0.06阴性对照组实验组[0.5mg/(kg·d)]实验组[3 mg/(kg·d)]实验组[7 mg/(kg·d)]实验组[10mg/(kg·d)]0 1.60±0.09 1.70±0.12 1.80±0.10 1.70±0.08 21 d 0 3.20±0.13*2.80±0.15*1.20±0.08△1.20±0.09△28 d 0 7.94±2.12*6.94±1.98*4.31±0.89△4.46±0.75△35 d 0 9.63±2.56*7.35±2.04*4.26±0.75△4.26±0.81△
3 讨论
血管内皮生长因子(vascularendothelialgrowthfactor,VEGF)是刺激血管形成最重要的生长因子之一,与内皮细胞表面上的特异性受体蛋白结合发挥其活性。绝大多数恶性肿瘤细胞均分泌VEGF,发生游走转移的肿瘤细胞在局部VEGF刺激生成局部血管是恶性肿瘤发生转移的重要机制,目前肿瘤血管靶向治疗主要针对VEGF。最早,Senger等于1994年从筛选的大鼠肿瘤细胞中发现VEGF-B[2],随后VEGF-A、PLGE、VEGF-H、VEGF-C、VEGF-D、VEGF-R 等陆续被发现。目前针对VEGF通路的靶向药物主要有:①VEGF Trap;②抗-VEGF;③抗-VEGFR;④VEGFR酪氨酸激酶抑制剂[3]。目前,贝伐单抗、IMC-1C11等已经在临床上广泛应用,在与卡铂、紫杉醇的联合应用的临床实验中,患者的治疗反应率、存活期、无疾病进展生存期均有明显增加[4-5],但是消化道反应、血栓、高血压、出血、蛋白尿、心脏毒性等副作用限制了其在临床的应用[6-7],而VEGFR酪氨酸激酶抑制剂越来越受到人们的重视。
ZD6474是一种合成的小分子酪氨酸激酶抑制剂,可同时作用于表皮生长因子受体(EGFR)、血管内皮生长因子受体(VEGFR)和酪氨酸激酶。不仅可抑制由EGFR诱导的肿瘤细胞增殖,发挥肿瘤细胞靶向治疗的作用,还可抑制肿瘤细胞的VEGFR-2阻断肿瘤血管内皮细胞的信号传导,从而抑制肿瘤血管生成,因此具有和肿瘤血管靶向治疗的双重作用。
本文采用荷人膀胱癌原位移植瘤动物模型评估ZD6474对膀胱癌裸鼠皮下移植瘤直径的影响,发现7 mg/(kg·d)组在给予ZD6474 第 21 天时,肿瘤直径为(1.2±0.08)mm,与 3mg/(kg·d)组比较差异有统计学意义;10 mg/(kg·d)组与 7 mg/(kg·d)组相比,肿瘤直径为(1.20±0.09)mm,差异无统计学意义,但有2例死亡,尸体解剖示肝坏死,提示剂量过大肝中毒。
ZD6474目前已经用于乳腺癌和肝癌的治疗,但是对膀胱癌的作用国内外尚无报道,本实验通过荷人膀胱癌原位移植瘤动物模型的实验,提示其对膀胱癌的抗肿瘤作用,开阔了思路,为临床上膀胱癌生物化疗的治疗模式提供了一定的理论基础。
[1]王鹰,李苏宜.抗肿瘤血管生成分子靶向治疗临床研究进展[J].东南大学学报,2007,26(6):476-480.
[2]Ferrara N.Vascular endothelial growth factor:basic science and clinical progress[J].Endocrine Reviews,2004,25(4):581-611.
[3]Tong RT,Boucher Y,Kozin SV,et al.Vascular normalization by vascular endothelial growth factor receptor-2 blockade induces a pressure gradient across the vasculature and improves drug penetration in tumors[J].Cancer Res,2004,64:3731-3736.
[4]He Y,Rajantie I,Hmonen M,et al.Preexisting lymphatic endothelium but not endothelial progenitor cells are essential for tumor lymphangiogenesis and lymphatic metastasis[J].Cancer Res,2004,64:3737-3740.
[5]Cudmore M,Ahmad S,AI-Ani B,et al.VEGF-E activates endothelial nitric oxide synthase to induce angiogenesis via cGMP and PKG-independent pathways[J].Biochem Biophys Res Commun,2006,345:1275-1282.
[6]Sandler AB,Gray R,Brahmer J.Randomized phase II/III trial of paclitaxel(p)plus carboplatin(c)with or without bevacizumab(NSC704865)in patients with advanced non-squamous non-small cell lung cancer(NSCLC):an Eastern Cooperative Oncology Group(ECOG)trial E4599[J].J Clin Oncol,2005,23:4-10.
[7]Jain R K,Duda D G,Clark J W,et al.Lessons from phase III clinical trials on anti-VEGF therapy for cancer [J].Nat Clin Pract Oncol,2006,3:24-40.

