精蛋白生物合成人胰岛素联合二甲双胍治疗2型糖尿病的疗效观察
刘 娅,唐金国
(重庆市渝北区人民医院内分泌科 401120)
精蛋白生物合成人胰岛素联合二甲双胍治疗2型糖尿病的疗效观察
刘 娅,唐金国
(重庆市渝北区人民医院内分泌科 401120)
目的观察精蛋白生物合成人胰岛素联合二甲双胍治疗2型糖尿病患者的临床疗效及其安全性。方法将51例2型糖尿病患者分为两组,精蛋白生物合成人胰岛素组(A组)25例,精蛋白生物合成人胰岛素联合二甲双胍组(B组)26例,两组分别治疗12周,并测量体质量、身高、空腹血糖(FBG)、餐后血糖(PPG)、血清胰岛素(FINS)、糖化血红蛋白(HbAlc)及血脂水平等,计算体质量指数(BMI)、胰岛素抵抗指数。结果A、B组FBG、餐后2 h血糖、HbAlc、胰岛素抵抗指数均明显降低(P<0.05);B组总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)均明显降低(P<0.05),而高密度脂蛋白胆固醇(HDL-C)增高(P<0.05);B组较A组血糖控制更佳,而低血糖发生率则不明显差别(P>0.05)。结论精蛋白生物合成人胰岛素联合二甲双胍是治疗2型糖尿病更安全、有效的治疗方案。
二甲双胍;糖尿病,2型;精蛋白生物合成人胰岛素;血糖
目前国际上普遍认为2型糖尿病患者的胰岛β细胞功能随病程的延长而进行性下降,致使2型糖尿病患者口服降糖药的降糖效果逐年降低,最终引起血糖和糖化血红蛋白(HbAlc)的控制长期不达标,导致各种慢性并发症的形成,增加患者的致残率及病死率。胰岛素治疗可使血糖水平迅速下降,减轻高糖对胰岛β细胞的毒害,使胰岛β细胞功能有一定恢复,故2型糖尿病患者在口服降糖药治疗不达标的情况下需开始胰岛素治疗[1]。基于这样的理论基础,现将本院2008年 3~10月门诊及住院收治的51例多种口服降糖药治疗效果仍不佳的2型糖尿病患者改用精蛋白生物合成人胰岛素或精蛋白生物合成人胰岛素联合二甲双胍治疗,现将其结果报道如下。
1 资料与方法
1.1 一般资料 纳入51例,为2008年3~10月本院门诊和住院的2型糖尿病患者,均符合1999年WHO推荐的糖尿病诊断标准[2]。在饮食控制和运动基础上,已用两种或两种以上口服降糖药治疗,血糖和HbAlc仍然不达标[空腹血糖(FBG)>7 mmol/L,HbAlc>7%]的2型糖尿病患者,近期无急性并发症,无心、肝、肾重要脏器功能不全。其中男 26例,年龄(59.3±10.4)岁;女 25例,年龄(58.8±14.6)岁;病程(6.9±3.4)年。两组治疗前性别比例、年龄、体质量、体质量指数(BMI)、FBG、餐后2 h血糖比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法 收集所有研究对象的病例资料,且患者均停用原口服降糖药,先测定 FBG、血清胰岛素(FINS)、HbAlc、血脂、餐后2 h血糖,并测量身高、体质量,计算BMI。将患者随机分为两组治疗:A组25例,应用精蛋白生物合成人胰岛素分别于早、晚餐前皮下注射治疗;B组26例,应用精蛋白生物合成人胰岛素分别于早、晚餐前皮下注射治疗并联合二甲双胍口服治疗。初次精蛋白生物合成人胰岛素剂量为0.4 IU/kg,以后根据FBG、餐后2 h血糖调整精蛋白生物合成人胰岛素及二甲双胍剂量。治疗12周后再测量体质量、身高,计算BMI,测定FBG、FINS、HbAlc、餐后2 h血糖及血脂。并记录治疗期间低血糖发生发生率、严重程度,以及夜间低血糖的发生率。低血糖定义为血糖小于或等于3.5 mmol/L,或出现低血糖症状。使用稳态模型评估法计算胰岛素抵抗指数(Homa-IR),Homa-IR=FBG×FINS/22.5评估胰岛素抵抗程度[3]。
1.3 统计学处理 使用SPSS13.0统计软件进行统计学处理,偏态变量均作自然对数转换后分析,计量资料以±s表示,两组间比较用t检验,多组间比较使用单因素方差分析,以P<0.05为差异有统计学意义。
表1 两组治疗前、后各项指标比较( ±s)
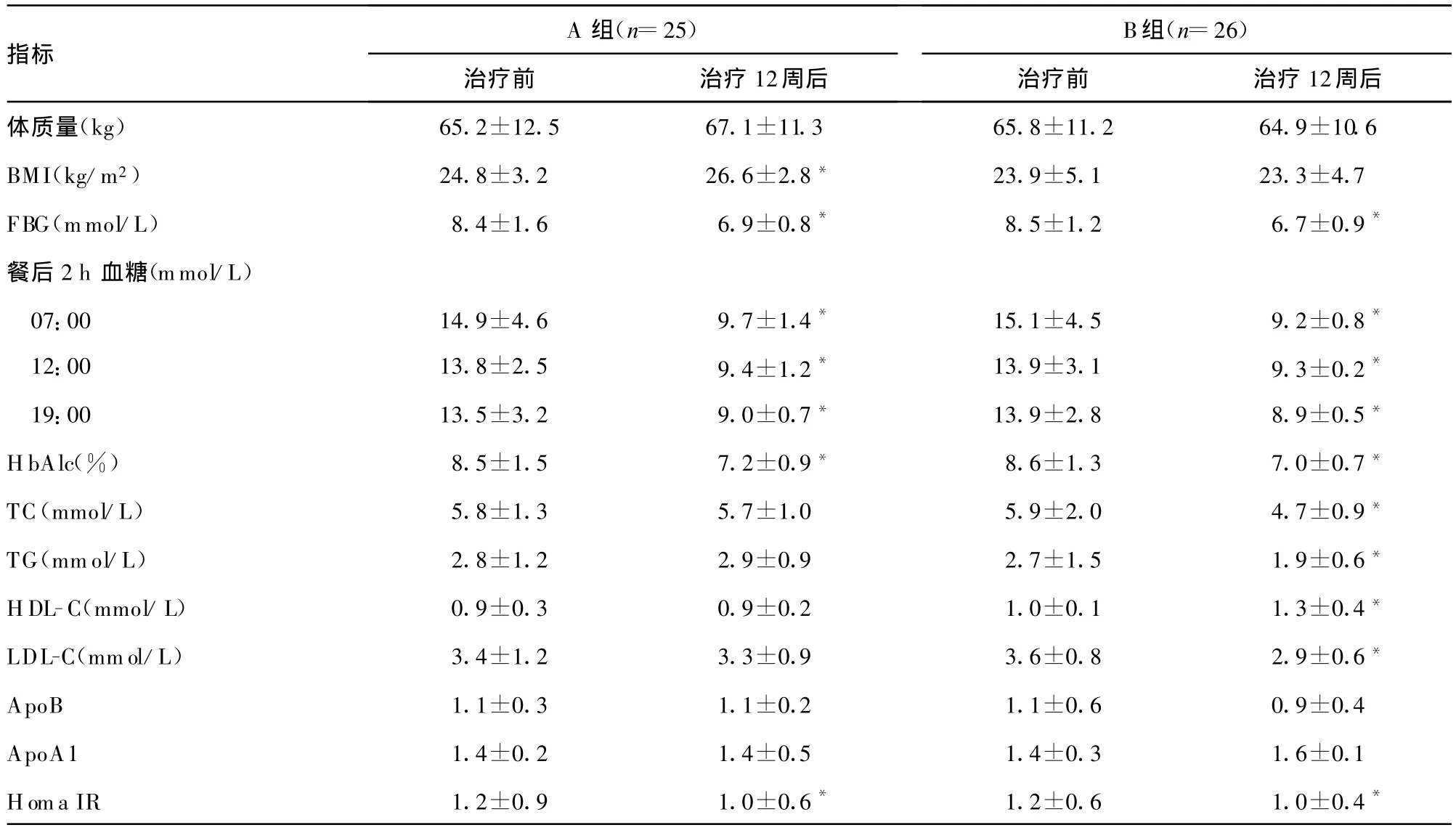
表1 两组治疗前、后各项指标比较( ±s)
*:P<0.05,与同组治疗前比较;Homa IR:对数转化后的数值。
A组(n=25)指标B组(n=26)治疗前 治疗12周后 治疗前 治疗12周后体质量(kg) 65.2±12.5 67.1±11.3 65.8±11.2 64.9±10.6 BMI(kg/m2) 24.8±3.2 26.6±2.8* 23.9±5.1 23.3±4.7 FBG(mmol/L) 8.4±1.6 6.9±0.8* 8.5±1.2 6.7±0.9*餐后2 h血糖(mmol/L)07:00 14.9±4.6 9.7±1.4* 15.1±4.5 9.2±0.8*12:00 13.8±2.5 9.4±1.2* 13.9±3.1 9.3±0.2*19:00 13.5±3.2 9.0±0.7* 13.9±2.8 8.9±0.5*HbAlc(%) 8.5±1.5 7.2±0.9* 8.6±1.3 7.0±0.7*TC(mmol/L) 5.8±1.3 5.7±1.0 5.9±2.0 4.7±0.9*TG(mmol/L) 2.8±1.2 2.9±0.9 2.7±1.5 1.9±0.6*HDL-C(mmol/L) 0.9±0.3 0.9±0.2 1.0±0.1 1.3±0.4*LDL-C(mmol/L) 3.4±1.2 3.3±0.9 3.6±0.8 2.9±0.6*ApoB 1.1±0.3 1.1±0.2 1.1±0.6 0.9±0.4 ApoA1 1.4±0.2 1.4±0.5 1.4±0.3 1.6±0.1 Homa IR 1.2±0.9 1.0±0.6* 1.2±0.6 1.0±0.4*
2 结 果
2.1 两组治疗前、后各项指标的变化 治疗12周后A组体质量及BMI较治疗前明显增加(P<0.05),而B组治疗后体质量及BMI增加不明显(P>0.05);B组的总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)及载脂蛋白 B(ApoB)水平均明显降低(P<0.05),但高密度脂蛋白胆固醇(HDL-C)和载脂蛋白A1(ApoA1)水平明显增高(P<0.05)。而A、B组FPG、餐后 2 h血糖、HbAlc水平、Homa IR值均明显降低(P<0.05),见表1。
2.2 胰岛素用量评估 两组精蛋白生物合成人胰岛素初始剂量均为0.4 IU/kg计算,以后按FBG与餐后2 h血糖进行调整。治疗初期,两组精蛋白生物合成人胰岛素用量比较差异无统计学意义(P>0.05)。治疗12周后,胰岛素用量,A组:23.7 IU/d;B组:18.5 IU/d,两组比较差异有统计学意义(P<0.05)。提示二甲双胍联合精蛋白生物合成人胰岛素治疗可以减少精蛋白生物合成人胰岛素的用量。
2.3 不良反应发生率 低血糖是精蛋白生物合成人胰岛素治疗中最常见的不良反应,两组低血糖发生率比较差异无统计学意义(P>0.05),且均为轻度低血糖,及时进食后缓解,无严重低血糖的发生。同时出现恶心3例,腹胀5例,服用二甲双胍1周后,以上症状基本缓解。无过敏反应及脂肪营养不良等发生。提示二甲双胍联合精蛋白生物合成人胰岛素治疗并不会增加低血糖的发生率。
3 讨 论
随着人民生活水平的提高以及生活方式的改变,糖尿病的发病率逐年增加,目前中国糖尿病的发病率约为5%,糖尿病患者人数仅次于印度。有关1型糖尿病的糖尿病控制及并发症试验研究和2型糖尿病的前瞻性糖尿病研究结果证实,严格控制血糖可以减少糖尿病患者慢性并发症的发生并降低死亡率[4-5]。2型糖尿病患者在生活方式干预及口服降糖药治疗的基础上,如果仍未达到较好的效果,可以联合胰岛素治疗。因而,选择合理的胰岛素治疗方案尤为重要。
精蛋白生物合成人胰岛素皮下注射后迅速吸收,满足了餐时胰岛素的需求,而且作用时间较长,满足了基础胰岛素的需求,故精蛋白生物合成人胰岛素能更好地控制全天血糖,减少低血糖的发生率。
二甲双胍通过提高外周组织(如肌肉、脂肪)对葡萄糖的摄取和利用,增加组织对胰岛素的敏感性;通过抑制糖异生和分解,降低过高的肝糖输出,延缓葡萄糖在肠道的吸收,同时可降低HbAlc、游离脂肪酸水平[6-8],又不刺激胰岛β细胞分泌胰岛素,不会导致胰岛β细胞过早衰竭。
本研究显示B组的 TC、TG、LDL-C、ApoB水平均明显降低(P<0.05),HDL-C及ApoA1水平明显增高(P<0.05),而A组并未发现相似的改变。考虑二甲双胍可能对血脂有一定的调节作用。国内外均有研究证实二甲双胍能降低TC、TG、LDL-C和 ApoB水平,升高HDL-C和 ApoA1水平[9-11]。
两组治疗12周后精蛋白生物合成人胰岛素用量均较治疗初明显减少。提示2型糖尿病患者口服降糖药治疗控制不佳,改用精蛋白生物合成人胰岛素治疗12周后,胰岛β细胞功能得到部分恢复,使胰岛素用量明显减少,这可能与高糖毒性解除,胰岛β细胞功能部分恢复有关[12`]。而B组治疗12周后胰岛素用量更少,考虑与二甲双胍增加组织对精蛋白生物合成人胰岛素的敏感性有关。
治疗期间,A、B组的低血糖发生率都很低,且无严重顽固性低血糖发生;A组治疗后体质量增加,而B组体质量无明显改变,考虑与二甲双胍减小体质量的作用有关。
综上所述,精蛋白生物合成人胰岛素联合二甲双胍治疗是治疗2型糖尿病安全、有效的治疗方案。
[1]Lebovitz HE.Treating hyperglycemia in type 2 diabetes:new goals and strategies[J].Cleve Clin J Med,2002,69(10):809-820.
[2]叶任高,陆再英.内科学[M].6版.北京:人民卫生出版社,2004:797.
[3]Matthews DR,Hosker JP,Rudenski AS,et al.Homeostasis model assessment:insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man[J].Diabetologia,1985,28(7):412-419.
[4]The Diabetes Control and Complications Trial Research Group.The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus[J].N Engl J Med,1993,329(14):977-986.
[5]UK Prospective Diabetes Study Group.Intensive blood glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes(UKPDS 33)[J].Lancet,1998,352(1931):837-853.
[6]Johansen K.Efficacy of metformin in the treatment of NIDDM[J].Diabetes Care,1999,22(1):33-37.
[7]Khutsoane D,Sharma SK,Almustafa M,et al.Biphasic insulin aspart 30 treatment improves glycaemic control in patients with type 2 diabetes in a clinical practice setting:experience from the present study[J].Diabetes Obes Metab,2008,10(3):212-222.
[8]胡茂清,吴文丽,罗玉,等.诺和锐 30联合二甲双胍治疗30例2型糖尿病患者的临床观察[J].四川医学,2008,29(7):842-844.
[9]Lalor BC,Bhatnagar D,Winocour PH,et al.Placebo-controlled trial of the effects of guar gum and metformin on fasting blood glucose and serum lipids in obese,type 2 diabetic patients[J].Diabet Med,1990,7(3):242-245.
[10]Schneider J.Effects of metformin on dipoproteinemla in noninsulin dependent diabetes mellitus[J].Diabet Metab,1991,17(3):185-190.
[11]张昌玉,席光明,庄茂友,等.二甲双胍对高脂蛋白血症患者血清载脂蛋白B及Al的影响[J].中华内分泌代谢杂志,2001,17(1):35-36.
[12]Boehm BO,Home PD,Behrend C,et al.Premixed insulin aspart 30 vs.premixed human insulin 30/70 twice daily:a randomized trial in type 1 and type 2 diabetic patients[J].Diabet Med,2002,19(5):393-399.
10.3969/j.issn.1671-8348.2011.06.036
B
1671-8348(2011)06-0599-03
2010-09-25
2010-12-13)
·临床研究·

